Журнал «Здоровье ребенка» 6 (57) 2014
Вернуться к номеру
Острый лейкоз у детей
Авторы: Вильчевская Е.В., Коломенская С.А., Марченко Е.Н. - Донецкий национальный медицинский университет им. М. Горького; Институт неотложной и восстановительной хирургии им. В.К. Гусака НАМН Украины, г. Донецк
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
В лекции представлены современные сведения об этиологии, патогенезе, клинических проявлениях, методах обследования и принципах лечения детей с острым лимфобластным лейкозом. Описано собственное клиническое наблюдение развития клинической картины острого лимфобластного лейкоза у ребенка 4 лет. Особенностями данного случая были поздняя диагностика заболевания и необоснованное использование стероидов в сочетании с жаропонижающими средствами, что привело к резистентности опухоли к лечению.
У лекції наведені сучасні відомості про етіологію, патогенез, клінічні прояви, методи обстеження та принципи лікування дітей із гострим лімфобластним лейкозом. Описано власне клінічне спостереження розвитку клінічної картини гострого лімфобластного лейкозу у дитини 4 років. Особливостями даного випадку були пізня діагностика захворювання та необґрунтоване призначення стероїдів у поєднанні з жарознижувальними засобами, що призвело до резистентності пухлини до лікування.
The lecture presents current data on the etiology, pathogenesis, clinical manifestations, observation methods and principles of treatment of children with acute lymphoblastic leukemia. own clinical observation of development of the acute lymphoblastic leukemia clinical picture in a child aged 4 years old has been described. This case is characterized by late diagnosis and inappropriate prescription of steroids in combination with antipyretic agents that led to tumor resistance to the treatment.
острый лейкоз, дети, клиника, диагностика.
гострий лейкоз, діти, клініка, діагностика.
acute leukemia, children, clinical picture, diagnostics.
Статья опубликована на с. 113-117
Острый лимфобластный лейкоз (ОЛЛ) (МКБ-10 — С91.0) — опухолевое заболевание системы крови, возникающее в результате злокачественной трансформации предшественников В- и Т-лимфоцитов [1]. Экспансия злокачественных клеток происходит из трансформированных гемопоэтических стволовых клеток, которые потеряли способность к дифференцировке и созреванию в зрелые лимфоидные клетки. Клон злокачественных клеток происходит из одной клетки, которая подверглась мутации. Это приводит к генетическим отклонениям в клетке и естественной селекции доминирующих мутантных субклонов [2].
Среди злокачественных новообразований кроветворной и лимфоидной тканей, занимающих половину всех злокачественных опухолей, на долю лейкозов в детском возрасте приходится 38–40 % [1]. Частота острого лимфобластного лейкоза у детей составляет 4 : 100 000 детского населения с соотношением мальчики/девочки 1,3 : 1 и пиком заболевания от 2 до 5 лет [1].
Причины, вызывающие поломку хромосом, разнообразны и складываются из наследственной предрасположенности, экзогенных и эндогенных факторов. Установлено, что в развитии лейкоза могут играть роль ионизирующая радиация, химические вещества, вирусы и бактерии [11], генетическая предрасположенность (наследственные синдромы с ненормальным количеством хромосом, дефектами в генах) [2]. Среди этих факторов наиболее частым является синдром Дауна, при котором риск развития ОЛ приблизительно в 20 раз выше, чем у детей без этого синдрома [2].
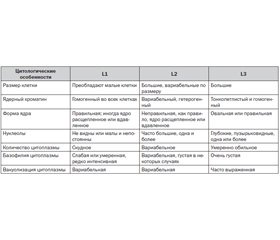
Основой современной классификации ОЛЛ является FAB-классификация (франко-американо-британская)[1], которая включает морфологические и цитохимические характеристики бластов (табл. 1).
Диагноз ОЛЛ устанавливают при наличии в пунктате костного мозга более 20 % бластов. Как видно из табл. 1, ОЛЛ по морфологическим критериям бластных клеток имеет 3 типа: L1 (85 % пациентов), L2 (14 %), L3 (1 %) [11].
Клиническая картина ОЛЛ обусловлена степенью инфильтрации костного мозга бластными клетками и экстрамедуллярным распространением процесса [2].
В клиническом течении ОЛЛ выделяют следующие периоды: предлейкозный, острый, ремиссии, рецидив и терминальный.
Клинические проявления ОЛЛ зависят от природы лейкозного клона, сроков установления диагноза и своевременности начала лечения.
На начальном этапе заболевания (предлейкозный период) могут отмечаться неспецифические симптомы: подъем температуры тела, снижение аппетита, нарастающая слабость, повышенная утомляемость, вялость. При исследовании периферической крови могут быть выявлены (но не всегда) анемия, гранулоцитопения, тромбоцитопения. Чаще эти изменения документируют при исследовании костного мозга [11].
Острый период характеризуется симптомами интоксикации, снижением аппетита, болями в костях, нарастанием анемии, появлением геморрагического синдрома (от петехий и гематом до различных кровотечений: носовых, желудочно-кишечных, почечных) [11]. Одним из частых симптомов является увеличение периферических лимфоузлов — подчелюстных, шейных, подмышечных, паховых. Они безболезненны, подвижны, не спаяны друг с другом и окружающими тканями [11]. Характерно увеличение печени и селезенки. Встречается язвенно-некротическое поражение слизистых оболочек в виде гингивита, стоматита, энтеропатии из-за лейкемической инфильтрации с кровоизлияниями и присоединением инфекции [1].
Поражение центральной нервной системы (ЦНС) происходит в виде менингеальной формы, менинго-энцефалической, энцефалической, миелитической, по типу полирадикулоневрита, эпидурита, диэнцефального синдрома и т.д. [2]. При поражении глаз определяется пролиферация лейкозных клеток в области сосудистой оболочки, сетчатки, соска зрительного нерва, передней камеры глаза и стекловидного тела [2]. При поражении легких в процесс вовлекаются альвеолярные перегородки, периваскулярные и перибронхиальные ткани, висцеральная и париетальная плевра [2]. У девочек при поражении яичников можно пальпировать плотное, малоподвижное образование в подвздошной области, при вовлечении в процесс матки отмечаются кровянистые выделения, в которых обнаруживаются бластные клетки [2]. У мальчиков может наблюдаться поражение яичек: чаще одностороннее, яичко плотное на ощупь, безболезненное, кожа над ним с цианотичным оттенком. Диагноз ставится по результатам цитологического изучения пунктата яичка.
Полной ремиссией считают отсутствие клинических проявлений заболевания при нормоклеточном костном мозге с количеством бластных клеток менее 5 % и нормальных показателях спинномозговой жидкости [1].
Рецидивом считают состояние, когда имеется возврат активной стадии заболевания после полной ремиссии и один из следующих признаков:
— количество бластов в костном мозге более 20 %;
— наличие экстрамедуллярных очагов поражения (ЦНС, половые железы и т.д.) при содержании бластных клеток в костном мозге менее 5 %;
— наличие 5 и более лейкозных клеток в 1 мкл ликвора.
Рецидив заболевания может иметь различную локализацию: изолированный костно-мозговой, экстрамедуллярный с поражением ЦНС, половых желез, кожи, орбиты, миндалины и т.д. Возможны также и комбинированные рецидивы [2].
Диагноз ОЛЛ устанавливается на основании жалоб, клинической картины, анамнеза заболевания, результатов объективного и дополнительных методов исследования при наличии в костно-мозговом пунктате более 20 % бластов с «провалом» созревания гранулоцитов. Для ОЛЛ характерно не только повышенное содержание бластных клеток, но и их анаплазия — наличие складчатости, фрагментаций, вдавлений, вакуолизации ядра и др. Помимо обнаружения опухолевых клеток лимфоидной линии кроветворения проводят и другие исследования — цитохимическое, цитогенетическое, молекулярно-биологическое и иммунофенотипирование [2].
При цитохимическом исследовании лейкозные лимфобласты дают отрицательную реакцию на пероксидазу, хлорацетатэстеразу и липиды. Для лимфобластов характерно гранулярное распределение материала в ШИК-реакции в виде пурпурных гранул по периферии цитоплазмы. Высокая активность кислой фосфатазы в лимфобластах у детей с ОЛЛ встречается в 20–30 % случаев [11].
Иммунофенотипирование бластных клеток с помощью моноклональных антител позволяет установить линейную принадлежность и стадию зрелости бластных клеток. Каждому иммуноподварианту лейкоза соответствует специфический набор антигенов [11].
Современные программы лечения детей с ОЛЛ зависят от иммунофенотипа подварианта заболевания. Наиболее распространенный и прогностически благоприятный — ранний пре-В-клеточный, I common, II пре-пре-В, I про-В, II пре-В-вариант. Редко встречается и агрессивно протекает В-ОЛЛ. Прогноз считается плохим при Т-ОЛЛ [2].
Важную роль в прогнозировании течения заболевания и реакции на лечение играет цитогенетическое исследование у детей. Например, наличие у детей с ранним пре-В ОЛЛ t (12; 21) свидетельствует о благоприятном прогнозе. При наличии t (9; 22) прогноз плохой. У 10 % больных ОЛЛ отмечаются делеции и транслокации с вовлечением хромосомы 9р, часто наблюдается гиперлейкоцитоз, увеличение лимфоузлов средостения. Дети с Т-клеточным иммунофенотипом имеют высокий риск рецидива [11].
Лечение ОЛЛ осуществляется согласно приказу МЗ Украины № 364 от 20.07.2005 [12] и включает индукцию ремиссии, консолидацию и поддерживающую терапию. Объем лечения зависит от группы риска по данному заболеванию [11], который определяется в соответствии с прогностическими признаками: возраст, объем опухолевой массы, наличие прогностически неблагоприятных цитогенетических аномалий t (9; 22) и t (4; 11) и их молекулярно-генетических эквивалентов, а также обязательно оценивается ответ пациента на инициальное лечение [11]. Общий план лечения детей с ОЛЛ отражен в табл. 2.
Для оценки эффективности индукционной терапии показано исследование костного мозга на 15-й и 33-й день после начала лечения и определение наличия и количества лейкозных клеток, так называемой остаточной болезни (Minimal residual disease — MRD), которая, по сути, является субмикроскопическим ОЛЛ. Для определения MRD используют метод проточной цитометрии, при котором можно выявить 1 лейкозную клетку на 1 млн клеток костного мозга.
Это необходимо для более точного определения полноты ремиссии и прогноза, а также позволяет выделить группу пациентов с высоким риском рецидива, у которых должна быть интенсифицирована терапия [2].
Поздняя диагностика ОЛЛ и, соответственно, задержка старта лечения ведут к увеличению вероятности появления дополнительных мутаций и возникновению нового клона клеток, резистентного к химиопрепаратам, что затрудняет эрадикацию лейкозного клона [2].
В качестве иллюстрации к вышеизложенному приводим собственное наблюдение.
Анастасия Б., 4 лет, находилась на лечении в отделении онкогематологии для детей Института неотложной и восстановительной хирургии им. В.К. Гусака НАМН Украины (г. Донецк) с ноября 2013 года по январь 2014 года. При поступлении предъявляла жалобы на боли в правой руке и ноге, лихорадку до 40 °С, бледность, слабость, вялость, снижение аппетита.
Ребенок болен с сентября 2013 года, когда появились жалобы на общую слабость, повышение температуры до 38 °С, боли в правом плече. После консультации детского хирурга хирургическая патология была исключена. Несмотря на отсутствие катаральных явлений, была диагностирована острая респираторно-вирусная инфекция (ОРВИ), однако лечение было неэффективным. Девочка продолжала лихорадить до 39 °С, в октябре появились «летучие» боли в костях, наросла вялость, ухудшился аппетит. Консультирована детским инфекционистом, вновь поставлен диагноз ОРВИ. В анализе периферической крови выявлена анемия (Нb — 95 г/л, L — 5,6 Г/л). Гипертермия плохо купировалась парацетамолом и нурофеном, в связи с чем неоднократно вызываемая бригада скорой помощи снижала температуру тела введением анальгина, димедрола и дексаметазона. После этого лихорадка исчезала на 5–7 дней, боли в конечностях не беспокоили, девочка становилась активнее. В связи с указанным бабушка, фельдшер по образованию, начала самостоятельно вводить анальгин с дексаметазоном для снижения температуры тела. В конце ноября вновь появились жалобы на лихорадку до 39,5–40 °С, боли в костях. При исследовании крови выявлена анемия тяжелой степени (Нb — 70 г/л), лимфоцитоз — 95 %. Ребенок был направлен на консультацию к гематологу, а затем в отделение онкогематологии для детей для дальнейшего обследования и лечения.
Ребенок от I нормально протекавшей беременности, I нормальных родов в срок. Привита по возрасту. Детскими инфекциями не болела. Аллергологический и наследственный анамнез не отягощен.
При поступлении самочувствие ребенка нарушено, состояние средней тяжести. Тяжесть состояния обусловлена симптомами интоксикации, анемии и болевым синдромом. Ребенок правильного телосложения, удовлетворительного питания. Кожные покровы и видимые слизистые чистые, бледные. Периферические лимфоузлы в подчелюстной и подмышечной областях до 1 см, заднешейные лимфоузлы до 0,5 см в диаметре, плотно-эластической консистенции, безболезненные, не спаянные между собой и окружающими тканями. Очаговой неврологической симптоматики не выявлено. Перкуторно над легкими ясный легочный звук, аускультативно — везикулярное дыхание. Тоны сердца ритмичные, систолический шум на верхушке и в V точке. Живот мягкий, безболезненный. Печень на 1,5 см ниже реберной дуги, селезенка не пальпировалась. Физиологические отправления без особенностей.
В клиническом анализе крови при поступлении: гемоглобин — 70 г/л, эритроциты — 2,6 Т/л, цветной показатель — 0,8; ретикулоциты — 0,3 ‰, лейкоциты — 3,5 Г/л, сегментоядерные нейтрофилы — 3 %, лимфоциты — 95 %, моноциты — 2 %, СОЭ — 46 мм/час.
Картина костного мозга при поступлении: в миелограмме из левой подвздошной кости — 1 % бластов, из грудины — 0,5 % бластов. Через 2 недели в пунктатах костного мозга из грудины и подвздошных костей: бласты — 4,5–6,0 %, снижена клеточность костного мозга.
Была произведена билатеральная трепанобиопсия подвздошных костей. Гистологическое заключение: в глубоких отделах губчатой кости межбалочные пространства диффузно инфильтрированы мелкими гемопоэтическими клетками с PAS-негативной цитоплазмой. Элементы нормального гемопоэза (клетки миелоидного, эритроидного и мегакариоцитарного ростков) угнетены. Морфологически картина соответствует поражению костного мозга острым лейкозом.
Показатели билирубина и его фракций, трансаминазы, общий белок, мочевина, креатинин, остаточный азот, электролиты крови (натрий, калий, кальций, хлориды) были в пределах нормы.
В ликворе белок до центрифугирования — 0,50 г/л, после центрифугирования — 0,47 г/л, цитоз — 1 лимфоцит в 1 мл.
Рентгенограммы органов грудной клетки и левого локтевого сустава без патологических изменений.
На магнитно-резонансной томограмме головного мозга выявлено умеренное расширение тел боковых желудочков мозга и подоболочечных пространств; гипоплазия правой позвоночной артерии.
При эхокардиографии документировано наличие косо расположенной хорды в средней трети левого желудочка; размеры полостей сердца и сократимость в норме; септальных дефектов не выявлено; клапанный аппарат не изменен.
Вследствие неоднократного введения ребенку дексаметазона диагноз острого лимфобластного лейкоза подтвержден лабораторными методами через 18 дней после поступления в отделение, хотя клиническая картина нарастала: ежедневно повышалась температура до 39–40 °С, усилились боли в конечностях, которые уже с трудом купировались введением ненаркотических анальгетиков, увеличились размеры печени и селезенки до 2 см ниже реберной дуги, появилась асимметрия носогубных складок и отклонение uvula влево. С учетом нарастания симптоматики была повторно проведена пункция костного мозга. В пунктате из левой подвздошной кости количество бластных клеток составило 24–26 %. По данным иммуногистохимического исследования, в опухолевых клетках мембранная экспрессия CD19, CD10 и ядерная экспрессия терминальной дезоксинуклеотидилтрансферазы (TdT). Заключение: В-лимфобластная лейкемия. По данным иммунофенотипирования определен фенотип бластной популяции, соответствующий пре-В-варианту ОЛЛ (CD|0+|19+|22+|24+|IgM+).
На основании жалоб, анамнеза заболевания, клинической картины и данных дополнительных исследований был установлен диагноз: острый лимфобластный лейкоз, L1, пре-В-клеточный вариант, нейролейкемия, развернутый период.
Начато лечение по протоколу ALL-IC-BFM-2009. Девочка получила 2 введения винкристина и доксорубицина, 3 введения аспарагиназы, преднизолон. Неоднократно с заместительной целью проводились трансфузии эритроцитарной массы, тромбоконцентрата и свежезамороженной плазмы, дезинтоксикационная и симптоматическая терапия. Однако, несмотря на проводимую терапию, заболевание прогрессировало с летальным исходом.
Результаты патологоанатомического исследования подтвердили клинический диагноз: острый лимфобластный лейкоз, пре-В-клеточный вариант. Нейролейкемия. Терминальный период. Осложнения основного заболевания: геморрагический синдром (кровоизлияния в средостение, плевру, эпикард, стенки желудка и кишечника, левый надпочечник, миокард, пищевод, поджелудочную железу, мягкую мозговую оболочку, почки). Общее венозное полнокровие. Дистрофические изменения внутренних органов. Отек легких. Отек головного мозга.
Таким образом, поздняя диагностика острого лейкоза и позднее начало лечения привели к неблагоприятному исходу заболевания. Особенность данного клинического случая в том, что на начальном этапе заболевания не придали значение болям в костях, не исследовали клинический анализ крови у ребенка с длительной лихорадкой неясного генеза, не были соблюдены элементарные правила пропедевтики в системном осмотре больного, включая осмотр кожи, слизистых оболочек, пальпацию лимфатических узлов, печени и селезенки. Негативную роль сыграло частое введение гормонов для купирования лихорадки, которое «смазало» клиническую картину, повлекло значительную задержку в установлении диагноза и привело к возникновению нового клона клеток, резистентного к терапии. Данный случай демонстрирует, что необоснованное назначение стероидов «стерло» клинико-лабораторные признаки заболевания, привело к его прогрессированию и существенно ухудшило прогноз.
1. Детская онкология / Под ред. М.Д. Алиева, В.Г. Полякова, Г.Л. Менткевича, С.А. Маяковой. — М.: Издательская группа РОНЦ, 2012. — 684 с.
2. Гематология и иммунология детского возраста / Под ред. Н.А. Алексеева. — СПб.: Гиппократ, 2009. — 1044 с.
3. Лейкозы у детей / Под ред. Г.Л. Менткевича, С.А. Маяковой. — М.: Практическая медицина, 2009. — 384 с.
4. Воробьев А.И. Руководство по гематологии: в 3 т. — Т. 1. — 3-е изд., перераб. и доп. — М.: Ньюдиамед, 2002. — 280 с.
5. Ермолин А.Э. Дифференциальная диагностика и лечение острых и хронических лейкозов / А.Э. Ермолин. — М.: Бином, 2008. — 200 с.
6. Глузман Д.Ф. Иммуноцитохимическая диагностика опухолей кроветворной и лимфоидной тканей у детей. — К.: ДИА, 2005. — 216 с.
7. Глузман Д.Ф. Диагностика лейкозов. Атлас и практическое руководство. — К.: Морион, 2000. — 224 с.
8. Гематология: руководство для врачей / Н.Н. Мамаев, С.И. Рябов. — СПб.: СпецЛит, 2008. — 543 с.
9. Дурнов Л.А. Злокачественные новообразования кроветворной и лимфоидной ткани у детей. Руководство для врачей. — М.: Медицина, 2001. — 272 с.
10. Ковалева Л.Г. Острые лейкозы. — 2-е изд., перераб. и доп. — М.: Медицина, 1990. — 272 с.
11. Руководство по детской онкологии / Под ред. ак. РАМН Л.А. Дурнова. — М.: Миклош, 2003. — 504 с.
12. Наказ МОЗ України № 364 від 20.07.2005 «Про затвердження протоколів надання медичної допомоги дітям за спеціальністю «Дитяча гематологія».

/114/114.jpg)
/115/115.jpg)