Газета «Новости медицины и фармации» 17 (513) 2014
Вернуться к номеру
Рекомендації Української асоціації кардіологів, Української асоціації ендокринних хірургів, Асоціації нефрологів України з диференційної діагностики артеріальних гіпертензій 2014 р.
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 20-24 (Укр.)
Зміст
Вступ
1. Ураження нирок та ниркових артерій, що можуть супроводжуватися розвитком АГ
1.1. Гломерулонефрит
1.2. Діабетична нефропатія
1.3. Хронічний пієлонефрит
1.4. Полікістоз нирок
1.5. Гідронефроз, обструктивна нефропатія
1.6. Гіпоплазія нирки
1.7. Ренінпродукуючі пухлини нирок
1.8. Травма нирки
1.9. Синдром Ліддла
1.10. Синдром Гордона
1.11. Реноваскулярна АГ
1.12. Довідкові матеріали
2. АГ, зумовлена ендокринними захворюваннями
2.1. Первинний альдостеронізм
2.2. Феохромоцитома
2.3. Синдром Кушинга
2.4. Акромегалія
2.5. Тиреотоксикоз
2.6. Гіпотиреоз
2.7. Гіперпаратиреоз
2.8. Синдром полікістозних яєчників
3. Гемодинамічні АГ
3.1. Коарктація аорти
3.2. Недостатність аортального клапана
4. Системні васкуліти
4.1. Синдром дуги аорти
4.2. Вузликовий поліартеріїт
5. АГ та синдром обструктивного апное сну
6. АГ, зумовлена неврологічними захворюваннями
6.1. Пухлини центральної нервової системи
6.2. Енцефаліт
6.3. Травми мозку
6.4. Спадкові порушення автономної регуляції
7. АГ, зумовлена медикаментами, наркотичними речовинами та харчовими компонентами
7.1. Кортикостероїди
7.2. Нестероїдні протизапальні засоби
7.3. Препарати жіночих та чоловічих статевих гормонів
7.4. Антидепресанти
7.5. Еритропоетин
7.6. Імуносупресанти
Вступ
Вторинна (симптоматична) артеріальна гіпертензія (АГ) є причиною підвищеного АТ у 5–10 % хворих на АГ. Ідентифіковано понад 50 захворювань та клінічних станів, що сприяють розвитку вторинної АГ. У більшості випадків така АГ характеризується високим АТ, несприятливим перебігом захворювання та високою частотою серцево-судинних катастроф. Проте при деяких її формах вчасна діагностика та адекватне лікування дозволяють досягти нормалізації АТ і запобігти розвитку ускладнень.
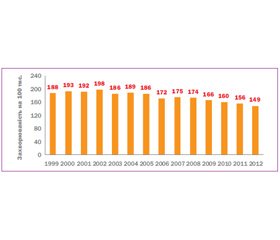
Поштовхом до видання даних Рекомендацій став аналіз статистичних даних МОЗ України щодо виявлення вторинних гіпертензій в нашій країні за період з 1999 по 2012 рік (рис. 1). Він наочно довів, що протягом останніх 14 років показник захворюваності на різні форми вторинної АГ суттєво знизився. Очевидно, що це зумовлено не зменшенням абсолютної кількості вторинних АГ, а погіршенням їх виявлення.
У наведених Рекомендаціях детально викладено діагностичні алгоритми та тактику лікування як найчастіших, так і рідкісних форм вторинних гіпертензій. Колектив авторів сподівається, що дані Рекомендації розширять уявлення лікарів про причини підвищення АТ і сприятимуть виявленню тих захворювань, при яких АГ є лише одним із симптомів і які потребують специфічного лікування, результатом якого є нормалізація АТ.
1. Ураження нирок та ниркових артерій, що можуть супроводжуватися розвитком АГ
1.1. Гломерулонефрит (ГН)
Визначення та клінічна картина. Це група захворювань, які характеризуються двостороннім негнійним запаленням нирок, найчастіше імунної природи, що перебігають з ураженням клубочкового апарату та, як правило, з залученням до патологічного процесу інших ниркових структур. У сучасній нефрології термін «хронічний ГН» не використовується, це — збірне поняття, яке не може розглядатися як остаточний діагноз. Терміном «гломерулонефрит» визначаються такі гломерулярні ураження, як гострий постінфекційний ГН, швидко прогресуючий (підгострий та півмісяцевий) ГН, мезангіопроліферативний ГН (у т.ч. LgA-нефропатія та ін.). Стандартним методом діагностики ураження гломерулярного апарату є прижиттєве морфологічне дослідження ниркової тканини із встановленням гістологічної форми ГН.
Клінічна картина досить різноманітна і характеризується:
1) ізольованим сечовим синдромом (протеїнурія менше за 1 г/добу і мікрогематурія — частіше з гломерулярними зміненими еритроцитами в осаді сечі, можливо, циліндрами — гіаліновими, еритроцитарними, зернистими);
2) нефротичним синдромом (протеїнурія > 3 г/добу, гіпо- та диспротеїнемія, гіперліпідемія, набряки);
3) нефритичним синдромом/синдромом швидкопрогресуючого ГН, для якого характерна поява протеїнурії в межах сечового синдрому, еритроцитурії та циліндрурії різного ступеня вираженості, а також екстраренальні прояви: набряки та/або АГ; нерідко — порушення азотовидільної функції нирок, часто — швидкий розвиток і стрімке прогресування АГ та зниження функції нирок;
4) епізодами макрогематурії.
У частині випадків перебіг ГН латентний (практично без клінічних проявів), в інших — із загостреннями, для яких характерне поглиблення сечового синдрому, розвиток АГ або зростання її ступеня, зниження функції нирок або прогресування наявної ниркової недостатності.
Поширеність і характер АГ при ГН залежать від морфологічної та клінічної форми ГН і стадії ниркового ураження. АГ завжди має місце при наявності нефротичного синдрому (наприклад, у осіб із класичним варіантом гострого післяінфекційного ГН, при швидко прогресуючому ГН). При субклінічному перебігу гломерулярного процесу АГ може бути відсутня, її розвиток при ряді варіантів ГН нерідко за часом співпадає з етапом зниження функції нирок, однак у ряді випадків АГ може розвиватись і на ранній стадії ГН.
За різними даними, поширеність АГ при мезангіокапілярному ГН становить 35–80 %, при LgA-нефропатії — 43–74 %, при мембранозній гломерулопатії — 27–52 %, для нефропатії з мінімальними змінами АГ не характерна. АГ розглядається як важливий критерій несприятливого прогнозу: її наявність сприяє прискоренню темпів прогресування ниркового ураження та збільшенню ризику серцево-судинних ускладнень.
Вираженість АГ при ГН достатньо широко різниться. На етапах вираженого та тяжкого зниження функції нирок часто спостерігається резистентна АГ.
Механізми розвитку АГ багатофакторні; провідними серед них є:
1) активація ренін-ангіотензинової та симпатичної систем;
2) затримка натрію та води;
3) ремоделювання судин та ендотеліальна дисфункція;
4) на етапах зниження функції нирок — вторинний гіперпаратиреоз, анемія; в осіб на гемодіалізі — наявність артеріовенозного шунта.
Діагностика. Важливим при хронічній хворобі нирок, при ГН особливо, є ретельне динамічне лабораторне дослідження сечі. Оцінюються:
1) рівень та характер протеїнурії (інтермітуюча або персистуюча та ін.);
2) сечовий осад із визначенням наявності та ступеня вираженості лейкоцитурії (з екскрецією поліморфноядерних лейкоцитів або лімфоцитів), гематурії (що проявляється зміненими або незміненими гломерулярними еритроцитами або їх комбінуванням), циліндрурії (гіалінові, зернисті, воскоподібні, еритроцитарні та ін.), ліпідурії та інших параметрів.
Необхідним є регулярний контроль рівня АТ (у т.ч. самоконтроль).
Інструментальні методи обстеження в діагностиці ГН є допоміжними. Вони використовуються переважно для виключення інших причин змін в аналізах сечі. Стандартним є регулярний контроль у динаміці розмірів нирок із використанням ультразвукового дослідження. Важливе значення в діагностиці та виявленні особливостей ГН, виборі лікувальної тактики та оцінці її ефективності надають прижиттєвому морфологічному дослідженню ниркової тканини (біопсії нирки) з використанням світлової, імунофлюоресцентної та електронної мікроскопії. Показаннями до проведення біопсії нирки є:
1) нефротичний синдром — практично в усіх дорослих хворих;
2) мікро- та макрогематурія — при наявності змінених еритроцитів (зазвичай > 50–80 %) та еритроцитарних циліндрів; а також ізольована мікрогематурія тривалістю понад 5 місяців, за умов відсутності вроджених анатомічних змін нирок або сечовивідних шляхів, сечокам’яної хвороби, кіст, пухлин нирок або сечовивідних шляхів;
3) гостре ураження нирок;
4) швидке прогресуюче зниження функції нирок у випадку невстановленого діагнозу, якщо розмір нирок ≥ 9 см;
5) системне захворювання сполучної тканини та васкуліти;
6) підозра на гостре або хронічне відторгнення ниркового трансплантата.
У процесі діагностики ГН необхідно враховувати головні клінічні характеристики тих системних захворювань сполучної тканини і системних васкулітів, перебіг яких супроводжується розвитком ГН:
1) системний червоний вовчак. Характерні: еритема на вилицях, дискоїдне висипання, фотосенсибілізація, виразки слизової оболонки ротової порожнини, ерозивний артрит ≥ 2 суглобів, серозит; різноманітна клінічна картина ГН — від латентного до швидкопрогресуючого; ураження центральної нервової системи — судоми або психоз; гематологічні (анемія, лейкопенія, тромбоцитопенія) та імунологічні (антитіла до нативної ДНК, антифосфоліпідні антитіла) порушення; підвищення рівня антинуклеарного фактора; критеріями діагнозу системного червоного вовчака є наявність 4 із вищеназваних критеріїв;
2) гранулематоз Вегенера (синусити та носові кровотечі; в легенях — інфільтрати, каверни, альвеолярні інфільтрати; ГН — часто по типу швидко прогресуючого; антитіла до антигенів цитоплазми нейтрофілів (ANCA);
3) мікроскопічний поліангіїт (пурпура, альвеолярні геморагії, полінейропатії);
4) синдром Чарга — Стросса (астма; еозинофілія; нейропатія; ГН — у частині випадків по типу швидко прогресуючого; ANCA).
Лікування. Терапія визначається морфологічною формою ГН, особливостями ниркового ураження та екстраренальних порушень, наявністю і ступенем АГ та ступенем зниження функції нирок. Лікувальна тактика при ГН визначається ренопротекторними та кардіопротекторними підходами, що включають:
- корекцію стилю життя: досягнення та утримання оптимальної ваги тіла, низькосольова дієта (< 5 г/добу кухонної солі), фізичні вправи (за відсутності протипоказань) 30 хв 5 разів на тиждень, інтенсивність яких сумісна з наявними у пацієнта серцево-судинними захворюваннями; відмова від паління;
- досягнення та підтримання цільового АТ < 140/90 мм рт.ст. для всіх хворих, крім хворих із протеїнурією, для яких цільовий САТ < 130 мм рт.ст., а також пацієнтів із цукровим діабетом — цільовий АТ < 140/85 мм рт.ст.;
- препаратами вибору для лікування АГ при ураженні нирок є інгібітори АПФ або блокатори АТ1-рецепторів ангіотензину ІІ (сартани), їх комбінації з діуретиками та блокаторами кальцієвих каналів, при необхідності застосовують інші класи медикаментозних засобів. Не допускається сумісне застосування інгібіторів АПФ і сартанів;
- відмова (або зведення до мінімуму) прийому нестероїдних протизапальних препаратів;
- контроль дисліпідемії статинами (цільовий рівень холестерину ліпопротеїнів низької щільності < 2,5 ммоль/л при високому або < 1,8 ммоль/л при дуже високому ризику серцево-судинних ускладнень);
- контроль гіперглікемії (цільовий рівень глікозильованого гемоглобіну — зазвичай менш 7,0 %);
- контроль анемії (препарати заліза, еритропоезстимулюючі засоби — до рівня гемоглобіну не більше 115 г/л);
- використання низькобілкової дієти;
- корекція порушень кальцієво-фосфорного балансу;
- за необхідності використовують різні режими імуносупресивної терапії (препарати цитотоксичної дії, глюкокортикоїди, можливо — протималярійні засоби);
- на етапах термінальної ниркової недостатності використовують лікувальні підходи, що заміняють функцію нирок (програмний гемодіаліз, перитонеальний діаліз, трансплантація нирки).
1.2. Діабетична нефропатія
Поширеність АГ в осіб із цукровим діабетом 1-го та 2-го типу з діабетичною нефропатією становить від 70 до 100 %. Діабетична нефропатія — класичне мікросудинне ускладнення цукрового діабету 1-го та 2-го типу з переважним ураженням гломерулярного апарату та тубулоінтерстиційними порушеннями (морфологічна картина нирок при діабетичній нефропатії в осіб із діабетом 1-го та 2-го типу має суттєві відмінності). Клінічно діабетична нефропатія характеризується протеїнурією, прогресуючим зниженням швидкості клубочкової фільтрації (ШКФ), особливо при значній протеїнурії, розвитком та прогресуванням АГ.
Механізми розвитку АГ. Окрім описаних у попередньому розділі механізмів, суттєвого значення у розвитку АГ при діабетичній нефропатії надають гіперглікемії.
Діагностика. Усім хворим на цукровий діабет рекомендується ретельний контроль та самоконтроль АТ. В осіб із цукровим діабетом 1-го та 2-го типу при відсутності анамнестичних та клінічних ознак ураження нирок обов’язковим є регулярний (не рідше 1 разу на рік) контроль загального аналізу сечі. При відсутності змін у таких аналізах — щорічне визначення мікроальбумінурії. Необхідним є регулярний контроль рівня креатиніну крові з розрахунком швидкості клубочкової фільтрації. Доцільним є ультразвукове дослідження нирок (розміри, структура) в динаміці. Прижиттєве морфологічне обстеження нирок (біопсія) проводиться рідше, ніж у хворих із ГН, переважно з метою виключення інших, не пов’язаних із діабетом, варіантів ниркового ураження (наприклад, швидкопрогресуючого та півмісяцевого ГН).
Лікування. Основою лікувальної тактики є застосування стандартних ренопротекторних підходів, що наведені у розділі, присвяченому лікуванню ГН. Особлива роль відводиться корекції гіперглікемії з досягненням цільового рівня глікозильованого гемоглобіну.
1.3. Хронічний пієлонефрит
Визначення та клінічна картина. Хронічний пієлонефрит — одно- або двостороннє неспецифічне інфекційно-запальне хронічне захворювання нирок, при якому в патологічний процес залучені ниркова чашечка (миска), чашечки та паренхіма нирки (в першу чергу і переважно — інтерстицій та канальцевий апарат), а також клубочки та ниркові судини. Хронічний пієлонефрит є причиною розвитку термінальної ниркової недостатності у 13–22 % випадків. Клінічна картина включає фази ремісії (при нормальному АТ і збереженій функції нирок може мати безсимптомний перебіг, також можуть бути відсутні зміни в аналізах сечі) та загострення (спостерігаються болі в поперековій ділянці та/або флангах живота, дизурія, часте сечовиділення, загальна слабкість, субфебрилітет; при тяжкому загостренні — гектична лихоманка, інтоксикаційний синдром). При хронічному пієлонефриті можуть спостерігатися симптоми, пов’язані з тубулоінтерстиціальними ураженнями (поліурія, ніктурія, збільшення екскреції натрію, зниження концентраційної функції нирок, гіперкаліємія, ацидоз). В аналізах сечі в період загострення зазвичай виявляється лейкоцитурія, гематурія (частіше — мікрогематурія), можуть виявлятися лейкоцитарні та бактеріальні циліндри. Протеїнурія, як правило, менша за 1 г/добу (при розвитку патологічних змін у гломерулярному апараті, зокрема, у вигляді фокального та сегментарного гломерулярного гіалінозу та склерозу можлива виражена протеїнурія в межах 1–3 г/добу і більше).
Механізми розвитку АГ:
1) підвищення активності ренін-ангіотензинової системи (частіше — при односторонньому ураженні);
2) гіперволемія (зазвичай — при двосторонніх процесах);
3) оклюзуюче ураження різних відділів судинного русла нирок (інтралобулярних та аркуантних артерій, потовщення стінки та фіброз інтими артеріол).
Поширеність АГ. АГ має місце у 50–75 % хворих із хронічним пієлонефритом, може розвиватись як при односторонньому, так і при двосторонньому ураженні нирок. Поширеність АГ більш висока в осіб зі зниженою функцією нирок. Для гострого пієлонефриту розвиток АГ не є характерним.
Діагностика. Хворі на хронічний пієлонефрит навіть за відсутності АГ потребують регулярного контролю АТ та періодичного (1–2 рази на рік при стабільному клінічному стані) контролю креатиніну плазми. Необхідним є регулярний контроль загального аналізу сечі (як при ремісії, так і — більш часто — під час загострення); проба С.С. Зимницького в умовах помірного обмеження вживання рідини в день збору сечі для оцінки концентраційної функції нирок. З метою виявлення структурних особливостей нирок (оцінка розмірів, контурів, товщини та однорідності паренхіми, форми та розмірів чашково-мискового апарату, склеротичних змін) найширше застосовується ультразвукове дослідження, а також комп’ютерна та магнітно-резонансна томографія нирок. Використовуються також, проте рідше, ніж раніше, радіонуклідні методи (ренографія та сцинтиграфія нирок, які дозволяють оцінити окремо функцію кожної з нирок, надають додаткову інформацію про особливості функціонування судинної системи нирок, обструкції сечовивідних шляхів, рефлюкси) та екскреторна уронефрографія (пов’язана з такими недоліками, як значна експозиція іонізуючого випромінення та йодовмісних контрастних речовин).
Лікування. При загостренні хронічного пієлонефриту необхідно проводити адекватну антибактеріальну терапію. У хворих старших за 18 років з неускладненим пієлонефритом віддалений прогноз, як правило, сприятливий, у переважній більшості випадків зберігається нормальна функція нирок і не розвивається АГ.
Лікування АГ в осіб із хронічним пієлонефритом здійснюється за загальноприйнятими принципами.
1.4. Полікістоз нирок (ПК)
Визначення та клінічна картина. В англомовній літературі для відмежування цього стану від інших форм кістозного ураження нирок застосовують термін «автосомно-домінантна полікістозна хвороба нирок». ПК — вроджене системне порушення з переважним ураженням нирок, нерідко із залученням печінки, підшлункової залози, рідше — головного мозку та інших органів. Може розвиватися в осіб обох статей. Розвиток ПК пов’язують із різними мутаціями (їх описано декілька сотень) одного з двох генів, що кодують утворення протеїнів поліцистину-1 та -2 (PKD1 та PKD2 відповідно), які регулюють функцію кальцієвих каналів у мембрані клітин тубулярного апарату та судин нирок, а також деяких інших тканин). Патологічний ген від батьків із ПК успадковується дитиною у 50 % випадків. Приблизно у 5 % випадків ПК мутації вказаних генів є спонтанними.
Для ПК характерна наявність, як правило, численних, білатеральних кіст у нирках, які після травматизації можуть містити кров або нагноюватися. У 80 % осіб із ПК виявляються кісти печінки, у 30–40 % — кісти підшлункової залози; у 8 % — аневризми інтракраніальних судин. Іноді виявляються кісти передміхурової залози, ураження серця у вигляді пролапсу мітрального клапана та/або дилатації кореня аорти, дивертикульоз товстого кишечника. Ураження нирок зазвичай є провідним у клінічній картині і визначає прогноз. Приблизно у 60 % осіб із ПК спостерігаються епізоди макрогематурії, тенденція до збільшення розмірів та кількості кіст, що призводить до прогресуючого симетричного збільшення розмірів нирок. Незважаючи на це, впродовж десятиліть функція нирок може зберігатись у межах нормальних значень, але з 30–40-річного віку починається її зниження, що часто супроводжується розвитком АГ. У західних країнах особи з ПК становлять 10 % хворих із термінальною стадією ниркової недостатності, що знаходяться на гемодіалізі.
Поширеність та характер АГ. Виявляють не менше ніж у 50–60 % хворих на ПК; АГ є одним із найчастіших клінічних проявів ПК. Розвиток АГ при ПК вважають важливим критерієм прогресування ураження нирок. Розвиток АГ можливий з дитячого віку.
Механізми розвитку АГ. Мають значення такі фактори:
1) стиснення інтраренальних артерій кістами з розвитком ішемізації ниркової тканини, хронічною активацією ренін-ангіотензинової та симпатичної систем;
2) поступова втрата функціонуючої паренхіми нирок;
3) затримка натрію нирками.
Діагностика. Генетичне дослідження не використовується для скринінгового обстеження через низьку специфічність. Інструментальним методом вибору для скринінгу та динамічного контролю є ультразвукове обстеження (у дорослих дозволяє виявити кісти розміром > 1 см у діаметрі).
Критеріями діагностики ПК при ультразвуковому обстеженні нирок є:
1) дві або більше уні- чи білатеральних кіст у осіб віком < 30 років;
2) дві або більше кіст у кожній з нирок в осіб віком 30–59 років;
3) чотири або більше кіст у кожній з нирок у осіб віком > 60 років.
Додатковим критерієм діагностики є виявлення кіст у печінці та підшлунковій залозі. За необхідності в осіб із невеликими та нечисленними кістами може застосовуватись комп’ютерна томографія з внутрішньовенним підсиленням, яка дозволяє виявляти кісти > 0,3 см у діаметрі, але пов’язана з ризиком контраст-індукованої нефропатії.
В осіб без сімейного анамнезу ПК необхідним є проведення диференційної діагностики з іншими варіантами кістозного ураження нирок:
1) прості кісти (поодинокі, без прогресування);
2) набуті кісти (малочисленні, можуть розвиватися в осіб, які мають знижену функцію нирок);
3) автосомно-рецесивна полікістозна хвороба нирок (кісти багаточисленні, виявляються у новонароджених, дітей раннього віку).
Лікування. До цього часу відсутні лікарські засоби, що уповільнюють формування кіст і прогресування ПК. Лікувальні підходи залежать від особливостей клінічної картини. За умов нормальної функції нирок при відсутності АГ та інших клінічних проявів рекомендують спостереження з регулярним контролем АТ, рівня креатиніну, розмірів нирок (за даними ультразвукового обстеження).
Лікування АГ проводиться за загальноприйнятими принципами, описаними в розділі «Гломерулонефрит». При наявності макрогематурії — постільний режим, анальгетики, достатня гідратація для підтримки об’єму сечі в межах 2–3 л/добу (при відсутності протипоказань); за наявності епізодів макрогематурії в анамнезі рекомендовано уникати прийому антитромботичних препаратів і травматизації в ділянці живота та попереку. В осіб з епізодами сечової інфекції проводиться стандартна антибактеріальна терапія (перша лінія — фторхінолони). Особам із термінальною стадією ниркової недостатності показані діаліз і трансплантація нирки.
1.5. Гідронефроз, обструктивна нефропатія
Визначення та клінічна картина. Гідронефроз — патологічний стан, що характеризується дилатацією чашково-мискового апарату нирки, пов’язаний з порушенням відтоку сечі з нирки — повною або частковою обструкцією сечовивідних шляхів. Як синонім гідронефрозу застосовують термін «обструктивна нефропатія». Можливі причини гідронефрозу:
1) вроджені структурні порушення нирок, сечоводу, сечового міхура або уретри, які ускладнюють відтік сечі;
2) набуті зміни цих структур внаслідок травм, хірургічних втручань, опромінення та ін.;
3) компресії структур сечовивідних шляхів ззовні (судинами, пухлинами, у т.ч. при аденомі передміхурової залози, білатеральна компресія сечоводів при вагітності, ретроперитонеальному фіброзі та ін.);
4) обтурація просвіту сечовивідних шляхів конкрементами, згустками крові (особливо часто — у місці впадіння сечоводу в сечовий міхур);
5) різні види рефлюксу (особливо міхурово-сечовідний);
6) нейрогенний сечовий міхур.
Клінічні прояви залежать від особливостей обструкції (гостра чи хронічна, часткова чи повна, одно- чи двостороння). Наприклад, гостра обструкція сечоводу конкрементом викликає появу інтенсивного різкого болю в попереку, також часто спостерігають дизурію, нудоту/блювання; в той же час поступовий розвиток гідронефрозу може не супроводжуватись клінічними проявами. Порушення відтоку сечі може збільшувати ризик утворення конкрементів, підвищує ймовірність розвитку/загострення сечової інфекції (клінічні прояви можуть включати дизурію, лихоманку, інтоксикаційний синдром, піурію, епізоди макрогематурії). Внаслідок дисфункції тубулярного апарату можливий також розвиток гіпонатріємії, гіперхлоремічного метаболічного ацидозу. Сумарна функція нирок може залишатися збереженою навіть при тяжкому однобічному гідронефрозі (контралатеральна нирка забезпечує компенсацію функції ураженої нирки). Зменшення об’єму сумарної функціонуючої ниркової паренхіми супроводжується зниженням функції нирок і розвитком АГ.
Поширеність і характер АГ. АГ не є частим клінічним проявом при гідронефрозі, особливо в осіб з однобічним характером ураження. Розвиток АГ частіше спостерігається при двобічному тяжкому гідронефрозі, як правило, співпадає у часі з етапом зниження функції нирок.
Механізми розвитку АГ: зменшення функціонуючої ниркової паренхіми, хронічна ішемізація тканини нирок з активацією ренін–ангіотензинової системи.
Діагностика базується на даних інструментальних обстежень: ультразвукове обстеження, спіральна комп’ютерна томографія, магнітно-резонансна томографія; достатньо широко застосовуються також екскреторна уронефрографія (для встановлення локалізації і особливостей обструкції), ретроградна пієлографія, цистоуретерографія (особливо для діагностики міхурово-сечовідного рефлюкса). В осіб із приступами сечокам’яної хвороби перевагу надають спіральній комп’ютерній томографії (вона дозволяє виявити до 99 % конкрементів у сечовивідних шляхах, тоді як при ультразвуковому обстеженні та екскреторній уронефрографії деякі з конкрементів не візуалізуються). При дослідженні сечі у частині випадків зміни можуть не виявлятися, в інших — виявляють гематурію (незмінені негломерулярні еритроцити, переважно в осіб із сечокам’яною хворобою); лейкоцитурію (за наявності сечової інфекції); зниження концентраційної функції нирок за даними проби С.С. Зимницького, збільшення рН сечі (при ураженні дистальних канальців).
Лікування. Важливим компонентом терапії є усунення обструкції та забезпечення дренування нирки. При цьому тактика визначається характером обструкції:
1) при гострій обструкції верхніх сечовивідних шляхів можливою є нефротомія;
2) при хронічній обструкції — стентування сечоводів;
3) при обструкції нижніх сечовивідних шляхів — катетеризація уретри або надлобкова пункція та катетеризація.
В осіб із сечокам’яною хворобою може бути застосована літотрипсія; при аденомі передміхурової залози — відповідні оперативні та медикаментозні підходи. При загостренні сечової інфекції проводять антибактеріальну терапію.
Лікування АГ здійснюється за загальноприйнятими принципами.
1.6. Гіпоплазія нирки
Визначення та клінічна картина. Гіпоплазія нирки — вроджене порушення розвитку нирки зі зменшенням кількості нефронів та її розмірів. У більшості випадків спостерігається також порушення структури тканини нирки (дефекти канальцевого апарату, інтерстиціальний фіброз та ін.), що позначається як гіподисплазія нирки. У більшості випадків гіпоплазія нирки є компонентом спадкових синдромів, пов’язаних із мутаціями різних генів; зазвичай такі хворі мають численні мальформації різних органів та систем, АГ і зниження функції нирок (особливо при двосторонній гіпоплазії); діагноз часто встановлюють в дитячому, навіть у ранньому дитячому, віці. Гіпоплазія нирки може бути ізольованим вродженим порушенням; при односторонній локалізації за відсутності ішемізації ниркової тканини та збереженні сумарної функції нирок клінічні прояви можуть бути повністю відсутні; діагноз у таких осіб встановлюють випадково (наприклад, при скринінговому ультразвуковому обстеженні). АГ виникає, як правило, при наявності судинних порушень, що сприяють ішемії тканини гіпоплазованої нирки (наприклад, аномалій ниркових артерій, в тому числі — інтраренальних).
Поширеність та характер АГ. Її виявляють у 20–25 % дорослих осіб із гіпоплазією нирки; ступінь гіпертензії широко різниться.
Механізми розвитку АГ. В основі розвитку АГ у таких хворих лежить активація ренін-ангіотензинової системи внаслідок гіпоперфузії та ішемії нирки.
Діагностика. Припущення, що причиною АГ є гіпоплазія нирки, може виникнути, якщо виявляють зменшення розмірів її (нормальні розміри нирок у дорослих осіб: довжина — 100–155 мм, ширина — 50–70 мм, товщина 30–50 мм) за даними ультразвукового, комп’ютерно-томографічного або інших інструментальних методів обстеження (екскреторна урографія, сцинтиграфія нирок). Таким пацієнтам необхідно провести стандартне загально клінічне та біохімічне лабораторні обстеження.
Лікування. За відсутності ефекту адекватної антигіпертензивної терапії, а також у випадках прогресуючого зниження функції нирок може знадобитися хірургічне втручання (реваскуляризація, нефректомія).
1.7. Ренінпродукуючі пухлини
Визначення та клінічна картина. У вузькому розумінні ренінпродукуючі пухлини — це пухлини юкстагломерулярного апарату нирок (синонім «реніноми»). Важливо зазначити (див. нижче розділ «Діагностика»), що підвищення активності реніну може спостерігатися і при інших пухлинах нирок (наприклад, нирково-клітинній карциномі, гемангіоперицитомі), а також метастатичних пухлинах інших локалізацій (легень, яєчників, печінки, підшлункової залози, саркомах, тератомах, парагангліомах та ін.). Підвищенню активності реніну в плазмі крові сприяють також великі інтраренальні пухлини, що здавлюють судинну систему нирки. Власне реніноми — це рідкі доброякісні пухлини, досить часто невеликого розміру (до 15–20 мм у діаметрі). Перебіг АГ на тлі реніном нерідко супроводжується вторинним гіперальдостеронізмом і пов’язаною з ним гіпокаліємією (інколи тяжкою, зі зниженням рівня калію крові в межах 2–3 ммоль/л), а також дуже високою активністю прореніну та реніну крові.
Поширеність та характер АГ. АГ виявляють у більшості пацієнтів із цією патологією, але описані поодинокі безсимптомні випадки; перебіг АГ, як правило, тяжкий і характеризується стабільно високим рівнем АТ, який погано піддається лікуванню; можливий кризовий перебіг захворювання. АГ зазвичай розвивається в осіб молодого віку (20–30 років), рідше — в середньому віці.
Механізм розвитку АГ: висока активність реніну крові.
Діагностика. Запідозрити наявність ренінпродукуючої пухлини можна, якщо у хворого молодого віку з тяжкою АГ і високим умістом (активністю) реніну в крові (нерідко — з вираженою гіпокаліємією) ураження судин нирок було виключене за даними артеріографії. Доцільним є проведення ультразвукового та комп’ютерного обстежень. При підозрі на наявність метастатичного ураження на тлі пухлин іншої локалізації проводяться відповідні обстеження. Остаточний діагноз може бути встановлено за даними морфологічного обстеження тканини видаленої пухлини, але в частині випадків за причини схожості гістологічної картини з такою первинних пухлин нирок заключний діагноз часто залишається не визначеним.
Лікування. Хірургічне видалення нирки з різним об’ємом втручання (часткова або радикальна нефректомія) призводить до усунення або значного зменшення тяжкості АГ та гіпокаліємії (як правило, протягом одного тижня після операції). У віддаленому післяопераційному періоді рецидивів чи метастазування реніном не спостерігається.
1.8. Травма нирки
Визначення та клінічна картина. Компресія ниркової паренхіми ззовні гематомою (внаслідок спортивної або іншої травми, а також ятрогенної природи (як ускладнення біопсії нирки), а також пухлиною чи кістою) має визначення «синдром Пейджа» або «нирка Пейджа». Клінічна картина АГ внаслідок травми нирки може коливатися від безсимптомних або малосимптомних випадків до ситуацій з наявністю больового синдрому абдомінальної або поперекової локалізації, частіше — одностороннього характеру, макро- або мікрогематурії.
Поширеність та характер АГ. Підвищення АТ не є частим проявом травми нирки. Розвиток АГ можливий у випадках формування паранефральної або субкапсулярної гематоми і пов’язаної з нею компресії нирки. Частота АГ при тупій травмі нирки становить 2–10 %. АГ часто розвивається швидко, хоча можливий і віддалений її розвиток, у частині випадків погано контролюється медикаментозними засобами.
Механізм розвитку АГ: гіперактивація ренін-ангіотензинової системи внаслідок гіпоперфузії та ішемії тканини нирки.
Діагностика. В осіб з АГ незалежно від віку необхідно звернути увагу на наявність в анамнезі перенесених травм поперекової ділянки та/або живота (різної давності); встановити часовий зв’язок розвитку АГ із подібною травматизацією. Діагностичним методом вибору є комп’ютерна томографія нирок із внутрішньовенним контрастуванням.
Лікування. У частини пацієнтів прийнятним є вичікувальний консервативний підхід із застосуванням антигіпертензивних препаратів для контролю АТ, за показаннями — хірургічна евакуація гематоми.
1.9. Синдром Ліддла (Liddle)
Визначення та клінічна картина. Синдром Ліддла — рідкісне генетично зумовлене (з автосомно-домінантним типом успадкування) порушення функції дистальних канальців нирки зі збільшенням реабсорбції натрію та вторинним посиленням секреції калію. В його основі лежать мутації генів SCNNIB або SCNNIG, що кодують бета- або гамма-субодиниці амілоридчутливих натрієвих каналів епітелію тубулярного апарату нирок.
Основні прояви синдрому Ліддла:
1) гіпокаліємія та гіперкалійурія;
2) артеріальна гіпертензія;
3) метаболічний алкалоз;
4) гіпернатріємія;
5) нормальний або знижений рівень альдостерону та реніну;
6) порушення інтелектуального та/або фізичного розвитку;
7) дегідратація, сонливість, м’язова слабкість, міалгії (як прояви гіпокаліємії).
Поширеність і характер АГ. АГ присутня практично в усіх хворих; зазвичай розвивається в осіб молодого віку (до 35 років), може бути діагностована в ранньому дитячому віці (перші роки життя); при відсутності лікування рівень АТ може бути досить високим.
Механізми розвитку АГ: хронічне перенавантаження натрієм та об’ємом. АГ при синдромі Ліддла є солечутливою та об’ємзалежною.
Діагностика. Запідозрити цей рідкісний синдром можна, якщо у хворого молодого віку (дитини раннього віку) АГ поєднується з переліченими вище порушеннями електролітного та кислотно-лужного балансу. Для підтвердження діагнозу рекомендується проведення генетичних обстежень.
Лікування. Обмеження кухонної солі в раціоні < 5 г/добу; калійзберігаючі діуретики (амілорид, тріамтерен), що блокують надмірно підвищену при синдромі Ліддла функцію натрієвих каналів тубулярного апарату нирок і призводять до зниження АТ і корекції гіпокаліємії та метаболічного алкалозу. Інші антигіпертензивні препарати (у т.ч. антагоністи альдостерону) малоефективні. При адекватному лікуванні прогноз є досить сприятливим. У частині випадків може бути застосована трансплантація нирки, після якої усуваються АГ та метаболічні порушення.
1.10. Синдром Гордона, або псевдогіпоальдостеронізм ІІ типу
Визначення та клінічна картина. Синдром Гордона — рідке генетично обумовлене (за автосомно-домінантним типом успадкування) порушення функції ниркових канальців. Залучена тіазидчутлива натрійхлоридна котранспортна система у дистальних канальцях нефрона. Синдром обумовлений мутаціями двох різних, але взаємопов’язаних, генів, що кодують утворення білків, які беруть участь у регуляції натрійхлоридної котранспортної системи.
Провідними клінічними ознаками синдрому Гордона є:
1) гіперкаліємія;
2) артеріальна гіпертензія;
3) метаболічний ацидоз;
4) нормальні показники швидкості клубочкової фільтрації.
Також можуть спостерігатися гіперхлоремія; гіпоренінемія при низьких або нормальних рівнях альдостерону; невисокий зріст; іноді — м’язова слабкість; в деяких випадках — порушення інтелектуального розвитку; порушення розвитку зубів.
Поширеність та характер АГ. Підвищення АТ має місце приблизно у 60–70 % осіб із цією патологією. АГ розвивається не відразу, у більшості випадків — на третьому десятилітті життя. За відсутності лікування рівень АТ може бути досить високим та відповідати 3-му ступеню АГ.
Механізми розвитку АГ: хронічне перенавантаження натрієм і об’ємом. АГ при синдромі Гордона — солечутлива і об’ємзалежна.
Діагностика. Припущення про наявність цього рідкісного синдрому може виникнути, якщо у молодого хворого АГ поєднується з переліченими вище порушеннями електролітного та кислотно-лужного балансу. Рекомендується визначення активності реніну та рівня альдостерону плазми. Доцільним є обстеження кровних родичів обох статей в різних поколіннях. Генетичні обстеження в широкій практиці досі недоступні.
Лікування. Обмеження кухонної солі в дієті; препарати вибору — тіазидні діуретики, їх застосування призводить до нормалізації АТ і рівня калію в крові, а відміна — до повернення цих, а також нових проявів захворювання. Позитивна відповідь на тіазидні діуретики зберігається роками/десятиліттями.
1.11. Реноваскулярна АГ
Варіанти уражень ниркових артерій, що призводять до розвитку реноваскулярної АГ, включають:
- фібром’язову дисплазію (ФМД);
- атеросклероз;
- системні васкуліти (артеріїт Такаясу, вузликовий поліартеріїт);
- розшарування аорти/ниркових артерій;
- тромбози при антифосфоліпідному синдромі, пухлинах та ін.;
- пошкодження судин нирок (травми при літотрипсії, трансплантації нирки, опромінювання й ін.);
- тиск ззовні (кістами, пухлинами, гематомами, при ретроперитонеальному фіброзі й ін.);
- артеріовенозні мальформації або фістули.
Поширеність і характер АГ. Реноваскулярні АГ становлять близько 1 % всіх випадків АГ. Серед осіб із рівнем діастолічного АТ ≥ 125 мм рт.ст. і наявністю ретинопатії ІІІ–ІV ступеня реноваскулярні АГ становлять до 30 % випадків. Оскільки найчастішою причиною реноваскулярних АГ є атеросклеротичне ураження ниркових артерій, поширеність їх зростає з віком. Характер АГ широко варіює: від безсимптомних форм і помірного підвищення АТ — до стійких високих цифр АТ (АГ 3-го ступеня), резистентної АГ з прогресуючим зниженням функції нирок.
Фібром’язова дисплазія — захворювання невідомої етіології (у 10 % хворих констатують генетичну схильність за автосомно-домінантним типом спадковості), характеризується фіброзуванням і/або надлишковою проліферацією клітин артеріальної стінки. Найбільш часто вражаються ниркові (до 75 % усіх випадків ФМД), сонні та хребтові артерії, рідше — мезентеріальні, плечові, клубові. Близько 1/3 осіб із ФМД мають ураження більше ніж одного судинного басейну. Зміни венозних та лімфатичних судин при ФМД відсутні. Поширеність АГ при ФМД становить 10–15 %. Середній вік встановлення діагнозу ФМД, за даними реєстру США, — близько 50 років, але часто (особливо при наявності раннього початку АГ) діагноз встановлюють у молодих дорослих чи у дітей. Частіше хворіють жінки. ФМД може призводити до потовщення стінок артерій зі зменшенням їх просвіту, також можливий розвиток ускладнень, включаючи формування аневризм і розшарування. Клінічна картина варіабельна: у частини пацієнтів ФМД перебігає безсимптомно, в інших випадках — симптоматика обумовлюється локалізацією і особливостями судинного ураження.
Варіанти клінічних проявів можуть включати:
1) при ФМД ниркових артерій — АГ, шуми над проекціями ниркових артерій;
2) при ФМД сонних і хребтових артерій — головні болі (за типом мігрені), запаморочення, болі в шиї, пульсуючі шуми в вухах, транзиторні ішемічні атаки/ішемічні інсульти, шуми над проекціями сонних артерій;
3) при ФМД мезентеріальних артерій — абдомінальний біль після їжі, зниження маси тіла;
4) при ФМД артерій кінцівок — біль у кінцівках при навантаженні, що зникає у спокої, різний АТ на кінцівках.
В осіб із ФМД ниркових артерій стенози частіше локалізовано в середніх і дистальних відділах судини, прогресування відмічається у 30–60 % пацієнтів упродовж 5 років.
Атеросклеротичне ураження становить до 90 % всіх випадків стенозів ниркових артерій. Серед осіб, яким проводиться катетеризація серця, поширеність атеросклеротичного ураження ниркових артерій досягає 30 %, а серед хворих, старших за 65–70 років, — 50 %. Типовою локалізацією судинного ураження при атеросклерозі є місце відходження від аорти ниркових артерій та їх проксимальна третина, у поєднанні з ураженням прилеглих відділів черевної аорти. При вираженому атеросклерозі ураження може мати дифузний характер із залученням інтраренальних артерій. Прогресування стенозу ниркових артерій впродовж 5 років спостерігається приблизно у 50 % пацієнтів. Поряд з АГ важливим клінічним проявом вважають зниження функції нирок (у зарубіжній літературі іноді використовують термін «ішемічна нефропатія»). Так, при обструкції > 60 % просвіту ниркової артерії спостерігається прогресуюче зменшення об’єму ниркової паренхіми і розвиток азотемії. Приблизно у 30 % хворих з атеросклеротичним ураженням ниркових артерій за відсутності лікування спостерігається зниження функції нирок протягом 6 років. За епідеміологічними даними, атеросклеротичне ураження ниркових артерій є причиною 14 % випадків термінальної ниркової недостатності, що потребує діалізного лікування.
Механізми розвитку АГ. Звуження ниркових артерій до 60–80 % просвіту при ФМД або склеротичному їх ураженні призводить до ішемії нирки, хронічної активації ренін-ангіотензинової і симпатичної систем, периферичної вазоконстрикції, затримки натрію і води. При тривалому істотному звуженні ниркових артерій розвиваються необоротні зміни мікроциркуляторного русла нирок, –тубулоінтерстиціальний фіброз і гломерулосклероз.
Діагностика. Підходи до діагностики стенозів ниркових артерій викладені в Рекомендаціях American College of Cardiology Foundation/American Heart Association з нагляду за пацієнтами з ураженням периферичних артерій (2011). Рекомендовано такі методи обстеження:
- дуплексна ультрасонографія ниркових судин — скринінговий тест, що дозволяє оцінити розміри нирок, функціональний резерв кровотоку і розрахувати резистивний індекс; при оцінці гемодинамічно значимого (суттєвого) стенозу чутливість методу становить 92 %, специфічність — 85 %.
- комп’ютерно-томографічна ангіографія — скринінговий тест; зважаючи на ризик розвитку контраст-індукованої нефропатії (особливо при значному зниженні функції нирок), проведення його потребує обережності; результати дослідження складно інтерпретувати при наявності виражених кальцифікуючих уражень судин; чутливість для діагностики стенозу ниркових артерій — до 94 %, специфічність — 60–90 %;
- магнітно-резонансна ангіографія — скринінговий тест; застосовується з обережністю з огляду на ризик нефротоксичної дії гадолінійутримуючого контрасту у хворих із помірним/важким зниженням функції нирок; протипоказанням для застосування є імплантовані прилади різного роду (штучні водії ритму, кардіостимулятори та ін.); чутливість та специфічність у діагностиці стенозу ниркових артерій досягають 90–100 %;
- за недостатньої інформативності перелічених неінвазивних тестів та високої ймовірності стенозу — катетерна ангіографія ниркових артерій.
Не рекомендується використовувати скринінгові тести для діагностики стенозу ниркових артерій:
- каптоприловий тест із скануванням нирок;
- селективне визначення активності реніну в крові, що відтікає від ниркових вен;
- активність реніну плазми;
- каптоприловий тест з оцінкою активності реніну плазми після прийому каптоприлу.
Обстеження з метою виявлення клінічно значимого стенозу ниркових артерій показане в першу чергу таким категоріям хворих на АГ:
- із розвитком АГ у віці до 30 років;
- розвитком тяжкої АГ, що визначають як рівні систолічного АТ > 160 мм рт.ст. та/або діастолічного АТ > 110 мм рт.ст. віком 55 років і більше;
- раптовим та стійким погіршенням контролю АТ, який раніше добре піддавався лікуванню;
- резистентною АГ;
- злоякісною АГ
- значним погіршенням функції нирок на тлі прийому інгібіторів АПФ або сартанів;
- зменшенням розміру нирки (атрофія), а також різницею в розмірах нирок, що перевищує 1,5 см;
- епізодами раптового набряку легенів неясної етіології, особливо у хворого зі зниженою функцією нирок.
Пацієнтам зі встановленим діагнозом ФМД однієї локалізації рекомендуються неінвазивне обстеження інших судинних басейнів на предмет мультифокального артеріального ураження. Хворим із ФМД сонних або хребцевих артерій також рекомендується проведення ангіографічного обстеження інтракраніальних артерій для виключення наявності їх аневризматичних змін (при їх виявленні потрібні відповідні лікувальні підходи).
Лікування
Фібром’язова дисплазія. При безсимптомному перебігу та відсутності АГ стан вважається доброякісним, специфічне лікування не проводиться, рекомендується інструментальний контроль у динаміці в районі судинного ураження. Для зниження ризику тромбозів у таких пацієнтів може застосовуватись антитромбоцитарна терапія (ацетилсаліцилова кислота 75–100 мг/добу).
При наявності АГ для її контролю можна використовувати різні антигіпертензивні препарати (найбільш вивчені інгібітори АПФ або сартани, можливо в комбінації з блокаторами кальцієвих каналів та/або діуретиками), при цьому дуже важливий ретельний лікарський контроль і регулярна оцінка стану функції нирок.
Блокатори ренін-ангіотензинової системи протипоказані у випадках:
1) білатерального ураження ниркових артерій;
2) унілатерального ураження високого ступеня;
3) ураження судин єдиної нирки;
4) атрофії контралатеральної нирки;
5) ШКФ < 30 мл/хв/м2.
За відсутності ефекту від антигіпертензивної терапії, а також при тенденції до зниження функції нирок та розвитку інших ускладнень перевагу віддають черезшкірній балонній ангіопластиці, частіше без стентування, однак за наявності уражень або при надмірній податливості судинної стінки можуть використовуватись стенти.
Атеросклеротичне ураження ниркових артерій. Стандартне лікування включає:
1) багатокомпонентну антигіпертензивну терапію з використанням тих самих препаратів і з урахуванням тих самих пересторог, що й при лікуванні АГ на тлі ФМД;
2) застосування статинів у високих/максимальних дозах (цільовий рівень холестерину ліпопротеїнів низької щільності < 1,8 ммоль/л, в разі недосягнення цільового рівня — зниження на 50 % від вихідного вмісту в крові);
3) відмова від паління;
4) оптимальний контроль глікемії;
5) призначення ацетилсаліцилової кислоти в дозі 75–100 мг/добу після досягнення цільового АТ.
Показання до реваскуляризації (ангіопластика зі стентуванням) після публікації результатів масштабних досліджень ASTRAL і CORAL у таких пацієнтів значно звузились. У сучасних міжнародних рекомендаціях зазначається, що навіть у осіб зі зниженою функцією нирок (без швидкого прогресування за останні 6–12 міс.), протеїнурією > 1 г/добу, атрофією нирки і дифузним ураженням інтралатеральних артерій перевагу слід віддавати медикаментозній терапії за умов досягнення адекватного контролю АТ.
Натепер реваскуляризація є резервним методом лікування у таких випадках:
1) рецидивуюча та незрозуміла гостра серцева недостатність або набряк легенів;
2) рецидивуюча нестабільна стенокардія;
3) прогресуюче зниження функції нирок;
4) недостатня ефективність медикаметозної антигіпертензивної терапії або її непереносимість.
Хірургічне лікування (реваскуляризація) використовується значно рідше, переважно в осіб, яким неможливо виконати ангіопластику зі стентуванням, або при їх недостатній ефективності.
1.12. Довідкові матеріали
Викладення матеріалу в частині Рекомендацій, присвяченій диференційній діагностиці гіпертонічної хвороби і ниркових гіпертензій, базується на кількох опублікованих у 2012 і 2013 рр. міжнародних рекомендаціях KDIGO (Kidney Disease Improving Global Outcomes), до яких включені Рекомендації з діагностики і лікування хронічних захворювань нирок, Рекомендації з контролю АТ у хворих із хронічними захворюваннями нирок, Рекомендації з діагностики і лікування гломерулонефритів та ін.
Наводимо сучасну номенклатуру та принципи класифікації хронічних захворювань нирок і гострого ураження нирок.
Номенклатура і класифікація уражень нирок (KDIGO, 2012)
Хронічна хвороба нирок (ХХН). Цей термін натепер є загальноприйнятим. Під ХХН розуміють порушення структури та/або функції нирок, що наявне протягом > 3 місяців (табл. 1).
ХХН — це збірне поняття, що об’єднує гетерогенні захворювання, які порушують структуру та/або функцію нирок; мають різні клінічні особливості і неоднорідні за етіологією, ступенем тяжкості та темпом прогресування.
На різних етапах ХХН становлення і розвиток хвороби часто перебігають безсимптомно; їх діагностика при цьому зазвичай відбувається під час скринінгових або випадкових обстежень, а також при обстеженні з приводу супутніх патологічних станів. При швидкопрогресуючому перебігу деяких варіантів ХХН розвиток значного зниження функції нирок можливий вже за декілька тижнів/місяців, однак у багатьох випадках темп прогресування значно повільніший (роки — десятиліття), а в окремих ситуаціях при багаторічному спостереженні за хворими чіткого прогресування ХХН виявити не вдається.
Гостре пошкодження нирок (ГПН) і ХХН. Хворі на ХХН на всіх стадіях мають підвищений ризик розвитку ГПН (раніше використовували термін «гостра ниркова недостатність»).
Визначення ГПН (адаптовано за KDIGO-AKI, 2012)
ГПН визначається при наявності у хворого будь-якої з перелічених нижче ознак:
- підвищення рівня креатиніну сироватки крові ≥ 26,5 мкмоль/л протягом 48 годин;
- підвищення рівня креатиніну сироватки крові у 1,5 раза і вище порівняно з його вихідним значенням (або його ймовірним значенням — з урахуванням клінічної ситуації) впродовж останніх 7 днів;
- зменшення об’єму сечі до рівня < 0,5 мл/кг/год за 6 годин.
У більшості випадків під час тривалого перебігу ХХН на його тлі можуть розвиватися 1 епізод ГПН або більше. Диференційна діагностика між ГПН та ХХН при першому виявленні зниження функції нирок зазвичай базується на особливостях конкретної клінічної ситуації. Якщо у хворого зниження функції нирок (ШКФ < 60 мл/хв/1,73 м2) виявлено вперше під час якого-небудь гострого захворювання при відсутності даних про більш раннє ураження нирок, зазвичай припускають ГПН. Покращення функції нирок протягом декількох днів/тижнів може підтвердити діагноз ГПН у такого пацієнта. У той же час у хворого з аналогічним порушенням функції нирок, вперше виявленим, за відсутності гострого захворювання зазвичай припускають наявність ХХН. Збереження зниженої функції нирок при подальшому спостереженні є підставою для підтвердження ХХН. В обох випадках для встановлення більш точного діагнозу треба провести повторну оцінку стану функції нирок та маркерів ниркового ураження.
Класифікація ХХН. Експертами KDIGO (2012) запропоновано класифікувати ХХН за такими трьома характеристиками:
1) етіологія;
2) ШКФ;
3) рівень альбумінурії
1. За етіологією виділяють 4 основні групи захворювань нирок:
1) гломерулярні;
2) тубулоінтерстиціальні;
3) судинні;
4) кістозні та вроджені ураження
2. Класифікація за рівнем ШКФ наведена в табл. 2.
Якщо у хворого має місце ШКФ, що відповідає стадії І або ІІ, але немає маркерів ураження нирок (табл. 1), діагноз ХХН не встановлюють.
3. За рівнем альбумінурії та протеїнурії виділяють три основні категорії захворювань нирок:
- із нормальним або несуттєво підвищеним умістом альбуміну в сечі;
- із помірною альбумінурією;
- зі значною альбумінурією (табл. 3).
Протеїнурія/альбумінурія. Під терміном «протеїнурія» розуміють наявність підвищеної кількості білка в сечі. Протеїнурія може бути наслідком втрати протеїнів плазми через:
- підвищення проникності клубочкового фільтру (альбумінурія, гломерулярна протеїнурія);
- недостатню канальцеву реабсорбцію профільтрованих низькомолекулярних протеїнів (тубулярна протеїнурія);
- підвищену концентрацію низькомолекулярних протеїнів у плазмі (протеїнурія переповнення, наприклад, з екскрецією легких ланцюгів імуноглобулінів при мієломі).
Протеїнурія також може відображати патологічну втрату білків, утворених безпосередньо в ниркових структурах (наприклад, у канальцях при їх пошкодженні) або в структурах сечовивідних шляхів (при інфекціях).
Ступінь вираженості протеїнурії розглядають як важливий фактор, що визначає темп прогресування ХХН. Є докази її безпосереднього пошкоджуючого впливу як на гломерулярні (подоцити — епітеліальні клітини капілярів клубочка), так і на тубулярні структури. Ступінь вираженості протеїнурії може бути використаний як один із маркерів прогнозування перебігу ХХН та відповіді на лікування.
Оцінка швидкості клубочкової фільтрації. ШКФ — найважливіший показник стану функції нирок. Основні методи визначення включають:
1) підрахунок з використанням формул на базі визначення рівня креатиніну сироватки крові (найбільш простий і дешевий, використовується повсюди);
2) підрахунок із використанням формул на базі визначення вмісту цистатину С сироватки крові;
3) безпосередня оцінка з використанням методик кліренсу (інуліну, ендогенного креатиніну та ін.).
З багаточисленних формул розрахунку ШКФ ми наводимо дві, що базуються на рівнях креатиніну сироватки крові — Кокрофта — Гаулта та MDRD. Ці формули вже достатньо добре відомі вітчизняним клініцистам і цілком придатні для використання в широкій практиці. Для ряду ситуацій більш точними можуть бути формули, запропоновані експертами KDIGO, 2012: CKD-EPI creatinine, що базується на визначенні креатиніну сироватки крові, та CKD-EPI сystatin C, що базуються на визначенні цистатину С сироватки (обидві ці формули дуже громіздкі, доступні онлайн www.kdigo.org).
А. Формула Кокрофта — Гаулта (при рівнях ШКФ < 10–15 мл/хв не використовується):
ШКФ = (140 – вік (років) х вага тіла (кг) х 0,85 (для жінок) / 0,81 х креатинін сироватки (мкмоль/л).
Б. Формула MDRD (особливо корисна при рівнях ШКФ < 10–15 мл/хв):
ШКФ = 170 х (Кр. х 0,0113) – 0,999 х вік (років) – 0,176 х (Сечов. х 2,8) –– 0,17 х Альб. х 0,762 (для жінок),
де Кр. — рівень креатиніну сироватки (мкмоль/л); Сечов. — рівень сечовини сироватки (ммоль/л); Альб. — рівень альбуміну сироватки (г/дл).
Розрахунок ШКФ за цією формулою можливий в online–режимі за допомогою пошуку в Google (ввести «калькулятор СКФ»).
Продовження у наступному номері

/21_u/21_u.jpg)
/24_u/24_u.jpg)
/24_u/24_u2.jpg)