Журнал «Травма» Том 15, №5, 2014
Вернуться к номеру
Підхід до лікування травматичного остеомієліту у хворих iз гірських районів з дефіцитом йоду
Авторы: Шимон В.М., Ковач В.В., Шерегій А.А., Сливка Р.М., Шимон М.В. - ДВНЗ «Ужгородський національний університет»; Інститут «Травма», м. Ужгород
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Представлені результати лікування хворих із хронічним посттравматичним остеомієлітом довгих кісток нижніх кінцівок. Клінічний матеріал базується на обстеженні і лікуванні хворих із посттравматичним остеомієлітом довгих трубчастих кісток нижніх кінцівок, у частини яких в лікуванні використані регіонарна інфузія і лазерна секвестректомія. Для лазерної остеоперфорації і секвестректомії використовували напівпровідниковий лазер «Ліка-хірург» із довжиною хвилі 980 нм, потужністю постійного випромінювання до 10 Вт. Корекція йодного балансу позитивно впливає на відновлення. Рентгенологічна динаміка, показники інтоксикації, імунологічного статусу, а також динаміка ранового процесу свідчать про високу ефективність запропонованої методики лікування, що дозволяє прискорити санацію кістки, її регенерацію, скоротити терміни лікування та реабілітації хворих.
Представлены результаты лечения больных с хроническим посттравматическим остеомиелитом длинных костей нижних конечностей. Клинический материал основан на обследовании и лечении больных с посттравматическим остеомиелитом длинных трубчатых костей нижних конечностей, у части которых в лечении использованы регионарная инфузия и лазерная секвестрэктомия. Для лазерной остеоперфорации и секвестрэктомии использовали полупроводниковый лазер «Лика-хирург» с длиной волны 980 нм, мощностью постоянного излучения до 10 Вт. Коррекция йодного баланса положительно влияет на восстановление. Рентгенологическая динамика, показатели интоксикации, иммунологического статуса, а также динамика раневого процесса свидетельствуют о высокой эффективности предложенной методики лечения, позволяющей ускорить санацию кости, ее регенерацию, сократить сроки лечения и реабилитации больных.
The treatment outcomes of patients with chronic posttraumatic osteomyelitis of long bones of lower extremities are presented. The clinical data are based on examination and treatment of patients with posttraumatic osteomyelitis of long tubular bones of lower extremities, in treatment of some of them regional infusion and laser sequestrectomy were used. The semiconductor laser «Lika-surgeon» with wave length of 980 nm, constant output power up to 10 W, was used for laser osteoperforation and sequestrectomy. Correction of iodine balance has a positive impact on its restoration. The rontgenological dynamics, parameters of intoxication, immunological status, as well as dynamics of wound process testify to high effectiveness of the offered method of treatment, which makes it possible to accelerate bone sanation, its regeneration, to minimize period of treatment and rehabilitation of patients.
хронічний остеомієліт, секвестректомія, лазер.
хронический остеомиелит, секвестрэктомия, лазер.
chronic osteomyelitis, sequestrectomy, laser.
Статья опубликована на с. 79-84
Вступ
Під терміном «остеомієліт» (грец. osteomyelitis), вперше запровадженим у практику в 1831 p. французьким хірургом Рейно, розуміють інфекційний запальний процес усіх елементів кістки, власне кістки (остит), кісткового мозку (мієліт), окістя (периостит) та прилеглих тканин внаслідок екзогенного проникнення інфекції, що супроводжується остеолізом і остеонекрозом [3, 6, 7].
За даними Всесвітньої організації охорони здоров’я, остеомієліт становить близько 7 % у структурі захворювань опорно-рухового апарату [13]. Остеомієліт ускладнює перебіг 5–67 % травм, зокрема відкриті переломи ускладнюються гнійно-некротичними наслідками з частотою до 59,7 %, остеомієлітом — до 15,4 %, а після остеосинтезу закритих переломів цей показник сягає 0,65–0,96 % [10]. Довгі кістки кінцівок уражаються в 75,3–88,7 % випадків. Незважаючи на лікувальні заходи, процес у 11,3–32,5 % випадків має тенденцію до хронізації з формуванням секвестрів, нориць, залишкових порожнин та періодичними загостреннями. В загальній структурі інвалідності внаслiдок травм опорно-рухового апарату частка остеомієліту становить 13 % [1, 6, 8].
Незважаючи на великі успіхи в лікуванні посттравматичного остеомієліту, залишається актуальним пошук клінічних рішень із профілактики ряду ранніх ускладнень та прогностичних критеріїв у діагностиці та прогнозуванні розвитку посттравматичного остеомієліту, особливо у хворих iз дефіцитом йоду.
Дотепер достатньо багато маловивчених біохімічних впливів, які пов’язані не тільки з вираженим запальним процесом кісткової тканини, але й із впливом хірургічного втручання на перебіг патологічного процесу. Також необхiдно поглиблене вивчення характеру компенсаторних регенеративних механізмів та пов’язаних з цим змін в ендокринній системі хворих.
Сукупність біохімічних показників складається з параметрів білково-вітамінного обміну та рівня активності деяких ферментів, зміни яких відображаються при травматичному остеомієліті та запаленні, але не є специфічними для цієї патології.
Поряд з етіотропною терапією та хірургічним лікуванням важливу роль у подоланні травматичного остеомієліту відіграє також імунна система. Відомо, що остеомієлітичний процес завжди перебігає на фоні вторинного імунодефіциту, який може бути як основним захворюванням, так і наслідком наявного в організмі кістково-гнійного процесу (Шубейко Л.О., 2005; Сулима В.С., 2002). Вторинний імунодефіцит затягує перебіг захворювання, призводить до хронізації та не дозволяє досягти стійкої ремісії (Дехтяренко К.О., 2001; Деменко А.В., 2005).
Із літературних джерел відомо про залежність хронізації та рецидивуючого перебігу остеомієліту від дефіциту факторів неспецифічної резистентності та неповноцінності функціонування імунної системи (Григоровський В.В., Магомедов О.М., 2000; Земляний А.В. та ін., 2002; Корж А.А., 2009), а також про виявлений феномен її гіперактивності на фоні Т-клітинної супресії. Блокада Т-лімфоцитів призводить до гальмування проліферації остеобластів на всіх стадіях регенерації, а стимуляція мікрофагальної ланки з продукуванням активуючого фактора остеобластів впливає на остеогенез (Рибарчук О.О., 1989).
Складність заміщення кісткових порожнин та дефектів при хронічному остеомієліті полягає у пригніченому перебігу репаративних процесів, які зумовлені станом мікроциркуляції та склеротичними змінами кістки поряд iз локальними змінами у більшості хворих на фоні розвитку токсикозу. У хворих iз дефіцитом йоду описані розлади розвиваються ще частіше, а гормональні зміни призводять до більш тяжких наслідків.
Лікування травматичного остеомієліту є значною економічно-соціальною проблемою, оскiльки страждають переважно пацієнти працездатного віку.
Мета дослідження: покращити результати лікування травматичного остеомієліту у хворих із нестачею йоду, доповнюючи комплекс лікувальних заходив використанням лазерного випромінювання на вогнище деструкції та впливом на кров’яне русло.
Матеріал та методи дослідження
Дослідження охопило групу пацієнтів, пролікованих з приводу посттравматичного остеомієліту в період 2008–2013 років на базі клініки травматології-ортопедії Закарпатської обласної клінічної лікарні (ЗОКЛ) ім. А. Новака. Проведено аналіз історій хвороби 70 пацієнтів, серед них 37 мешканців гірських районів області, у яких за результатами лабораторних досліджень виявлено нестачу йоду. Також проаналізовано результати лікування, як хірургічного, так і малоінвазивного, із застосуванням високо- та низькоінтенсивного лазерного випромінювання у 46 пацієнтів, які склали основну групу. В їх лікуванні стандартні, загальноприйняті заходи доповнювались власною методикою, яка вивчається Iнститутом «Травма» і включає в себе катетеризацію a.epigastrica inferior з наступним пролонгованим регіонарним введенням антибактеріальних та судинних препаратів за допомогою інфузоматів Lineomat, ВЕДА-2, ДШВ та лазерні маніпуляції. Відповідно в комплексі лікування 24 пацієнти контрольної групи отримали загальноприйняте лікування в наступному обсязі: санація вогнища гнійно-некротичного процесу (секвестректомії, некректомії), антибактеріальна, дезінтоксикаційна та судинна терапія, що проводилась внутрішньовенним, внутрішньоартеріальним (пункційно) та внутрішньом’язовим шляхами, внутріартеріальні маніпуляції та лазерні методики не застосовувались. Хворі розділені по групах згідно з віковою та гендерною приналежністю: перша група — 13 чоловіків і 8 жінок вiком 20–40 років, друга група — 11 чоловіків та 14 жінок вiком 41–60 років, третя група — 13 чоловіків та 11 жінок старше 60 років.
Посів виділень із рани або вогнища запалення робили всім пацієнтам, результати продемонстровані в діаграмі, наведеній нижче (рис. 1). Патогенний стафілокок висівається у 61–100 % випадків у вигляді монокультури або в асоціації з іншими мікроорганізмами. На сьогодні час з’явились численні штами мікроорганізмів, які не чутливі до більшості антибактеріальних препаратів [10]. Характер мікробної флори, яка висівалася у хворих, був типовим [4, 7, 10, 14] і включав стафілококи (34,3 %), кишкову паличку (26,5 %), синьогнійну паличку (18,2 %), протей (11,6 %), стрептококи (9,4 %). У 32,7 % випадкiв висіяно змішану флору (рис. 1).
/80/80.jpg)
Відомо, що деякі бактерії здатні виключати процеси антитілоутворення як прямим, так і опосередкованим шляхом (шляхом індукції факторів, що перешкоджають активації Т-клітин) і тим самим знижувати загальний рівень імунної відповіді. При такому механізмі імунорегуляції перебіг гнійного процесу залежить не тільки від імуногенного потенціалу інфікуючих мікроорганізмів, але й від початкового імунного статусу організму хворого [6].
Таким хворим після неодноразового лікування без отримання бажаного ефекту нами було запропоновано розширення спектра лікувальних заходів, та за умови згоди пацієнта він переводився до основної групи. Хворим для стимулювання ендокринної системи в післяопераційний період було призначено йодомарин 300 мкг на добу 2–3 місяці.
Результати досліджень
У результаті проведеного лікування спостерігалося прискорення динаміки ранового процесу у хворих основної групи, що проявлялося у скороченні термінів очищення рани, появi грануляцій та початку епітелізації. Післяопераційні рани заживали вторинним натягом протягом 14–18 діб. З метою фіксації кісткових фрагментів використовували апарати зовнішньої фіксації, зорема перевагу надавали багатоплощинному апарату зовнішньої фіксації типу Попсуйшапки, який для зручності використання доповнили мобілізуючою муфтою (патентна довідка № u201311554), та апарату зовнішньої фіксації для репозиції відламків довгих кісток та компресійно-дистракційного остеосинтезу власної конструкції (патент України № 49002), представлений на рис. 2.
/81/81.jpg)
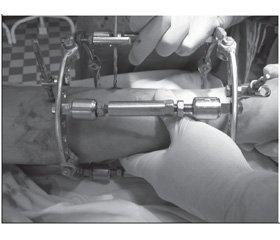
Клінічний приклад. Пацієнт К., 56 років, отримав травму в побуті при падінні на гомілку деревини в ході заготівлі дров на зиму. З місця пригоди доставлений в центральну району лiкарню, де було діагностовано відкритий перелом середньої третини обох кісток гомілки, виражений набряк м’яких тканин. З метою підготовки до оперативного втручання застосовано скелетне витяжіння на 10 діб. Для операції пацієнт направлений в ЗОКЛ ім. А. Новака, де було виконано позавогнищевий остеосинтез за допомогою апарату зовнішньої фіксації власної конструкції. Етапи монтажу апарату представлені на рис. 3.
Післяопераційний період перебігав прогнозовано, у зв’язку із вираженим забрудненням рани в момент травми констатовано наявність ознак остеомієліту, відповідно призначена адекватна антибактеріальна терапія. Динаміка та рентгенологічна картина в процесі лікування представленi на рис. 4, було констатовано прискорення регенерації кісткової тканини на 10–12 діб порівняно з контрольною групою.
Видалення нежиттєздатної кісткової тканини вимагає заміщення дефекту, що у хворих на посттравматичний остеомієліт виконують в умовах гнійної інфекції, рубцево змінених м’яких тканин та виражених нейродистрофічних змін.
Рівень ендотоксикозу оцінювали за вмістом у крові середньомолекулярних пептидів (СМП), які є ендогенними сполуками із середньою молекулярною масою від 500 до 5000 Да, їх рiвень зростає при наростанні інтоксикаційного синдрому.
Як видно на рис. 5, у всіх хворих із клінікою посттравматичного остеомієліту при наростанні інтоксикації у крові різко пiдвищувався рівень СМП, причому в основному за рахунок пулу, що визначається на довжині хвилі 254 нм і характеризує токсичні властивості крові (до 0,441 ± 0,050 у хворих контрольної групи та 0,446 ± 0,060 — в основній групі, у здорових — 0,333 ± 0,040). Водночас при цьому у хворих різко зменшувалась величина Кс, що також вказує на наростання інтоксикації (до 1,05 ± 0,06, у здорових — 1,36 ± 0,04). У процесі лікування ці показники мали тенденцію до нормалізації, причому найбільш виражений ефект спостерігали у групі хворих із використанням лазерних секвестректомій та ультрафіолетового опромінення секвестральної порожнини (0,345 ± 0,040 та 1,25 ± 0,04 відповідно, при загальноприйнятому лікуванні — 0,377 ± 0,080 та 1,12 ± 0,05).
Рівень захисних сил організму оцінювали за деякими показниками імунітету, такими як загальна кількість лімфоцитів, які визначали в реакції Є-РУК, показники Т-хелперів, Т-супресорів, їхнє співвідношення (Тх/Тс), за рівнем у крові циркулюючих імунних комплексів (ЦІК).
При цьому ми відзначали, що у хворих із клінікою посттравматичного остеомієліту на фоні зменшення загальної кількості лімфоцитів (до 21,60 ± 0,64, у здорових — 44,40 ± 0,79) мало місце різке зменшення кількості Тх при помірному зменшенні Тс та відповідному зменшенні (до 1,03 ± 0,12 у хворих контрольної групи та 1,02 ± 0,14 — в основній групі, у здорових — 2,22 ± 0,12) їхнього співвідношення (Тх/Тс) в крові, зростання рівня циркулюючих імунних комплексів (до 32,46 ± 1,64 у хворих контрольної групи та 34,76 ± 1,84 — в основній групі, у здорових — 16,17 ± 0,53).
Після лікування має місце тенденція до нормалізації співвідношення Тх/Тс (до 1,64 ± 0,12 у хворих контрольної групи та 1,93 ± 0,14 в основній групі), зменшується рівень ЦІК у крові, що більш виражено в основній групі (до 27,67 ± 2,02 у хворих контрольної групи та 23,98 ± 1,94 — в основній групі), однак не досягає показників здорових людей (рис. 6).
Позитивна динаміка ендотоксикозу, йодного балансу, ранового процесу, підвищення захисних сил організму хворих на посттравматичний остеомієліт кісток нижніх кінцівок сприяє також скороченню перебування хворих на стаціонарному лікуванні — з 38,6 ± 2,8 ліжко-дня у контрольній групі, у якiй використовувалось загальноприйняте лікування, до 22,4 ± 3,2 ліжко-дня в основній групі, у якiй використана описана методика.
Висновки
Використання методики лікування посттравматичного остеомієліту довгих кісток нижніх кінцівок на фоні призначення йодомарину із використанням регіонарної інфузії та широким застосуванням високо- та низькоінтенсивного лазерного випромінювання дозволяє зупинити прогресування гнійно-деструктивного процесу у кістці та м’яких тканинах або повністю ліквідувати осередок ураження, досягти швидкої санації кістки, норицевих ходів та вогнища гнійно-некротичного процесу м’яких тканин, прискорити динаміку ранового процесу та регенерацію кістки, знизити рівень ендотоксикозу, підвищити імунологічний статус організму та нормалізувати йодний баланс, значно зменшити терміни лікування, а призначення препаратів йоду обумовлює корективні тенденції в лікуванні травматичних остеомієлітів у хворих із гірських регіонів.
Наші дослідження потребують ще більш поглибленого подальшого спостереження.
1. Амирасланов Ю.А. Основные принципы лечения больных с хроническим остеомиелитом длинных костей / Амирасланов Ю.А., Светухин А.М., Митиш В.А. // Вестник хирургии. — 2000. — Т. 159, № 2. — С. 91-96.
2. Григоровський В.В. Деякі групові відмінності структури осередків ураження при хронічному остеомієліті // Ортопедия, травматология и протезирование. — 2004. — № 2. — С. 46-52.
3. Замещение костных дефектов у больных с посттравматическим остеомиелитом длинных костей / Рушай А.К., Бодаченко К.А., Кривенко С.Н., Чучварев Р.В. // Ортопедия, травматология и протезирование. — 2004. — № 1. — С. 42-46.
4. Каплан А.В. Гнойная травматология костей и суставов / Каплан А.В., Махсон Н.Е., Мельникова В.М. — М.: Медицина, 1985. — 384 с.
5. Корж А.А. Посттравматический остеомиелит — инфекционное осложнение открытых повреждений / Корж А.А., Бэц Г.В. // Искусство лечения. — 2004. — № 8. — С. 56-59.
6. Коррекция вторичных нарушений иммунной системы при хроническом посттравматическом остеомиелите / Белохвостикова Т.С., Кирдей Л.Е., Гаврилова Е.Ю. и др. // Медицинская иммунология. — 2002. — Т. 4, № 2. — С. 228-229.
7. Мікробіологічний спектр збудників хронічного остеомієліту довгих кісток верхньої кінцівки та антибіотикотерапія захворювання / Бідненко С.І., Грицай М.П., Івченко Д.В. та ін. // Укр. мед. альманах. — 2002. — Т. 5, № 1. — С. 17-20.
8. Неворотин А.И. Введение в лазерную хирургию. — СПб.: СпецЛит, 2000. — 174 с.
9. Применение бактериофагов в лечении больных с посттравматическими гнойными осложнениями / Циклаури М.В., Кобахидзе Н.И., Аладашвили Л.Т., Таборидзе И.И. // Ортопедия, травматология и протезирование. — 2004. — № 2. — С. 53-56.
10. Тогаев Т.Р. О лечении открытых переломов длинных костей и профилактике раневой инфекции / Тогаев Т.Р., Абдулхаков Н.Т., Ишмухамедов Н.А. // Ортопедия, травматология и протезирование. — 2004. — № 4. — С. 84-86.
11. Трофимов А.Н. О лечении диафизарных переломов голени / Трофимов А.Н., Черновол С.И., Дунай О.Г. // Ортопедия, травматология и протезирование. — 2004. — № 1. — С. 21-24.
12. Ono W. Osteomyelitis / Ono W., Saotome K. // Ryoikibetsu Shokogun Shirizu. — 1999. — Vol. 23, № 1. — P. 599-602.
13. Post-traumatic osteomyelitis: analysis of inflammatory cells recruited into the site of infection / Wagner C., Kondela K., Bernschneider T. et al. // Shock. — 2003. — Vol. 20(6). — P. 503-510.
14. Sax H. Osteomyelitis / Sax H., Lew D. // Curr. Infect. Dis. Rep. — 1999. — Vol. 1, № 3. — P. 261-266.
15. Дехтяренко Н.О. Вторинний імунодефіцит при посттравматичному остеомієліті та його корекція // Вісник ортопедії, травматології та протезування. — 2001. — № 1. — С. 34-35.
16. Деменко А.В. Особенности патогенного состава лимфоцитов при хроническом травматическом остеомиелите // Український медичний альманах. — Луганськ, 2009. — № 5. — С. 39-40.

/81/81_2.jpg)
/82/82.jpg)
/82/82_2.jpg)