Украинский журнал хирургии 3-4 (26-27) 2014
Вернуться к номеру
Болевой синдром при оперативных вмешательствах большой и средней травматичности
Авторы: Смирнова Н.Н. - Донецкий национальный медицинский университет им. М. Горького; Онищенко Е.В. , Мендзяк Р.М. , Климачева И.Е. - КЛПУ «Донецкое областное клиническое территориальное медицинское объединение
Рубрики: Хирургия
Разделы: Клинические исследования
Версия для печати
Одной из основных причин послеоперационных осложнений рассматривается хирургический стресс-ответ – комплекс изменений нейроэндокринного, метаболического и воспалительного характера, развивающийся в результате хирургической травмы. Хирургический стресс-ответ становится основной причиной периоперационной дисфункции различных органов и систем (боль, катаболизм, нарушения иммунитета и гемостаза, дисфункция легких, желудочно-кишечного тракта, сердечно-сосудистой системы). Оценка интенсивности послеоперационного болевого синдрома при оперативных вмешательствах различной травматичности с целью последующей разработки рекомендаций по ее профилактике и лечению является актуальной проблемой.
Цель исследования - изучить интенсивность послеоперационного болевого синдрома при оперативных вмешательствах различной травматичности в условиях многопрофильной хирургической клиники.
Для оценки интенсивности послеоперационного болевого синдрома использована визуально-аналоговая шкала интенсивности боли.
Наблюдение продолжалось от 0 часов до 72 часов послеоперационного периода включительно.
Оценка интенсивности послеоперационного болевого проводилась в трех группах: группа 1 (n = 68) – оперативные вмешательства средней травматичности, группа 2 (n = 82) – большой травматичности, группа 3 (n = 23) – оперативные вмешательства при огнестрельных ранениях брюшной полости и забрюшинного пространства. Группы 1 и 2 были сопоставимы по полу и возрасту. Третья группа на 100% состояла из мужчин возрастом от 28 до 62 (в среднем 36,6 ± 3,33).
В послеоперационном периоде пациенты всех трех групп были разделены на подгруппы в зависимости от различных схем обезболивания: с использованием эпидуральнй анестезии и без эпидуральной анестезии. Дополнительно группы были разделены на подгруппы: внутримышечное введение промедола или промедола с дексотопрофеном.
Скорость инфузии ропивакаина подбиралась индивидуально в зависимость от интенсивности боли и уровня артериального давления (допускалось снижение не более 20-25% от исходного). При усилении болевого синдрома во всех группах назначали дополнительное введение нестероидных противовоспалительных препаратов.
При оперативных вмешательствах большой травматичности средний показатель интенсивности болевого синдрома по визуально-аналоговой шкале в группах без использования продленной эпидуральной анестезии находится в диапазоне сильных болевых ощущений ; при эпидуральной анестезии – в диапазоне болевых ощущений средней интенсивности.
Начало эпидуральной анестезии после травмы менее эффективно – длительность сохранения послеоперационной боли увеличивается в сравнении с использовнием эпидурального обезболивания как составной части мультимодальной анестезии во время оперативного пособия с последующим продолжением в послеоперационном периоде. Этот может быть объяснено запуском механизмов центральной сенситизации. Даное утверждение достоверно доказано при оценке боли у пациентов с огнестрельными ранениями, где эпидуральная анестезия начиналась значительно позднеее травмы.
Использование нестероидных противовоспалительных препаратов достоверно эффективно как компонент планового послеоперационного обезболивания только при оперативных вмешательствах средней травматичности без использования эпидуральной анестезии.
Нами также были изучена потребность в дополнительных дозах нестероидных противовоспалительных препаратов из-за выраженного болевого синдрома. За дополнительную потребность мы принимали более чем двукратное введение препаратов указанной группы сверх назначенного плана обезболивания в течение 72 часов после оперативного вмешательства. Значительный удельный вес дополнительного обезболивания во всех изученных группах вызывает необходимость поиска путей дальнейшей оптимизации послеоперационного обезболивания, в частности, применения превентивной анестезии. Дополнительные введения нестероидных противовопалительных препаратов требовались во всех группах пациентов. Внеплановое обезболивание было необходимо чаще при эпидуральной анестезии, начатой в послеоперационном периоде, по сравнению с началом обезболивания до оперции, при близком по травматичности хирургическом вмешательстве. Значительный удельный вес дополнительного обезболивания во всех изученных группах вызывает необходимость поиска путей дальнейшей оптимизации послеоперационного обезболивания, в частности, применения превентивной анестезии.
Однією з основних причин післяопераційних ускладнень розглядається хірургічний стрес-відповідь — комплекс змін нейроендокрінного, метаболічного і запального характеру, що розвивається в результаті хірургічної травми. Хірургічний стрес-відповідь стає основною причиною періопераційної дисфункції різних органів і систем (біль, катаболізм, порушення імунітету і гемостазу, дисфункція легких, шлунково-кишкового тракту, серцево-судинної системи). Оцінка інтенсивності післяопераційного больового синдрому при оперативних втручаннях різної травматичності з метою подальшої розробки рекомендацій щодо її профілактики та лікування є актуальною проблемою.
Мета дослідження — вивчити інтенсивність післяопераційного больового синдрому при оперативних втручаннях різної травматичності в умовах багатопрофільної хірургічної клініки.
Для оцінки інтенсивності післяопераційного больового синдрому використана візуально-аналогова шкала інтенсивності болю.
Спостереження тривало від 0 годин до 72 годин післяопераційного періоду включно.
Оцінка інтенсивності післяопераційного больового проводилась в трьох групах: група 1 (n = 68) — оперативні втручання середньої травматичності, група 2 (n = 82) — великий травматичності, група 3 (n = 23) — оперативні втручання при вогнепальних пораненнях черевної порожнини та заочеревинного простору. Групи 1 і 2 були порівнянні за статтю та віком. Третя група на 100% складалася з чоловіків віком від 28 до 62 (в середньому 36,6 ± 3,33).
В післяопераційному періоді пацієнти всіх трьох груп були розділені на підгрупи в залежності від різних схем знеболення: з використанням епідуральної анестезії і без епідуральної анестезії. Додатково групи були розділені на підгрупи: внутрішньом''язове введення промедолу або промедолу з дексотопрофеном.
Швидкість інфузії ропівакаіна підбиралася індивідуально в залежність від інтенсивності болю та рівня артеріального тиску (допускалося зниження не більше 20-25% від вихідного). При посиленні больового синдрому у всіх групах призначали додаткове введення нестероїдних протизапальних препаратів.
При оперативних втручаннях великий травматичності середній показник інтенсивності больового синдрому за візуально-аналоговою шкалою в групах без використання продовженої епідуральної анестезії знаходиться в діапазоні сильних больових відчуттів; при епідуральної анестезії — в діапазоні больових відчуттів середньої інтенсивності.
Початок епідуральної анестезії після травми менш ефективно — тривалість збереження післяопераційного болю збільшується в порівнянні з использовния епідурального знеболювання як складової частини мультимодальной анестезії під час оперативного посібники з подальшим продовженням в післяопераційному періоді. Цей може бути пояснено запуском механізмів центральної сенситизации. Дане твердження достовірно доведено при оцінці болю у пацієнтів з вогнепальними пораненнями, де епідуральна анестезія починалася значно Позднєєв травми.
Використання нестероїдних протизапальних препаратів достовірно ефективно як компонент планового післяопераційного знеболювання тільки при оперативних втручаннях середньої травматичності без використання епідуральної анестезії.
Нами також були вивчена потреба в додаткових дозах нестероїдних протизапальних препаратів через вираженого больового синдрому. За додаткову потребу ми приймали більш ніж дворазове введення препаратів зазначеної групи понад призначеного плану знеболювання протягом 72 годин після оперативного втручання. Значну питому вагу додаткового знеболення в усіх вивчених групах викликає необхідність пошуку шляхів подальшої оптимізації післяопераційного знеболювання, зокрема, застосування превентивної анестезії. Додаткові введення нестероїдних протівовопалітельних препаратів були потрібні у всіх групах пацієнтів. Позапланове знеболювання було необхідно частіше при епідуральної анестезії, розпочатої в післяопераційному періоді, порівняно з початком знеболювання до оперции, при близькому за травматичності хірургічному втручанні. Значну питому вагу додаткового знеболення в усіх вивчених групах викликає необхідність пошуку шляхів подальшої оптимізації післяопераційного знеболювання, зокрема, застосування превентивної анестезії.
One of the main causes of postoperative complications is considered a surgical stress response — a complex of changes in neuroendocrine, metabolic and inflammatory nature, evolving as a result of surgical trauma. Surgical stress response becomes the main cause of perioperative dysfunction of various organs and systems (pain, catabolism, impaired immunity and hemostasis dysfunction lungs, gastrointestinal tract, and cardiovascular system). The assessment of the intensity of postoperative pain during surgery various traumatic for subsequent development of recommendations for the prevention and treatment is an important issue.
The purpose of the study is — to examine the intensity of postoperative pain in surgical interventions in various traumatic conditions multidisciplinary surgical clinic.
To estimate the intensity of postoperative pain used visual analogue scale of pain intensity.
Observation lasted from 0 hours to 72 hours of the postoperative period, inclusive.
Assessment of the intensity of postoperative pain was conducted in three groups: group 1 (n = 68) — the average trauma surgery, group 2 (n = 82) — large trauma, group 3 (n = 23) — surgery for gunshot wounds of abdominal and retroperitoneal space. Groups 1 and 2 were matched by sex and age. The third group consisted of 100% of men aged 28 to 62 (average 36,6 ± 3,33).
Postoperatively, patients in all three groups were divided into subgroups based on various schemes analgesia: using epidural anesthesia and epidural anesthesia without. Additionally, the group was divided into subgroups: intramuscular or promedola promedola with deksotoprofenom.
Ropivacaine infusion rate selected individually depending on the intensity of pain and blood pressure (reduction allowed no more than 20-25% of the original). In the amplification of pain in all groups assigned the additional administration of non-steroidal anti-inflammatory drugs.
During surgery large traumatic average pain intensity on a visual analogue scale in groups without the use of epidural anesthesia is in the range of severe pain; for epidural anesthesia — the range of average pain intensity.
Starting epidural anesthesia after injury is less effective — the duration of preservation increases postoperative pain compared with ispolzovnii epidural analgesia as part of a multimodal anesthesia during surgical benefits, followed by a continuation in the postoperative period. This can be attributed to the launch of the mechanisms of central sensitization. Danoe assertion proved significantly when assessing pain in patients with gunshot wounds, where the epidural began significantly Pozdneev injury. Use the nonsteroidal anti-inflammatory drugs significantly effective as a component of routine postoperative analgesia only during surgery without the use of secondary traumatic epidural.
We have also studied the need for additional doses of nonsteroidal anti-inflammatory drugs because of significant pain syndrome. For additional demand we have been more than double the administration of drugs over specified group designated plan analgesia for 72 hours after surgery. Significant proportion of additional analgesia in all groups studied is the need to find ways to further optimize postoperative analgesia, in particular, use of preventive anesthesia. Additional administration of non-steroidal drugs protivovopalitelnyh required in all groups of patients. Unscheduled anesthesia was necessary more often with epidural anesthesia, which started in the postoperative period, compared with the beginning of anesthesia to opertsii at close to trauma surgery. Significant proportion of additional analgesia in all groups studied is the need to find ways to further optimize postoperative analgesia, in particular, use of preventive anesthesia.
послеоперационная боль, оценка боли, схемы обезболивания, оперативные вмешательства большой и средней травматичности, огнестрельные ранения.
післяопераційний біль, оцінка болю, схеми знеболювання, оперативні втручання великої та середньої травматичності, вогнепальні поранення.
post-operative pain, pain assessment, pain relief scheme, surgery large and medium trauma, gunshot wounds.
Статья опубликована на с. 44-51
Актуальность
Одной из основных причин послеоперационных осложнений рассматривается хирургический стресс-ответ – комплекс изменений нейроэндокринного, метаболического и воспалительного характера, развивающийся в результате хирургической травмы [9]. При высокой травматичности оперативного вмешательства эти изменения, первоначально имеющие компенсаторно–приспособительный характер, становятся избыточными, приобретая, таким образом, четко очерченную патологическую направленность. Хирургический стресс–ответ становится основной причиной периоперационной дисфункции различных органов и систем (боль, катаболизм, нарушения иммунитета и гемостаза, дисфункция легких, желудочно-кишечного тракта, сердечно-сосудистой системы) [1,2].
Острая боль повышает ригидность мышц грудной клетки и передней брюшной стенки, что ведет к снижению дыхательного объема, жизненной емкости легких, функциональной остаточной емкости и альвеолярной вентиляции. Следствием этого является коллапс альвеол, гипоксемия и снижение оксигенации крови. Затруднение откашливания на фоне болевого синдрома нарушает эвакуацию бронхиального секрета, что способствует аттелектазированию с последующим развитием легочной инфекции.
Боль сопровождается гиперактивностью симпатической нервной системы, что клинически проявляется тахикардией, гипертензией и повышением периферического сосудистого сопротивления. Помимо этого, симпатическая активация вызывает послеоперационную гиперкоагуляцию и, следовательно, повышает риск тромбообразования. На этом фоне у пациентов высокого риска, особенно страдающих недостаточностью коронарного кровообращения, высока вероятность резкого увеличения потребности миокарда в кислороде с развитием острого инфаркта миокарда. По мере развития ишемии, дальнейшее увеличение ЧСС и повышение АД увеличивают потребность в кислороде и расширяют зону ишемии [3].
Активация вегетативной нервной системы на фоне болевого синдрома повышает тонус гладкой мускулатуры кишечника со снижением перистальтической активности и развитием послеоперационного пареза [7].
Интенсивная боль является одним из факторов реализации катаболического гормонального ответа на травму: задержки воды и натрия с увеличением секреции АДГ и альдостерона, а также гипергликемией за счет гиперсекреции кортизола и адреналина [11]. Отрицательный азотистый баланс в послеоперационном катаболическом периоде нарастает за счет гиподинамии, отсутствия аппетита и нарушения нормального режима питания.
Невозможность ранней мобилизации пациентов на фоне неадекватной анальгезии повышает риск венозного тромбообразования [14].
В ряде исследований показано существенное ухудшение иммунного статуса и повышение частоты септических осложнений периоперационного периода при неадекватном купировании послеоперационной боли, особенно у пациентов повышенного риска [16].
И, наконец, ноцицептивная стимуляция боль-модулирующих систем спинного мозга может привести к расширению рецепторных полей и повышению чувствительности боль-воспринимающих нейрональных структур спинного мозга. Результатом является формирование хронических послеоперационных нейропатических болевых синдромов, в основе которых лежат вышеупомянутые пластические изменения ЦНС [4].
Послеоперационная боль продолжает оставаться актуальной проблемой и в XXI веке – как в нашей стране, так и за рубежом. Приведенные в литературе данные интенсивности послеоперационного болевого синдрома колеблются в достаточного широком диапазоне – от выраженного болевого синдрома в послеоперационном периоде страдают от 30 до 75% пациентов [5, 6, 10, 12]. Аудиторская комиссия Великобритании в свое время установила стандарт качества лечения послеоперационной боли: процент пациентов с болями высокой интенсивности к 1997 году должен был снизиться до 20, а к 2002 – до 5. Однако указанные сроки прошли, а ситуация изменилась мало[8]. Литературные данные по изучаемой проблеме в отечественных источниках последних 10 лет отсутствуют.
В связи с вышеизложенным оценка интенсивности послеоперационного болевого синдрома при оперативных вмешательствах различной травматичности в условиях конкретной системы здравоохранения с целью последующей разработки рекомендаций по ее профилактике и лечению является актуальной проблемой.
Цель исследования. Изучить интенсивность послеоперационного болевого синдрома при оперативных вмешательствах различной травматичности в условиях многопрофильной хирургической клиники.
Материалы и методы
Для оценки интенсивности послеоперационного болевого синдрома использована визуально-аналоговая шкала интенсивности боли (ВАШ) (рис. 1), по которой с помощью специальной линейки с бегунком пациентам предлагалось оценить болевые ощущения в различное время.
/46/46.jpg)
Условно болевые ощущения от 1 до 2,9 балов расценивались как легкие, от 3 до 4,9 – умеренные, от 5 до 6,9 – средние, от 7 до 8,9 – сильные, 9 до 10 сильные нестерпимые.
Наблюдение продолжалось от 0 часов до 72 часов послеоперационного периода включительно.
Оценка интенсивности послеоперационного болевого проводилась в трех группах: группа 1 (n = 68) – оперативные вмешательства средней травматичности, группа 2 (n = 82) – большой травматичности, группа 3 (n = 23) – оперативные вмешательства при огнестрельных ранениях брюшной полости и забрюшинного пространства.
Группы 1 и 2 были сопоставимы по полу и возрасту. В первой группе мужчины составили 57,4% (39 человек), женщины – 42,6% (29 человек); во второй – 58,5% (48 человек) и 14,5% (34 человека) соответственно (t = 0,15, р > 0,05). Возраст пациентов первой группы от 29 до 72 (в среднем 48,6 ± 1,72) лет, во второй группе от 34 до 76 (в среднем 49,9 ± 1,63) лет (t = 0,55, р > 0,05). Третья группа на 100% состояла из мужчин возрастом от 28 до 62 (в среднем 36,6 ± 3,33).
У всех больных использовалась общая анестезия с искусственной вентиляцией легких (ИВЛ). С целью премедикации за 30–40 мин до операции больные получали ингибитор протонной помпы (пантопразол 40 мг внутривенно). Премедикация на операционном столе осуществлялась с помощью м-холиноблокатора (атропин в дозе 0,01–0,02 мг/кг), бензодиазепинового транквилизатора (диазепам 0,2–0,5 мг/кг внутривенно), опиоидов (фентанил 0,5–1,5 мкг/кг), орошения задней стенки глотки 10% раствором лидокаина. Для индукции использовали тиопентал натрия в дозе 5–6 мг/кг. Интубация трахеи осуществлялась после введения сукцинилхолина в дозе 1–1,5 мг/кг. Для поддержания наркоза использовали низкопоточную анестезию севофлюраном (1,5–1,8 % МАК) с FiO2 95–100%. ИВЛ проводилась в режиме нормовентиляции. Для поддержания релаксации применяли пипекурония бромид 0,02–0,05 мг/кг. Анестезия поддерживалась фракционным введением фентанила (1–3 мкг/кг каждые 20–30 минут).
У 30 пациентов первой группы и 59 пациентов второй группы дополнительно до начала оперативного пособия выполнялась пункция и катетеризация эпидурального пространства на уровне Th6-Th9, и анестезия дополнялась постоянным введением ропивакаина (концентрация 2 мг/мл) со скоростью 6–14 мл/час. 12 пациентам третьей группы пункция и катетеризация эпидурального пространства выполнена в течение вторых суток послеоперационного периода, поскольку больные требовали оперативного вмешательств в ургентном порядке и из-за возбужденного состояния и имеющегося болевого синдрома более ранняя установка эпидурального катетера была затруднена.
В послеоперационном периоде пациенты всех трех групп были разделены на подгруппы в зависимости от различных схем обезболивания.
A. Пациенты без эпидурального катетера:
1) Промедол по 20 мг внутримышечно каждые 6 часов (группа 1.1, n = 17; группа 2.1, n = 9; группа 3.1, n = 3).
2) Промедол по 20 мг внутримышечно каждые 6 часов совместно с декскетопрофеном 50 мг каждые 8 часов (группа 1.2, n = 21; группа 2.2, n = 14; группа 3.1, n = 5).
B. Пациенты с установленным эпидуральным катетером:
3) Постоянная инфузия ропивакаина (концентрация 2 мг/мл) со скоростью 3–12 мл/час совместно с промедолом по 20 мг внутримышечно каждые 6 часов (группа 1.3, n = 8; группа 2.3, n = 21; группа 3.3, n = 2).
4) Постоянная инфузия ропивакаина (концентрация 2 мг/мл) со скоростью 3–12 мл/час совместно с промедолом по 20 мг внутримышечно каждые 6 часов и декскетопрофеном 50 мг каждые 8 часов (группа 1.4, n = 8; группа 2.4, n = 21; группа 3.4, n = 2).
5) Постоянная инфузия ропивакаина (концентрация 2 мг/мл) со скоростью 3–12 мл/час совместно декскетопрофеном 50 мг каждые 8 часов (группа 1.5, n = 12; группа 2.5, n = 12). В группе с огнестрельными ранениями данная схема не использовалась в виду необходимости дополнительного обеспечения психоэмоционального комфорта в послеоперационном периоде, которое достигалось при введении наркотических анальгетиков.
Скорость инфузии ропивакаина подбиралась индивидуально в зависимость от интенсивности боли и уровня артериального давления (допускалось снижение не более 20–25% от исходного). При усилении болевого синдрома во всех группах назначали дополнительное введение нестероидных противовоспалительных препаратов (НПВП).
Статистическая обработка результатов исследования проведена на персональном компьютере с помощью пакетов лицензионных программ «Microsoft Excel 2007», «Statistica 10». Оценивали средние значения (М), их погрешность (m), t-критерии Стьюдента (kS), достоверность разницы показателей (рkS).
Результаты и их обсуждение
Результаты оценки интенсивности болевого синдрома при операциях средней и большой травматичности, а также при операциях по поводу огнестрельных ранений брюшной полости представлены в таблицах 1, 2 и 3 соответственно.
Анализ полученных результатов показал наличие статистически значимых различий в сторону уменьшения болевого синдрома при использовании комбинации дексетопрофен + промедол в сравнении моноанестезией промедолом при операциях средней травматичности в период с 25 до 48 часов послеоперационного периода. Использование вышеуказанной комбинации в сроки от 0 до 24 часов и от 49 до 72 часов при операциях средней травматичности также приводит к уменьшению болевого синдрома, однако различия между группами статистически недостоверны (табл. 4).
В группе операций большой травматичности при комбинации наркотического анальгетика и нестероидного противовоспалительного препарата в сравнении с использованием только наркотического анальгетика статистически недостоверное уменьшение боли выявлено в период от 25 до 48 часов, в период от 0 до 24 часов пациенты испытывали болевые ощущения одинаковой интенсивности (табл. 5).
В группе с огнестрельными ранениями вышеуказанная комбинация препаратов не приводила к уменьшению болевого синдрома в сравнении с монообезболиванием промедолом во всех изучаемых временных интервалах.
Использование эпидуральной анестезии как компонента обезболивания во время оперативного вмешательства с последующей продленной анестезией в послеоперационном периоде достоверно уменьшало интенсивность болевого синдрома в сравнении с группами без эпидуральной анестезии во всех интервалах послеоперационного периода, за исключением периода с 25 до 48 часов в группе с огнестрельными ранениями, что объясняется более поздним началом эпидурального обезболивания. В дальнейшем, в период с 49 до 72 часов, разница в болевых ощущениях между указанными группами становится достоверной (табл. 6).
В группах с использованием эпидуральной анестезии при плановых операциях большой травматичности (группа 2В) и при оперативных вмешательствах, связанных с огнестрельными ранениями (группа 3В), оценка интенсивности болевого синдрома выявила достоверно меньшую интенсивность боли группе 2В. Также выявлено достоверно более длительное сохранение интенсивных болевых ощущений: в период от 49 до 72 часов от окончания оперативного вмешательства в группах 2В–3В показатель боли по ВАШ составил в среднем 4,7 ± 0,29 и 5,2 ± 0,27 соответственно (табл. 7)
Полученные результаты согласуются с литературными данными о меньшей эффективности эпидуальной анестезии, которая начата после повреждения [13,15].
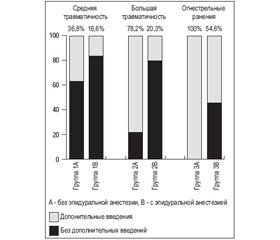
Нами также были изучена потребность в дополнительных дозах нестероидных противовоспалительных препаратов из-за выраженного болевого синдрома. За дополнительную потребность мы принимали более чем двукратное введение препаратов указанной группы сверх назначенного плана обезболивания в течение 72 часов после оперативного вмешательства. Результаты представлены на рисунке 2.
/49/49.jpg)
Дополнительные введения НПВП требовались во всех группах пациентов. При использовании эпидуральной анестезии как компонента обезболивания количество дополнительных введений НПВП достоверно меньше группах 2 и 3 (табл. ). В группе 1 отличия статистически недостоверны.
Внеплановое обезболивание НПВП было необходимо чаще при эпидуральной анестезии, начатой в послеоперационном периоде, по сравнению с началом обезболивания до оперции, при близком по травматичности хирургическом вмешательстве (группы 2В – 3В; kS = 2,06, pkS < 0,05), что может свидетельствовать о начале формирования центральной сенситизации.
Выводы
1. При оперативных вмешательствах большой травматичности средний показатель интенсивности болевого синдрома по ВАШ в группах без использования продленной эпидуральной анестезии находится в диапазоне сильных болевых ощущений; при эпидуральной анестезии – в диапазоне болевых ощущений средней интенсивности, что позволяет рекомендовать данный компонент как обязательный (при отсутствии противопоказаний) у пациентов, которые подвергаются обширным оперативным вмешательствам.
2. При оперативных вмешательствах средней травматичности использование эпидурального обезболивания позволяет достичь полностью комфортного течения послеоперационного периода с умеренным болевыми ощущениями.
3. Использование НПВП достоверно эффективно как компонент планового послеоперационного обезболивания только при оперативных вмешательствах средней травматичности без использования эпидуральной анестезии.
4. Начало эпидуральной анестезии после травмы менее эффективно – длительность сохранения послеоперационной боли увеличивается в сравнении с использовнием эпидурального обезболивания как составной части мультимодальной анестезии во время оперативного пособия с последующим продолжением в послеоперационном периоде, – что может быть объяснено запуском механизмов центральной сенситизации.
5. Значительный удельный вес дополнительного обезболивания во всех изученных группах вызывает необходимость поиска путей дальнейшей оптимизации послеоперационного обезболивания, в частности, применения превентивной анестезии.
1. Любошевский П. А. Хирургический стресс–ответ при абдоминальных операциях высокой травматичности и возможности его анестезиологической коррекции: автореф. дис. … д–ра мед. наук: 14.01.20 / П.А. Любошевский. – Ярославль, 2012 . – 21 с.
2. Осипов С.А., Сравнительная оценка действия местных анестетиков в сочетании с морфином при их эпидуральном введении / С.А. Осипов, И.В. Червякова, В.Е. Киселевич и др. // Анестезиология и реаниматология. – 1993. – № 1. – С. 70 – 73.
3. Breivik Н. Postoperative pain management / Н. Breivik // Bailliere's Clinical Anaesthesiology. – 1995. – V. 9. – P. 403 – 585.
4. Campiglia L. Pre-emptive analgesia for postoperative pain control: a review / L. Campiglia, G. Consales, A.R. De Gaudio // Clin. Drug Investig. – 2010. – Suppl 2. – Р. 15–26.
5. Carr D. Acute pain / D.Carr, L. Goudas // Lancet. – 1999. – V. 353. – P. 205 1– 2058.
6. Chauvin M. Postoperative patient management. Pain after surgical intervention / M. Chauvin // Presse Med. – 1999. – V.28. – P.203 – 211.
7. de Leon Casasola. The effects of epidural bupivacaine morphine and intravenous PCA morphine on bowel function and pain after radical hysterectomies / de Leon Casasola , D. Karabella, М. Lema // Anesth Analg. – 1993. – V.76. – P.73.
8. Dolin S. Effectiveness of acute postoperative pain management: I. Evidence from published data. / S. Dolin, J. Cashman, J. Bland // Br.J.Anaesth. – 2002. – V.89. – P.409– 423.
9. Gottschalk A., Sharma S., Ford J., et al. The role of the perioperative period in recurrence after cancer surgery / A. Gottschalk, S. Sharma, J. Ford, et al // Anesthesia & Analgesia. – 2010. – Vol. 110, N 6. – P. 1636–1643.
10. Harmer M. The effect of education, assessment and a standardised prescription on postoperative pain management. The value of clinical audit in the establishment of acute pain services / M. Harmer, K. Davies // Anaesthesia. – 1998. – V.53. – P.424 – 430.
11. Kehlet Н. Postoperative pain / Н. Kehlet, J.B. Dahl // World J.Surg. – 1993. – V.17. – P.215–219.
12. Neugebauer E. Recommendations and guidelines for perioperative pain therapy in Germany / E. Neugebauer, H. Wulf // Langenbecks Arch Chir Suppl Kongressbd. – 1998. – V.115. – P. 666 – 671.
13. Shipton E.A. Pain acute and chronic / E.A. Shipton. – New York : Oxford University Press, 1999. – 378p.
14. Tuman K. Effects of anaesthesia and analgesia on coagulation and outcome after major vascular surgery / K. Tuman, R. McCarthy, R. March // Anesth.Analg. – 1991. – V.73. – P.696 – 704.
15. Vadivelu N. Preventive analgesia for postoperative pain control: a broader concept. / N. Vadivelu, S. Mitra, E. Schermer, V. Kodumudi, A.D. Kaye, R.D. Urman // Local Reg Anesth. – 2014. – Vol. 7. – Р. 17–22.
16. Yeagcr М. Epidural anaesthesia and analgesia in high risk surgical patjents / М. Yeagcr, D. Glass, R. Neff, F. Brick Johnsen // Anesthesiology. – 1988. – V.73. – P. 729 – 736.

/47/47.jpg)
/48/48.jpg)