Украинский журнал хирургии 3-4 (26-27) 2014
Вернуться к номеру
Случаи успешного лечения раневого сепсиса с отдаленными септикопиемическими очагами
Авторы: Балацкий Е.Р., Журавлева Ю.И. — Донецкий национальный медицинский университет им. М. Горького
Рубрики: Хирургия
Разделы: Справочник специалиста
Версия для печати
Проведен анализ двух случаев успешного лечения похожих больных с сахарным диабетом, гнойно-некротическими поражениями пальцев стоп, сепсисом и септикопиемическими очагами на руке. Бактериологические исследования микробного спектра и чувствительности к антибактериальным препаратам у 146 больных с различными раневыми процессами за 2010–2013 годы показали высокую эффективность карбапенемов и эртапенема как варианта выбора для стартовой деэскалационной терапии. Выявлен медленный рост штаммов, резистентных к ванкомицину, ежегодно увеличивается ассоциативная микрофлора и продуценты бета-лактамаз.
Проведений аналіз двох випадків успішного лікування схожих хворих з цукровим діабетом, гнійно-некротичними ураженнями пальців стоп, сепсисом і септикопіємічними вогнищами на руці. Бактеріологічні дослідження мікробного спектру і чутливості до антибактеріальних препаратів у 146 хворих з різними рановими процесами за 2010–2013 роки показали високу ефективність карбапенемів і ертапенему як варіант вибору для стартової деескалаційної терапії. Виявлено повільне зростання штамів, резистентних до ванкоміцину, щорічно збільшується асоціативна мікрофлора і продуценти бета-лактамаз.
The analysis of the two cases of successful treatment of similar patients with a combination of diabetes, pyo-necrotic lesions of toes, sepsis and septicopyemic suppurative on the hand. Bacteriological studies of microbial spectrum and sensitivity to antibacterial drugs in 146 patients with different wounded processes for 2010–2013 showed high efficiency of karbapenem and ertapenem as choices for the launch de-escalation therapy. Revealed slow growth of strains resistant to vancomycin, is increasing annually associative microflora and beta-lactamase producers.
хирургический сепсис, септикопиемия, антибактериальная терапия.
хірургічний сепсис, септикопіємія, антибактеріальна терапія.
surgical sepsis, septicopyemia, antibacterial therapy.
Статья опубликована на с. 139-142
Введение
В настоящий момент, говоря о хирургическом сепсисе при установленной инфекции и наличии первичного гнойного очага, подразумевают обязательное наличие признаков синдрома системного воспалительного ответа (systemic inflammatory response syndrome — SIRS), который, в свою очередь, может быть началом синдрома полиорганной недостаточности (multiple organ dysfunction syndrome — MODS). По простой матрице диагностики сепсиса, предложенной P.-O. Nyström еще в 1998 году [6] и получившей широкое признание и распространение (наиболее высокий уровень цитирования в современной литературе, посвященной сепсису) во всем мире, к абсолютно подтвержденному сепсису относятся состояния с наличием SIRS и инвазивной инфекции (положительной гемокультуры или бактериемии).
Удельный вес больных с хирургическим сепсисом в мире стабилен, процент летальных исходов колеблется от 24 до 90 % в зависимости от форм сепсиса и полученной при бактериологическом исследовании микрофлоре. Наиболее тяжелыми являются именно ситуации септикопиемии с наличием удаленных гнойных очагов, сопровождающихся максимальной летальностью. Сложный выбор антибактериальной терапии в этих случаях базируется на деэскалационном принципе, с учетом региональных особенностей бактериального профиля [1, 4].
Препаратами выбора при проведении эмпирической антибактериальной терапии являются: современные аминогликозиды, фторхинолоны и цефалоспорины в сочетании с производными метронидазола, карбапенемы [2, 3]. Последние являются препаратами с широким антибактериальным спектром, что позволяет проводить монотерапию этими препаратами, которая, в свою очередь, не уступает по эффективности другим антибиотикам и их комбинациям и может значительно сократить время лечения. Но четкой программы выбора и рекомендаций для стартовой антибактериальной терапии при наличии признаков SIRS не существует.
Цель работы — анализ случаев успешного лечения раневого сепсиса с отдаленными септикопиемическими очагами на фоне трофических нарушений нижних конечностей.
Материал и методы
Клинический материал получен из сформированной архивной базы данных лечения различных гнойно-некротических поражений конечностей в условиях нарушенной трофики. Для непосредственного изучения из совокупности выбран материал 146 случаев за 2010–2013 гг. с анализом результатов бактериологических исследований раневого отделяемого и гемокультуры (n = 54), выполненных в хирургическом отделении и бактериологической лаборатории ЦГКБ № 6 г. Донецка. Использованы данные эпидемиологических отчетов за этот период времени по лечебному учреждению в целом. Для детального анализа выбраны 2 редких сходных случая успешного лечения хирургического сепсиса у больных с отдаленными септикопиемическими очагами.
Наличие сепсиса верифицировали по стандартным критериям, вид септической реакции оценивали по матрице диагностики (Nyström, 1998), тяжесть течения сепсиса оценивали по общепринятым критериям и шкалам APACHE II (Acute Physiology and Chronic Health Evaluation, version II) и SOFA (Sepsis-related Organ Failure Assessment / Sequential Organ Failure Assessment). Бактериологическое исследование крови выполняли всем больным с наличием клинических признаков SIRS (n = 54), как правило, до начала антибактериальной терапии, а также в динамике для контроля. Бактериологическое исследование проводили по двум направлениям: 1) для выявления бактериемии без выделения культуры, с предварительным результатом на 2-е — 3-и сутки; 2) бактериологическое исследование с выделением возбудителей и определением чувствительности к антибактериальным препаратам (на 5–7-е сутки). Эффективность антибактериальной терапии оценивали по клиническим и лабораторным критериям регрессии SIRS. Основным критерием для эффективности продленной антибактериальной терапии (продолжающейся после основного эмпирического эрадикационного курса антибиотикотерапии) принято отсутствие признаков рецидива септического состояния в течение 6 месяцев.
Результаты и обсуждение
В целом раневой сепсис с положительной гемокультурой был выявлен у 12 (22,2 %) из 54 больных с признаками SIRS. Из 12 больных умерло 5 (летальность 41,6 %): при быстром (до 10 суток) нарастании полиорганной недостаточности — 3 больных; при рецидивирующем (в сроки 1 и 2 месяца) течении сепсиса — 2 больных. Из выживших больных у двоих были выявлены сходные метастатические септические отдаленные очаги, успешно ликвидированные.
Заболевания, как причины сепсиса, у этих больных были следующими: 1) пандактилит IV пальца левой стопы с сетчатым лимфангиитом стопы, септической метастатической глубокой флегмоной левого предплечья и кисти у больной 86 лет, с сопутствующим сахарным диабетом; 2) пандактилит II пальца культи правой стопы у больной 53 лет, с метастатической тотальной флегмоной левой кисти и предплечья.
1) Больная Е., 86 лет, поступила в клинику с пандактилитом IV пальца левой стопы, сетчатым лимфангиитом стопы, септической метастатической флегмоной левого предплечья и кисти, с сопутствующим сахарным диабетом, генерализованным атеросклерозом. Поступила на 6-е сутки от начала заболевания с септическим состоянием тяжелой степени, 36 баллов по шкале APACHE II, 8 баллов по шкале SOFA, с полиорганной недостаточностью, в состоянии психического возбуждения на фоне интоксикации, церебросклероза II степени. Начало заболевания связывает с выполнением педикюра 8 суток назад, постепенно развились воспалительные изменения на стопе, в течение 2 суток признаки воспалительного поражения левой кисти. Антибактериальная терапия эртапенемом в дозе 1,0 в/в капельно 1 раз в сутки начата с первых часов после госпитализации. Интенсивная терапия для стабилизации состояния перед операцией. Оперирована на 2-е сутки: 1) удаление IV пальца левой стопы с резекцией головки плюсневой кости, первичным швом на рану; 2) вскрыта флегмона левой кисти — глубокая флегмона срединного ладонного пространства с распространением через пространство Пирогова — Парона до средней трети предплечья. Позитивный в гемокультуре сепсис — St.aureus (MSSA — Meticillinsensitiv Staphylococcus aureus — метициллин-чувствительный золотистый стафилококк). При бактериологическом исследовании отделяемого из ран на стопе и руке — St.aureus 105 КОЕ (MSSA).
Продолжительность антибактериальной терапии эртапенемом до 10 суток, продолжение поддерживающей антибактериальной терапии гатифлоксацином (после подтверждения результатов высокой чувствительности к препарату) перорально на протяжении 15 суток. Заживление ран к 18-м суткам после операции. Полная регрессия признаков SIRS к 25-м суткам. Наблюдается в течение двух лет, признаков рецидива сепсиса не отмечено.
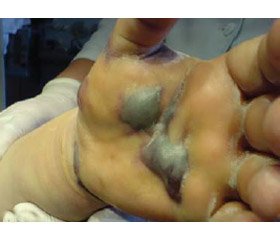
2) Больная У., 53 лет, впервые поступила в клинику после реконструктивно-восстановительного вмешательства — рентгенэндоваскулярной дилатации, стентирования подколенной артерии, ампутации III–IV пальца правой стопы, выполненных в сосудистом отделении, для закрытия раны стопы. После подготовки и аутопластического закрытия раны была выписана. Поступила повторно через 6 месяцев с признаками пандактилита II пальца культи правой стопы и флегмоны левой кисти, в септическом состоянии (см. рис.).
Начало заболевания связывает с травмой II пальца культи правой стопы. Через 4 суток после начала воспалительного процесса на пальце стопы появились признаки воспалительного поражения левой кисти, тогда же и обратилась за медицинской помощью. Оперирована после кратковременной (6 часов) подготовки — ампутация II пальца культи правой стопы, вскрытие глубокой флегмоны срединного ладонного пространства левой кисти. Состояние прогрессивно ухудшалось, на вторые сутки дополнительно вскрыто пространство Пирогова — Парона и глубокая флегмона предплечья до средней трети по передней поверхности в связи с распространением поражения на левой руке. Рана стопы на месте удаленного пальца с признаками продолжающегося гнойного процесса. Клинически признаки наличия анаэробного поражения на стопе и руке. Установлены показания для экстренной ампутации. Септическая реакция тяжелой степени, 32 балла по шкале APACHE II и 6 баллов по шкале SOFA в первые сутки. На 2-е сутки 38 баллов по шкале APACHE II и 8 баллов по шкале SOFA, с тяжелой полиорганной недостаточностью. Антибактериальная терапия с первых суток карбапенемом 1,0 в/в капельно 4 раза в сутки в течение 6 суток + орнидазол 100,0 2 раза в сутки в/в капельно, продолжение антибактериальной терапии азитромицином + орнидазол перорально до 20 суток. В экстренном порядке выполнена трансметатарзальная ампутация правой стопы, ампутация левой руки на уровне плеча.
С учетом клинических признаков анаэробного поражения и сепсиса раны культей стопы и плеча оставлены открытыми, закрывались в несколько этапов аутопластически. Выраженная положительная динамика через сутки после операций ампутаций — 20 баллов по шкале APACHE II, 4 балла по шкале SOFA. В отделяемом из ран пальца стопы получено St.aureus 106 КОЕ (MSSA) + Bacteroides fragilis 103 КОЕ; в отделяемом из ран левой кисти — St.aureus 105 КОЕ (MSSA) + Bacteroides fragilis 102 КОЕ. В гемокультуре — St.aureus (MSSA). Регрессия SIRS к 8 суткам после ампутаций, при повторном трехкратном бактериологическом контроле крови роста микрофлоры не получено. Наблюдается в течение 3 лет, признаков рецидива сепсиса нет, периодически получает профилактическое лечение.
Проведенный анализ 146 бактериологических исследований раневого отделяемого, выполненных на базе ЦГКБ № 6 г.Донецка за 2010–2013 годы, показал стабильно высокую эффективность карбапенемов, цефалоспоринов III поколения, эртапенема, азитромицина для большинства культуральных штаммов как в монокультуре, так и в ассоциациях. Для этих препаратов получена высокая чувствительность возбудителей хирургической инфекции (до 94 % штаммов) и отсутствие роста антибиотикорезистентности за трехлетний период в отличие от некоторых других антибактериальных препаратов. Несмотря на то, что наиболее частой причиной септических состояний является контаминация St.aureus (9 из 12 случаев в наших наблюдениях) в монокультуре или ассоциациях, по нашим и по литературным данным [5], достаточно редко встречаются MRSA (Methicillin-resistant Staphylococcus aureus — метициллин-устойчивый золотистый стафилококк) штаммы этого возбудителя. За трехлетний период из 98 выявленных в раневом отделяемом культур St.aureus лишь в 7 (7,1 %) случаях установлено наличие штаммов MRSA. В это же время в последние годы отмечен рост удельного веса микрофлоры, резистентной к ванкомицину. Так, по данным за 2013 год, из 50 культур St.aureus 11 (22,0 %) оказались резистентными к ванкомицину, с постепенным ростом резистентности за трехлетний период втрое. Высокая резистентность к ванкомицину получена и среди культур St.epidermidis (50,0 %) и Ent.faecalis (81,3 %). Остальные возбудители были чувствительны к ванкомицину. Кроме того, за последний пятилетний период выявлен абсолютный прирост контаминации микроорганизмами — продуцентами бета-лактамаз расширенного спектра до +50,4 %, ассоциативной микрофлорой — до +18,5 % среди всех изолятов с ежегодным положительным темпом прироста для этих групп. Темп прироста контаминации Ps.aeruginosa в среднем составил +5,4 % в год. Эти факторы послужили причиной выбора комбинации препаратов различных групп у септических больных по деэскалационному принципу эмпирической антибактериальной терапии до получения результатов бактериологического исследования.
Выводы
Успешное лечение 2 случаев сепсиса с септикопиемическими очагами, по нашему мнению, обусловлено рядом факторов: 1) полной ранней ликвидацией инфекционных очагов и их доступностью для радикального устранения; 2) своевременной диагностикой септического состояния и ранним выявлением (на 2-е — 3-и сутки) бактериемии; 3) адекватным выбором антибактериальных препаратов для эмпирической стартовой терапии и продолжением пролонгированной антибиотикотерапии в соответствии с установленной чувствительностью для профилактики рецидива сепсиса, явившегося причиной смерти у 2 больных.
1. Захарова Н.В., Медведев Д.С. Применение деэскалационного подхода к антибиотикотерапии в лечении инфекционных осложнений термических ожогов / Н.В. Захарова, Д.С. Медведев // Вестник Санкт-Петербургской медицинской академии последипломного образования. — 2011. — N. 3, № 1. — С. 97–100.
2. Brunkhorst F.M. Antimicrobial therapy of severe sepsis and septic shock — the "hit-hard-and-fast" concept / F.M. Brunkhorst // Infection. — 2009. — Vol. 37, Suppl. 4. – Р. 58–59.
3. Funk D. Improving Outcomes in Sepsis and Septic Shock: Getting it Right the First Time / D. Funk, Sh. Kethireddy, A. Kumar // Sepsis Management / Eds. Rello J. — Springer-Verlag Berlin Heidelberg, 2012. — P. 219–235.
4. Gomes Silva B.N. De-escalation of antimicrobial treatment for adults with sepsis, severe sepsis or septic shock / Brenda Nazaré Gomes Silva, Régis B. Andriolo, Álvaro N. Atallah, Reinaldo Salomão // Cochrane Database of Systematic Reviews. — 2013. — Issue 3. — Р. 1–34. — Art. No.: CD007934. DOI: 10.1002/14651858.CD007934.pub3 — Wiley Online Library. — Режим доступа к журн.: http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD007934.pub3/pdf.
5. Increasing consumption of MRSA-active drugs without increasing MRSA in German ICUs / E. Meyer, F. Schwab, B. Schroeren-Boersch [et al.] // Intensive Care Med. — 2011. — V. 37. — P. 1628–1632.
6. Nyström P.-O. The systemic inflammatory response syndrome: definitions and aetiology / P.-O. Nyström // J. Antimicrob. Chemother. — 1998. — Vol. 41, suppl. A. — P. 1–7.

/141/141.jpg)