Журнал «Актуальная инфектология» 4 (5) 2014
Вернуться к номеру
Применение противовирусного препарата нового поколения Аллокин-альфа в терапии социально значимых вирусных инфекций
Авторы: Дуда А.К., Коцюбайло Л.П., Окружнов Н.В. — Национальная медицинская академия последипломного образования имени П.Л. Шупика, г. Киев
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
Освещены вопросы комплексной терапии вирусных инфекций. Представлены основные группы химиопрепаратов для лечения вирусных инфекций. Показана эффективность использования нового противовирусного препарата Аллокин-альфа в терапии простого и опоясывающего герпеса, вирусных гепатитов В и С, острых респираторных вирусных инфекций.
Висвітлено питання комплексної терапії вірусних інфекцій. Представлено основні групи хіміопрепаратів для лікування вірусних інфекцій. Показана ефективність використання нового противірусного препарату Алокін-альфа в терапії простого та оперізуючого герпесу, вірусних гепатитів В і С, гострих респіраторних вірусних інфекцій.
The questions of comprehensive treatment for viral infections are considered. The main group of chemotherapeutic agents for the treatment of viral infections is described. The efficiency of using new antiviral drug Allokin-alfa has been shown in the treatment of herpes simplex and herpes zoster, viral hepatitis B and C, acute respiratory viral infections.
вирус простого и опоясывающего герпеса, Аллокин-альфа, противовирусное действие, вирусные гепатиты В и С.
вірус простого та оперізуючого герпесу, Алокін-альфа, противірусна дія, вірусні гепатити В і С.
herpes simplex and herpes zoster virus, Allokin-alfa, antiviral effect, viral hepatitis B and C.
Статья опубликована на с. 32-41
Введение
Одной из актуальных проблем современной мировой медицины является высокая заболеваемость и смертность от вирусных инфекций (ВИ), которые широко распространены в человеческой популяции, способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую, хроническую и медленную формы инфекции. Эти факты позволяют рассматривать ВИ как общее системное заболевание организма [1].
Само слово «вирус» означает «яд». Его впервые предложил Л. Пастер для обозначения «заразного материала». Первые упоминания о ВИ (натуральная оспа) найдены еще в древнегреческих папирусах за 12 веков до н.э. Началом эры научной вирусологии считают 1892 год, когда 28-летний русский ученый из Санкт-Петербурга Д.И. Ивановский доказал, что болезнь табака (табачная мозаика) вызывается неким агентом, легко проходящим через так называемые бактериальные фильтры.
Применение в клинической практике вакцин и антибиотиков позволило существенно сократить число бактериальных инфекций. Однако абсолютное число ВИ продолжает расти, а многие ВИ до сих пор плохо контролируются: грипп и другие ОРВИ, герпесвирусные инфекции, гепатиты, ВИЧ-инфекция и др.
Комитет экспертов ВОЗ прогнозировал серьезную заболеваемость ВИ в текущем столетии, а Европейское бюро ВОЗ еще в 1987 г. опубликовало свой доклад, в котором указывалось, что «…герпесвирусные инфекции будут определять будущее инфекционной патологии в XXI веке». Это свидетельствует о большом медико-социальном значении ВИ для практического здравоохранения.
За последние 40 лет открыто около 20 новых ранее неизвестных вирусов, некоторые из которых вызывают смертельно опасные заболевания. Это в первую очередь вирус лихорадки Эбола, Марбург, Ласса, Западного Нила, вирус иммунодефицита человека (ВИЧ), вирусы гепатитов C, D, E и другие [1].
В своей практической деятельности врачи многих специальностей встречаются с заболеваниями, вызванными вирусами семейства Herpesviridae. Герпесвирусы (ГВ) широко распространены в человеческой популяции, они способны поражать все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции. По данным серо-эпидемиологических исследований, антитела к вирусам простого герпеса выявляются у 70–100 % населения, к вирусу Эпштейна — Барр — у 50–85 %, цитомегаловирусу — до 100 %. Вирусы герпеса индуцируют процессы атеросклероза, показано неблагоприятное, а порой и фатальное влияние ГВ на течение беременности и родов, патологию плода и новорожденных. ГВ являются кофактором прогрессирования ВИЧ-инфекции и СПИДа [7].
По данным ВОЗ, в качестве причин смерти вследствие вирусных инфекций герпетические инфекции (ГИ) занимают 2-е место (15,8 %), уступая только вирусу гриппа (35,8 %). Около 90 % населения нашей планеты инфицировано герпесвирусами, а 2–12 % — страдает рецидивирующими герпесвирусными заболеваниями.
К офтальмологам ежегодно обращается от 300 до 500 тыс. чел. с различными формами герпеса, причем больные с герпетическими кератитами и иридоциклитами составляют примерно 60 % от общего числа больных с поражениями роговицы. Офтальмогерпес в развитых странах занимает центральное место в вирусной патологии органа зрения, причем до 60 % роговичной слепоты обусловлено герпетическими кератитами [1, 7].
Инфекция, вызываемая вирусом опоясывающего герпеса (Herpes zoster), реализуется воздушно-капельным путем. Первичная манифестация инфекции в молодом возрасте обусловлена клиникой ветряной оспы, затем следует латентная стадия с персистенцией вируса в организме (макрофаги периферической крови, печени, нейроны и др.). При определенных условиях происходит реактивация вируса с проявлением разнообразных клинических форм, одной из которых является Herpes zoster [9].
Размножение вирусов простого и опоясывающего герпеса происходит в полиморфноядерных лейкоцитах и моноцитах. Связь с лейкоцитами обеспечивает вирусу защиту от факторов гуморального иммунитета и создает реальные предпосылки для последующей диссеминации [3]. Вирус Herpes zoster обнаруживается также и в эритроцитах, в которых образуются включения. Показано, что более половины случаев заболевания Herpes zoster приходится на пациентов старше 50 лет.
По решению Международного комитета по номенклатуре вирусов каждые пять лет обновляется номенклатура. Данный Международный комитет предлагает классификацию всех известных вирусов (последняя классификация предложена в 2010 г.), которая включает 4 иерархических уровня: вид, род, семейство (иногда и подсемейство) и порядок.
В настоящее время определено 3 порядка, 64 семейства, 9 подсемейств, 233 рода и более 1550 видов. Различают РНК- и ДНК-содержащие вирусы, другие основные критерии и современная классификация вирусов изложены в литературе. В настоящее время изучено более 500 вирусов, способных вызывать различные заболевания у людей.
Современные методы молекулярной биологии, генетики позволили изучить механизмы репликации в чувствительных клетках многих вирусов, что дало возможность разработать целый ряд оригинальных и высокоэффективных химиотерапевтических препаратов (ХП), обладающих противовирусной активностью. В условиях хронических ВИ с длительной персистенцией вируса развивается иммунологическая недостаточность, возможны мутации и рекомбинации в геноме вириона и формирование резистентности вирусов к базовым ХП. В связи с этим терапия ВИ сопряжена с определенными трудностями. В ряде случаев применение современной комплексной терапии острых и хронических ВИ не всегда оказывает влияние на тяжесть течения и исход болезни, а также на реактивацию вируса и частоту рецидивирования.
В.И. Покровский и соавт. (2002) считают, что изменения, вызванные вирусной инфекцией, являются результатом следующих процессов:
— поражения и нарушения функций жизненно важных органов;
— виремии — «вирусная нагрузка» прямо коррелирует с общим токсикозом, тяжестью общего состояния и выраженностью лихорадки;
— тесного взаимодействия с иммунной системой, реакция которой в значительной степени определяет характер, течение и исход инфекционного процесса;
— присоединения бактериальной инфекции и развития осложнений.
Современная медицина, к сожалению, не располагает высокоэффективными методами лечения, позволяющими элиминировать вирус простого герпеса (ВПГ), Herpes zoster, гепатитов В и С из организма человека [1, 3, 11]. В связи с этим основными целями лечебных мер являются:
— подавление репродукции вирусов в период обострения;
— формирование адекватного длительного иммунного ответа для предотвращения реактивации вирусов в очагах персистенции;
— предупреждение развития или восстановления тех нарушений, которые вызывают активацию вирусов.
В связи с этим необходимы новые отечественные лекарственные препараты, обладающие противовирусной и иммуномодулирующей активностью, которые повышают иммунобиологическую резистентность организма и улучшают качество жизни пациентов. Одним из таких перспективных и эффективных препаратов является Аллокин-альфа.
Цитокиновый ответ при вирусных инфекциях
К цитокинам с прямым противовирусным действием относятся aльфа/бета-интерферон (ИФН) и фактор некроза опухоли (ФНО), которые продуцируются NK-клетками. ФНО способен усиливать ИЛ-12-зависимую продукцию yИФН.
Эффекторные механизмы реакции цитокинового ряда могут быть представлены следующими механизмами [3, 6]:
— продукцией aльфа/бета-ИФН;
— активацией НК и цитотоксических лимфоцитов;
— продукцией гамма-ИФН;
— перераспределением лимфоцитов;
— экспрессией генов ИЛ-1 и ФНО;
— каскадной активацией продукции других цитокинов.
Эти механизмы активации врожденного иммунитета в ответ на вирусную инфекцию кардинально отличаются от реакций организма на другие патогены. ФНО и гамма-ИФН активируют макрофаги, которые участвуют в противовирусной защите (Покровский В.И. и др., 2003). При прогрессировании вирусной инфекции происходит регуляция генов, отвечающих за синтез ИЛ-12, что прямо связано с продукцией гамма-ИФН.
Если инфекционный процесс развивается дальше, то продолжается активация неспецифических компонентов иммунной системы, а именно:
— экспрессия генов рецепторов цитокинов;
— перераспределение иммунокомпетентных клеток;
— увеличение активности цитотоксических лимфоцитов и продукции гамма-ИФН;
— индукция пролиферации NK-клеток и CD8+ Т-клеток памяти.
Таким образом, система ИФН не только осуществляет первую линию защиты организма от инфекций, но и участвует в специфических иммунных процессах уничтожения чужеродных объектов. Если иммунная система отвечает за неизменность белкового состава организма, то система ИФН следит за поддержанием генетического гомеостаза, т.е. за сохранением постоянства состава организма на уровне генома [3].
Антивирусное действие индукторов ИФН реализуется через механизмы активации ими цитокинов, подавляемых при вирусном инфицировании. Считают, что способность «запрещать выключение» цитокинов при вирусных инфекциях может стать методом отбора новых антивирусных препаратов.
Первым представителем этой зарождающейся уникальной группы противовирусных препаратов является препарат Аллокин-альфа, в основу создания которого и легла тысячелетиями отшлифованная насекомыми способность аллоферонов (олигопептиды иммунной системы насекомых) «запрещать выключение» цитокинов.
Таким образом, реакции цитокинового ряда непосредственно связаны с противовирусными эффектами цитокинов. Они могут реализоваться на уровне инфицированных клеток и/или активировать неспецифический клеточный иммунитет, при этом конечным этапом реакции цитокинового ряда является участие в специфическом иммунном ответе.
Большое значение в противовирусной защите организма придается системе интерферонов. Для хронических вирусных инфекций (в первую очередь герпетической и герпесвирусной инфекций, вирусных гепатитов В и С), а также некоторых заболеваний невирусной этиологии характерно выраженное подавление интерфероногенеза.
При этом более значительно продукция ИФН угнетена у больных с тяжелым течением хронического заболевания. Фоновые показатели сывороточного ИФН сочетаются с резко угнетенной способностью иммуноцитов синтезировать aльфа- и гамма-ИФН.
Молекулярные механизмы модуляции активности натуральных киллеров вирусами
Иммунный ответ на ВИ включает сложные взаимодействия между эффекторными клетками хозяина и инфицированными клетками. Основными эффекторными клетками, принимающими участие в антивирусном ответе, являются NK- и цитотоксические Т-лимфоциты, которые секретируют противовоспалительные медиаторы и напрямую лизируют зараженные клетки. Кроме этого, В-лимфоциты продуцируют антитела, которые становятся специфичными для вирусных антигенов с помощью Т-хелперов.
Персистирующие вирусы (CМV, Herpes zoster, EBV, HSV-1, гепатитов В и С) приспособились к тому, чтобы уменьшить взаимодействие с иммунной системой хозяина, что позволяет им реплицироваться и распространяться среди здоровых людей. Персистенция достигается путем комбинированной активности программы экспрессии гена вирусной латентности и продуцированием иммуносупрессорных молекул. Это позволяет вирусу избегать распознавания NK-клетками и цитотоксическими Т-лимфоцитами. Изучение этих сложных патогенетических механизмов вирусных иммуномодуляторов дает возможность лучше понять взаимоотношения патогенов и их хозяев.
Среди иммунных механизмов в патогенезе вирусного гепатита важное значение имеет дефицит продукции альфа-интерферона, что приводит к снижению его противовирусного действия и активации вирусной репликации [2, 10].
Цель: работа посвящена обзору клинических исследований по изучению эффективности препарата Аллокин-альфа при острых и персистирующих ВИ, вызванных CМV, Herpes zoster, EBV, HSV-1, вирусом гепатита В и С, вирусами острых респираторных заболеваний.
Противовирусная активность Аллокина-альфа
Аллокин-альфа — антивирусный препарат, представитель нового семейства антивирусных пептидов природного происхождения. Он представляет собой синтетический линейный цитокиноподобный олигопептид с молекулярной массой 1265 дальтон и состоит из 13 L-аминокислот. Действующим веществом Аллокина-альфа является аллоферон [6–9].
/35/35.jpg)
Аллокин-альфа относится к иммунотропным лекарственным препаратам. Его действие направлено на усиление распознавания вирусных антигенов и инфицированных клеток натуральными (естественными) киллерами (NK), нейтрофилами и другими эффекторными системами естественного иммунитета, ответственными за элиминацию вируса.
Именно такой механизм действия особенно актуален при лечении рецидивирующих ВИ. Как показали исследования последних лет, разные представители Herpesviridae защищают инфицированную клетку хозяина от уничтожения цитотоксическими лимфоцитами, блокируя активность Т- и NK-клеток. Этим и объясняется развитие хронического процесса при ГИ. Аллокин-альфа улучшает распознавание пораженных клеток и позволяет подавить очаги репликации вируса. Аллокин-альфа усиливает продукцию интерферона гамма естественными киллерами в ответ на стимуляцию интерлейкином (ИЛ-12) [8].
В отличие от известных индукторов ИФН Аллокин-альфа выступает в качестве кофактора, позволяя продуцирующим ИФН-aльфа лейкоцитам эффективно реагировать на вирусный антиген. Это дает возможность сфокусировать действие препарата в месте размножения вируса и избежать избыточной реакции лейкоцитов за пределами очага инфекции [5].
В проведенных ранее работах установлено, что Аллокин-альфа оказывает влияние на факторы естественного иммунитета (систему ИФН, естественные киллеры), стимулирует фагоцитоз, а также обладает антивирусной активностью [7]. Все эти механизмы приводят к компенсации проявлений вторичной иммунной недостаточности и ликвидации дисбаланса компонентов систем иммунореактивности при воздействии вируса [6].
За прошедшие годы Аллокин-альфа успешно использовали в лечении больных опоясывающим герпесом, вирусными гепатитами В и С, EBV-инфекцией, папилломавирусной инфекцией и даже лямблиозом. Аллокин-альфа сочетается с основными лекарственными формами, а именно с противовирусными ХП, антибиотиками, ИФН и их индукторами, антиоксидантами и другими препаратами.
Активация NK-клеток
Естественные киллеры представляют собой большие гранулярные лимфоциты, не имеющие на своей поверхности ни иммуноглобулярного рецептора, ни антигенраспознающего Т-клеточного рецептора. Однако они способны распознавать и разрушать определенные опухолевые и вирусинфицированные клетки. Этот киллинговый эффект осуществляется NК-клетками независимо от антител и комплемента. NK-распознавание не требует реаранжировки рецепторов или клональной экспансии, поэтому NK-клетки способны быстро реагировать на инфекцию. Они могут быть активированы благодаря прямому взаимодействию их активирующих рецепторов с лигандами, которые экспрессируются на поверхности вирусинфицированной клетки. Также NK-клетки могут быть активированы цитокинами, например интерферонами, которые продуцируются другими клетками иммунной системы в ответ на внедрение вирусов.
Активированные NK-клетки напрямую убивают инфицированные клетки (гранзимы, перфорины) либо продуцируют в месте заражения воспалительные цитокины, которые стимулируют созревание или активируют другие иммунные клетки.
Главный цитокин, который секретируется NK-клетками после активации, — ИФН-гамма. Он активирует макрофаги и Т-клетки — основные эффекторные клетки, участвующие в иммунном ответе.
Итак, главная эффекторная функция NK-клеток — продукция цитокина. Они помогают ограничивать и контролировать распространение вируса в первые часы и дни после заражения. С учетом этой важной роли NK-клеток в регуляции ВИ неудивительно, что многие вирусы выработали механизмы для модуляции активности NK-клеток. Понимая этот факт, без медикаментозной активации NK-клеток препаратами, «запрещающими выключение» цитокинов (Аллокин-альфа), обойтись не представляется возможным.
Наиболее изученными эти механизмы были у вирусов семейства Herpesviridae. Поскольку вирус герпеса кодирует очень большое количество генов, часть вирусного генома может кодировать иммуносупрессорные белки. Эти иммуносупрессанты позволяют вирусу «скрываться» от основных компонентов иммунной системы и таким образом позволяют вирусу герпеса персистировать.
Герпесвирусы, вирусы гепатита В и С, ВИЧ-инфекции не только персистируют, но и репродуцируются в клетках иммунной системы, тем самым они, обусловливая гибель или снижение функциональной активности этих клеток, способствуют развитию вторичных иммунодефицитных состояний и поддерживают длительную персистенцию вируса. Таким образом, возникает своеобразный порочный круг.
К преимуществам комплексной терапии вирусных инфекций следует отнести следующие:
— сочетанное применение противовирусных химиопрепаратов и иммунобиологических средств обеспечивает аддитивный или синергический эффект;
— снижение дозы противовирусного химиопрепарата, следовательно, вероятности развития побочных эффектов, уменьшение токсического воздействия на организм больного;
— снижение вероятности возникновения устойчивых штаммов вирусов к данному препарату;
— достижение иммунокорригирующего эффекта;
— сокращение продолжительности острого периода болезни и сроков лечения;
— улучшение качества жизни пациентов.
Лекарственные средства, используемые в терапии ВИ, подразделяют на 4 основные группы:
— этиотропные — действуют на возбудитель болезни;
— иммуномодулирующие — осуществляют коррекцию иммунологических нарушений, возникающих в процессе болезни;
— патогенетические — уменьшают основные клинические проявления заболевания: интоксикацию, обезвоживание, сосудистые поражения, аллергические реакции, синдром полиорганной недостаточности, профилактируют бактериальные осложнения;
— симптоматические — купируют сопутствующие симптомы заболевания (боль, кашель, бессонница и др.).
Антивирусные химиопрепараты различных химических групп (Ершов Ф.И., 2006)
1. Производные адамантана.
2. Аналоги нуклеозидов:
2.1. Средства, селективно активируемые тимидинкиназой.
2.2. Ингибиторы ДНК-полимеразы.
2.3. Аналоги широкого спектра действия.
2.4. Ингибиторы обратной транскриптазы.
3. Ненуклеозидные ингибиторы обратной транскриптазы.
4. Ингибиторы протеаз.
5. Вирулицидные лекарственные средства.
6. Препараты, «запрещающие выключение» цитокинов (Аллокин-альфа).
7. Прочие препараты.
Известно, что реакции гуморального иммунитета не являются определяющими в борьбе с рецидивами Herpes zoster и лишь частично защищают от экзогенного вируса. Риск реактивации Herpes zoster резко возрастает у лиц, имеющих иммунодефициты различного генеза. В клинике Herpes zoster серьезное значение имеет синдром постзостерной невралгии, которая может наблюдаться у 20–30 % больных и сохраняться от 3 мес. до нескольких лет после перенесенного Herpes zoster. Прогностически неблагоприятным является угнетение клеточно-опосредованных иммунологических реакций, т.к. риск активизации Herpes zoster существенно возрастает. В частности, показано, что чем дольше происходит нормализация Т-клеточного звена иммунитета, тем длительнее острая боль. Раннее назначение противогерпетических препаратов на 30 % снижает риск развития синдрома периферической цервикальной недостаточности.
Противогерпетические ХП, быстро и эффективно купируя острые проявления ГИ, не предотвращают повторного рецидивирования герпеса, не снижают частоту рецидивов. Для повышения эффективности лечения в схемы терапии необходимо включать иммунобиологические средства, способствующие коррекции иммунологического статуса больного, а также патогенетические препараты, облегчающие состояние пациента.
Обзор клинических исследований эффективности Аллокина-альфа в терапии герпесвирусных инфекций (ВПГ, Herpes zoster, ВЭБ, вирусы гепатитов В и С)
Пациенты отбирались методом произвольной выборки при поступлении в стационар. Больных наблюдали в стационаре и амбулаторно в течение 3 месяцев после выписки из стационара.
Как видно из табл. 1, при включении в схему лечения больных Herpes zoster препарата Аллокин-альфа офтальмогерпес не развивается вообще (если он не развился до начала лечения Аллокином-альфа), а у 30 % пациентов наблюдается регресс уже начавшегося поражения глаз. Рецидивов Herpes zoster в течение 3 месяцев не было в наблюдаемых группах.
Поскольку гемограмма является частью иммунограммы, можно констатировать, что Herpes zoster с поражением глаз протекает на фоне лимфопении (вторичная иммунологическая недостаточность), однако после комплексной терапии (ацикловир + Аллокин-альфа) количество лимфоцитов увеличилось на 50 %, т.е. возрастала иммунобиологическая резистентность организма.
Было проведено исследование возможности использования Аллокина-альфа для лечения больных ВЭБ-инфекцией, поскольку данный препарат избирательно стимулирует функциональную активность NK-клеток, обладает свойствами индуктора эндогенного интерферона. Все это позволяет считать Аллокин-альфа лекарственным препаратом одновременно этиотропной и патогенетической терапии ВЭБ-инфекции.
Для лечения больных использовался Аллокин-альфа в виде шести подкожных инъекций по 1 мг через день. В качестве контроля эффективности терапии использовали метод ПЦР для выявления ДНК ВЭБ в крови через 2–3 месяца после окончания курса лечения и ИФА для определения антител IgM, IgG к ВЭБ. У всех больных после курса лечения Аллокином-альфа отмечалась положительная клиническая динамика:
— нормализовалась температура;
— уменьшились размеры печени и селезенки.
Полилимфаденопатия сохранялась у двоих из семи пациентов после проведенного лечения. После окончания курса терапии у всех больных улучшилось общее самочувствие.
В открытом проспективном рандомизированном контролируемом исследовании представлены результаты изучения клинической эффективности аллоферона при лечении больных острым гепатитом В.
Схемы и клиническая оценка результатов лечения. 54 пациента с верифицированным диагнозом ВГВ разной степени тяжести при помощи рандомизированных кодовых номеров были разделены на 3 группы: 1-я группа — 14 пациентов получали только базисную терапию; 2-я группа — 20 пациентов вместе с базисной терапией получали подкожные инъекции аллоферона 2 раза в неделю в дозе 1,0 мг в течение 3 недель — всего 6 инъекций по 1,0 мг; 3-я группа — 20 пациентов вместе с базисной терапией получали подкожные инъекции аллоферона 3 раза в неделю в дозе 1,0 мг в течение 3 недель — всего 9 инъекций по 1,0 мг. Лечение аллофероном назначали не позднее 5–7-го дня от начала желтушного периода.
У пациентов, лечившихся аллофероном, наблюдалась четкая тенденция к более быстрому исчезновению симптомов интоксикации. У больных испытуемой группы быстрее исчезали такие симптомы, как общая слабость и головная боль, прекращалась тошнота (для пациентов 2-й и 3-й групп по данному симптому р < 0,001). Примечательно, что у больных, получавших аллоферон, существенно сокращалась продолжительность температурной реакции (для испытуемых групп р < 0,001).
В процессе лечения темпы снижения уровней АлАТ и АсАТ, щелочной фосфатазы и гамма-глутамилтранспептидазы были выше у больных, получавших аллоферон. Уже на 10-й день лечения аллофероном активность АлАТ уменьшилась во 2-й группе больных в 2,9 раза и в 3-й группе — в 3,3 раза по сравнению с начальными показателями, в то время как в контрольной группе — только в 1,7 раза. По завершении лечения (21-й день) активность АлАТ в сыворотке крови больных, леченных аллофероном, уменьшилась во 2-й группе в 5,8 раза, в 3-й группе — в 7,8 раза, а у пациентов контрольной группы — в 4,5 раза. Соответственно, у больных испытуемой группы быстрее наступала нормализация уровня АлАТ. После окончания лечения (21-й день) во 2-й группе уровень АлАТ нормализовался у 15 % больных и в 3-й группе — у 5 %, в то время как в контрольной группе больных гипераминотрансфераземия сохранялась у всех пациентов.
После проведенной терапии (21-й день) HВsAg не был выявлен у 4 человек (20 %) во 2-й группе, у 4 пациентов (20 %) в 3-й группе и у 2 больных (14,3 %) группы сравнения. Через 30 дней от начала лечения HВsAg не был обнаружен у 7 больных (35 %) 2-й группы, у 10 человек (50 %) 3-й группы и у 4 пациентов (28,6 %) группы сравнения.
Таким образом, результаты определения HВsAg в сыворотке крови больных, леченных аллофероном, свидетельствуют о тенденции к быстрой элиминации HВsAg из крови больных в испытуемых группах по сравнению с контрольной группой, хотя статистически достоверных различий не установлено.
Одной из задач исследования было уточнение возможного влияния аллоферона на этиологический фактор, верифицируемый по ДНК HBV. До начала курса терапии ДНК HBV в сыворотке крови была выявлена у всех наблюдавшихся больных. По окончании лечения аллофероном ДНК HBV была выявлена у 14 человек (70 %) во 2-й группе и у 14 пациентов (70 %) в 3-й группе, в то время как в группе сравнения — у 12 человек (85,7 %). К 30-му дню от начала лечения ДНК HBV была выявлена у 9 больных (45 %) во 2-й группе, у 8 пациентов (40 %) в 3-й группе и у 6 человек (42,9 %) в группе сравнения.
Как видно из табл. 3, сроки выздоровления больных в испытуемых группах (с использованием Аллокина-альфа) были короче на всех этапах наблюдения, чем в группе сравнения. К 90-му дню наблюдения выздоровление наступило у 50–75 % пациентов, получавших Аллокин-альфа (аллоферон), в то время как в группе сравнения — только у 21,4 %. Различия в сроках выздоровления больных, получавших аллоферон по 1,0 мг 3 раза в неделю, и пациентов группы сравнения высокодостоверны (р < 0,001). К 180-му дню все больные, лечившиеся аллофероном, выздоровели, тогда как в группе сравнения выздоровление наступило у 92,9 % больных.
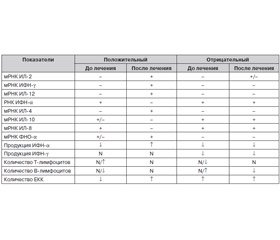
При ВГС-инфекции возрастало число больных, у которых определялись мРНК ИФН-aльфа, ИЛ-2, -4, -6, -18, по сравнению со здоровыми добровольцами. При этом обнаружено, что в стадии обострения до лечения снижалась встречаемость больных с выявленной мРНК ИФН-гамма, ФНО-aльфа, ИЛ-12, а мРНК ИЛ-8 и ИЛ-10 определялась у больных ВГС с той же частотой, что и у здоровых добровольцев.
Встречаемость мРНК ИФН-гамма через 10 дней терапии обнаруживалась в 2 раза чаще, чем до лечения. А через 20–30 дней и до конца срока наблюдения выявляемость мРНК этого цитокина у обследованных пациентов была такой же, как и у здоровых добровольцев. Можно предполагать нормализацию иммунного ответа у этих больных по Тh1-типу, что является благоприятным признаком при лечении ВГС.
Таким образом, Аллокин-альфа рекомендуется для лечения больных острым ВГС. Проведенные исследования интерферонового и цитокинового статусов больных ВГС показали, что в результате лечения положительный клинический эффект наблюдался при следующих закономерностях в изменении лабораторных показателей (табл. 4).
Выводы
1. Мишенью Аллокина-альфа в организме служат две основные системы антивирусной защиты, играющие основную роль в сдерживании вирусной агрессии, — система интерферона и цитотоксические лимфоциты.
2. Парентеральное применение Аллокина-альфа не вызывало аллергических и других побочных реакций, хорошо переносилось больными; данный препарат удобен в применении, сочетается с другими препаратами. Аллокин-альфа может быть рекомендован для широкого практического применения как препарат выбора в комплексной терапии опоясывающего герпеса.
3. Установлена высокая эффективность препарата Аллокин-альфа при лечении ВЭБ-инфекции. В связи с этим представляется перспективным дальнейшее использование Аллокина-альфа для лечения больных различными формами ВЭБ-инфекции.
4. Показано, что терапия Аллокином-альфа обеспечивает восстановление и поддержание на стабильно высоком уровне функциональной активности данных систем у больных вирусными гепатитами В и С. Этим обстоятельством можно объяснить длительное терапевтическое действие Аллокина-альфа (длительное последействие) — более месяца после краткосрочного курса лечения, а также повышенную активность NK-клеток в течение недели, включая однократную инъекцию препарата.
5. Аллокин-альфа повышает способность к продукции ИФН-гамма и в целом восстанавливает активность по Th1-типу иммунного ответа, позволяет подавить очаги репликации вируса.
6. Сочетанное использование Аллокина-альфа с препаратами, имеющими различный механизм действия (противовирусные химиопрепараты, интерфероны и пр.), позволяет рассчитывать на получение аддитивного или даже синергического эффекта этих препаратов у большинства пациентов.
7. Применение Аллокина-альфа сокращало период клинических проявлений гепатита В. Особенно это видно по таким клиническим симптомам, как желтуха и интоксикация: пациенты, которым проводился курс лечения препаратом Аллокин-альфа, в инфузионной дезинтоксикационной терапии не нуждались. Лечение аллофероном обеспечивает благоприятную динамику клинических проявлений ВГВ и ускоряет выздоровление.
8. Препарат Аллокин-альфа рекомендуется к медицинскому применению для лечения больных со среднетяжелой формой острого гепатита В. Аллоферон назначается в ранние сроки желтушного периода (до 7-го дня) по схеме: 1,0 мг подкожно 3 раза в неделю в течение 3 недель. Всего на курс лечения 9 инъекций по 1,0 мг.
9. Практикующим врачам для принятия решения о назначении препарата Аллокин-альфа не требуется обязательного проведения иммунологических исследований, т.к. на основании изучения патогенеза основных вирусных инфекций установлены угнетение клеточных реакций, нарушение синтеза эндогенных интерферонов (ИФН-дефицит), снижение активности цитотоксических лимфоцитов. Следует отметить, что именно два последних фактора неспецифической резистентности (интерфероны и цитотоксические лимфоциты) являются основной мишенью Аллокина-альфа в организме больного.
1. Баринский И.Ф. Герпесвирусные инфекции — иммунодефицитные заболевания ХХI века // Актуальные проблемы герпесвирусных инфекций. — М., 2004. — С. 5–7.
2. Бурневич Э.А. 4-я конференция Европейского общества по изучению печени // Гепатологический форум. — 2010. — 4. — С. 26–32.
3. Дранник Г.Н. Клиническая иммунология и аллергология: Пособие для студентов, врачей интернов, иммунологов, аллергологов, врачей лечебного профиля всех специальностей. — К., 2010. — 552 с.
4. Ершов Ф.И., Кубанова А.А., Пинегин Б.В. и др. Влияние терапии «аллокином-альфа» на течение рецидивов хронического генитального герпеса // Materia Medica. — 2003. — № 4. — С. 103–111.
5. Ершов Ф.И., Романцов М.Г. Лекарственные средства, применяемые при вирусных заболеваниях: Руководство для врачей. — М.: ГЭОТАР-Медиа, 2007. — 363 с.
6. Исаков В.А., Архипова Е.И., Азовцева О.В., Черныш С.И., Кутуева Ф.Р., Семенов А.Е. Аллокин-альфа в комплексной терапии герпетической инфекции // Terra Medica. — 2006. — № 3. — С. 14–17.
7. Исаков В.А., Архипова Е.И., Исаков Д.В. Герпеcвирусные инфекции человека: Руководство для врачей. — СПб.: СпецЛит., 2006. — 303 с.
8. Чешик С.Г., Шкурко Т.В., Козлова А.В. и др. Клинико-лабораторная оценка терапевтической эффективности и безопасности иммуномодулирующего препарата Аллоферон при остром гепатите В: Сборник тезисов VI Российского съезда врачей-инфекционистов. — М., 2003. — С. 24.
9. Шишкин М.К., Исаков В.А., Ермоленко Д.К. и др. Герпесвирусные инфекции // Избранные вопросы терапии инфекционных больных: Руководство для врачей / Под ред. Ю.В. Лобзина. — СПб.: Фолиант, 2005. — С. 636–664.
10. Мязин Р.Г., Хабибуллин Э.Р. Противовирусный препарат Аллокин-альфа как стимулятор лейкопоэза у больных хроническими вирусными гепатитами В и С // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2009. — 19(5), приложение 34, тез. 370. — С. 98.
11. Chernysh S.I., Kim S.I., Bekker G. et al. Antiviral andantitumor peptides from insects // Proc. Nat. Acad. Sci. USA. — 2002. — 99(20). — Р. 12628–12632.

/37/37.jpg)
/38/38.jpg)
/39/39.jpg)
/40/40.jpg)