Журнал «Медицина неотложных состояний» 7 (62) 2014
Вернуться к номеру
Збалансована інфузійна терапія невідкладних станів в урологічній практиці
Авторы: Нікітін О.Д. - Національний медичний університет ім. О.О. Богомольця; Малолітній Л.М. - Олександрівська міська клінічна лікарня, м. Київ
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Стаття присвячена використанню плазмозамінників із метою усунення дефіциту об’єму циркулюючої крові. Наведені результати дослідження ефективності препарату Волютенз для інтенсивної терапії при невідкладних станах в урологічній практиці — при гострому обструктивному пієлонефриті, ускладненому бактеріотоксичним шоком, а також при гострій крововтраті під час оперативних втручань.
Статья посвящена применению плазмозаменителей с целью устранения дефицита объема циркулирующей крови. Представлены результаты исследования эффективности препарата Волютенз для интенсивной терапии при неотложных состояниях в урологической практике — при остром обструктивном пиелонефрите, осложненном бактериотоксическим шоком, а также при острой кровопотере в ходе оперативных вмешательств.
Article deals with the use of plasma substitutes in order to eliminate the deficit in circulating blood volume. The results of the study on Volutens efficacy for intensive care in emergencies in urological practice — in acute obstructive pyelonephritis, complicated with bacteriotoxic shock, as well as in acute blood loss during surgery — are provided.
об’єм циркулюючої крові, інфузія, плазмозамінники, Волютенз.
объем циркулирующей крови, инфузия, плазмозаменители, Волютенз.
circulating blood volume, infusion, plasma substitutes, Volutens.
Статья опубликована на с. 51-56
За визнанням більшості дослідників і клініцистів, «нормальний внутрішньосудинний об’єм — основа життєзабезпечення». У 75 % тяжких хворих, які не отримували адекватну інфузійну терапію вчасно, некорегована гіповолемія стала основною причиною летального кінця [3, 12, 17].
Інфузійна терапія визначається об’ємним і рідинним компонентами відшкодування втрат, перший з яких відновлює внутрішньосудинний об’єм, а другий — компенсує екстрацелюлярні й інтрацелюлярні втрати рідини й електролітів.
Цілі і завдання інфузійної терапії:
— заповнення об’єму циркулюючої крові (ОЦК);
— забезпечення ефективного транспорту кисню;
— відновлення водно-електролітного балансу, кислотно-лужної рівноваги, осмотичного балансу й онкотичної рівноваги;
— усунення порушень реологічних і коагуляційних властивостей крові;
— ліквідація розладів мікроциркуляції і тканинної гіпоксії;
— корекція імунного статусу (регуляція запальних реакцій і взаємодій у системі «клітини ендотелію — лейкоцити») [2, 9, 15].
Сталість колоїдно-осмотичного тиску крові в людини є загальним законом, без якого неможливе її нормальне існування. Онкотичний тиск обумовлено електролітами й деякими неелектролітами з низькою молекулярною масою (глюкоза та ін.). Чим більша концентрація таких речовин у розчині, тим вищий осмотичний тиск. Онкотичний тиск плазми залежить в основному від умісту в ній мінеральних солей і становить у середньому 768,2 кПа (7,6 атм.). Близько 60 % усього осмотичного тиску обумовлено солями натрію. Онкотичний тиск — частка осмотичного тиску, створювана високомолекулярними компонентами розчину плазми — білками. За рахунок цього рідина (вода) утримується в судинному руслі. Стінка капілярів вільно проникна для води і низькомолекулярних речовин, але не для білків [4, 16].
З білків плазми найбільшу участь у забезпеченні величини онкотичного тиску беруть альбуміни; унаслідок малих розмірів і високої гідрофільності вони мають виражену здатність притягувати до себе воду [13].
Згідно з положеннями Міжнародної програми, що розроблена Кампанією за виживаність при сепсисі, одним із провідних заходів інтенсивної терапії хворих на сепсис є рідинна ресусцитація [1, 4, 9]. Причому відсутні очевидні докази переваги будь-якого з сучасних плазмозамінників. Тобто кристалоїдні розчини за своїм ефектом не поступаються колоїдним, а серед останніх відсутні ті, що мають найкращий ефект для зниження смертності [4, 9]. У той же час існують численні дані експериментальних досліджень, згідно з якими застосування колоїдів перешкоджає швидкому розвитку та прогресуванню синдрому капілярного витоку, сприяє утриманню рідини в судинах, перешкоджає набряку інтерстицію і тим самим покращує мікроциркуляторні процеси та забезпечення організму киснем [6, 8]. Цілком логічно, що різні контингенти хворих залежно від ступеня проявів системної запальної реакції та тяжкості їх стану мають потребувати й різного складу інфузійної терапії, що ще й досі чітко не визначено.
На жаль, кристалоїдні розчини, що широко застосовують для проведення інфузійної терапії, досить швидко виводяться з судинного русла, і їх гемодинамічний ефект може зникати вже через 15 хв після введення, тому для підтримання стабільної гемодинаміки ці препарати слід вводити у значному об’ємі. Отже, їх доцільно комбінувати з препаратами, що здатні затримуватись у судинному руслі більш тривалий час, а саме з колоїдними розчинами, що меншою мірою проникають в інтерстиціальну рідину і при поєднанні з кристалоїдами ліквідують набряк тканин, сприяють переміщенню позасудинної рідини в судинне русло під дією градієнта колоїдно-осмотичного тиску. Колоїдні розчини також покращують реологічні властивості крові та мікроциркуляцію [10].
Показання до призначення плазмозамінників
I. Кристалоїди:
— Поповнення втрати позаклітинної рідини.
— Базова інфузія під час хірургічних втручань.
— Лікування помірної гіповолемії.
II. Колоїди:
— Корекція гіповолемії при гострій крововтраті, шоці, травмі, опіках і сепсисі.
— Нормоволемічна гемодилюція.
— Запобігання розвитку гіповолемії і зниження крововтрати при спінальній і епідуральній анестезії.
— Заповнення апаратів для штучного кровообігу.
— Екстракорпоральні процедури відшкодування плазмовтрат.
Характеристики ідеального колоїду
I. Ефективність:
— Швидка стабілізація гемодинаміки.
— Тільки внутрішньосудинний розподіл.
— Достатня тривалість клінічного об’ємного ефекту.
— Керованість і передбачуваність.
II. Безпека:
— Відсутність накопичення в органах і тканинах навіть після масивної інфузії.
— Апірогенність, антиалергенність.
— Відсутність впливу на згортання крові.
— Відсутність впливу на імунну функцію.
— Відсутність впливу на функцію нирок [5, 13].
При незупиненій кровотечі програму інфузійно-трансфузійної терапії (ІТТ) реалізують у 2 етапи. На першому з них (до остаточної зупинки кровотечі) використовують кровозамінники з метою підтримки гемодинаміки на безпечному для життя потерпілого рівні, а також для зниження або усунення тяжких проявів гіповолемії. На другому етапі (після зупинки кровотечі) ІТТ спрямована:
— на усунення дефіциту ОЦК шляхом нормалізації насамперед об’єму циркулюючої плазми, для чого необхідно використовувати колоїдні розчини кровозамінників, що справляють гемодинамічну дію, здатні тривало утримуватися в судинному руслі (альбумін, протеїн, поліглюкін);
— відновлення мікроциркуляції для нормалізації функцій органів, розрідження крові та надходження еритроцитів у капілярний кровотік, заповнення об’єму циркулюючих еритроцитів. У цих випадках показано застосування низькомолекулярних розчинів, що мають реологічну активність (альбумін, протеїн, реополіглюкін, желатиноль);
— заповнення дефіциту інтерстиціальної рідини для нормалізації транскапілярного обміну, що досягається використанням сольових розчинів (Рінгера — Локка, Рінгера лактату, лактасолу та ін.);
— відновлення киснево-транспортної функції крові шляхом переливання цільної крові (консервованої донорської) або еритроцитарної маси.
Гостра крововтрата — результат швидкої та інтенсивної кровотечі. Розрізняють три ступені крововтрати залежно від кількості втраченої крові:
— помірна крововтрата — до 20 % від початкового ОЦК постраждалого (у середньому до 1 л);
— велика — до 40 % (у середньому 2–2,5 л);
— масивна — понад 40 % (3–3,5 л).
При масивній кровотечі значна кількість рідини мобілізується з депо для підтримання об’єму циркулюючої крові, до того ж кровоносне русло саме здатне змінювати свою ємність. Унаслідок цього відбувається природна гемодилюція і збільшується текучість крові. Необхідність інфузійної корекції виникає тоді, коли навіть після мобілізації внутрішніх запасів рідини в організмі об’єм циркулюючої крові є недостатнім для підтримання адекватної перфузії головного мозку, нирок, легень та ін. Отже, головним фактором, що робить кровотечу фатальною, можна вважати фактор порожнього судинного русла. Тому інфузійна терапія і є однією з найважливіших складових лікування пацієнтів із крововтратою [7, 18].
Які ж завдання має вирішити інфузійна терапія на доклінічному етапі? По-перше, це підтримання достатнього об’єму циркулюючої крові для забезпечення серцевого викиду; по-друге, збереження мікроциркуляції і, таким чином, уникнення або зменшення в подальшому проявів поліорганної недостатності. Крім того, ці препарати мають якомога менше впливати на процеси згортання крові, адже травма дуже часто супроводжується розвитком синдрому дисемінованого внутрішньосудинного згортання крові.
При проведенні ІТТ для усунення наслідків крововтрати слід ураховувати, що дефіцит ОЦК завжди більший від обумовленого об’єму крововтрати, тому кількість інфузійних розчинів повинна перевищувати величину крововтрати в 1,5–2 рази. Співвідношення колоїдних і кристалоїдних розчинів повинне бути не менше 1 : 1. Чим більша крововтрата, тим більше потрібно кристалоїдних розчинів для запобігання дефіциту поза- і внутрішньоклітинної рідини. При масивній крововтраті це співвідношення може становити 1 : 2 і більше [3, 14].
Розчини желатину належать до штучних колоїдів, так само як і розчини гідроксіетилкрохмалю і декстрани. З моменту першого застосування розчину желатину J. Hogan (1915) для заміщення крові при смертельній крововтраті минуло майже 100 років. У даний час у світі застосовуються більше ніж 50 препаратів на його основі.
Найбільш привабливою з точки зору безпеки та ефективності є молекула модифікованого желатину. Унікальність даної молекули: для запобігання міграції молекули модифікованого желатину крізь судинну стінку протеїнові ланцюжки мають виражений електронегативний заряд, що досягається за допомогою реакції з сукцинільованим ангідридом. Процес сукцинілювання й формування електронегативного заряду призводить до витягування протеїнових ланцюгів, у результаті чого відбувається значне збільшення їх об’єму. Електронегативно заряджені молекули модифікованого желатину відштовхуються від ендотеліальної мембрани судинної стінки, що так само має негативний заряд.
Серед цієї групи лікарських засобів особливу увагу до себе привертає вітчизняний препарат Волютенз — 4% розчин модифікованого (сукцинільованого) желатину, розчинений у збалансованому розчині (Рінгера ацетат). Слід зазначити, що сьогодні на українському фармацевтичному ринку він є єдиним плазмозамінником на основі желатину. Внаслідок сукцинілювання змінюється конфігурація молекул желатину, збільшується його молекулярна маса і він проявляє більший об’ємний ефект, ніж несукцинільовані білкові ланцюжки. Важливою перевагою цього препарату є й те, що його об’ємозамісний ефект зберігається протягом не менше ніж 3–4 год, після чого він швидко й повністю виводиться з організму (переважно з сечею). Волютенз виводиться через нирки. Лише невеликі кількості виводяться через кишечник, і не більше 1 % метаболізується. Маленькі молекули екскретуються безпосередньо шляхом гломерулярної фільтрації, тоді як великі молекули спочатку піддаються протеолітичній деградації в печінці, а потім також екскретуються з нирками. Протеолітичний метаболізм адаптується настільки легко, що навіть в умовах ниркової недостатності акумуляції желатину в організмі не спостерігається. Період напіввиведення становить 4–5 годин. Період напіввиведення Волютензу з плазми може бути пролонгований у пацієнтів, які знаходяться на гемодіалізі (швидкість клубочкової фільтрації < 0,5 мл/хв).
Таким чином, метою нашої роботи було вивчення ефективності препарату Волютенз для інтенсивної терапії при невідкладних станах в урологічній практиці — при гострому обструктивному пієлонефриті, ускладненому бактеріотоксичним шоком, а також при гострій крововтраті під час оперативних втручань.
Матеріали й методи
У дослідження були включені 32 хворі на гострий вторинний (обструктивний) пієлонефрит, які перебували на лікуванні у відділенні урологічної реанімації у 2014 р.
Середній вік хворих становив 53,0 ± 5,4 року і коливався від 28 до 76 років. Всі хворі були розподілені на 2 групи — основну (ОГ; 17 осіб), у комплексній терапії використовувався Волютенз, і групу порівняння (ГП; 15 осіб), в інфузійній терапії якої застосовувалися тільки кристалоїдні розчини. Характеристика хворих обох груп залежно від виду урологічної патології та супутніх захворювань наведена в табл. 1.
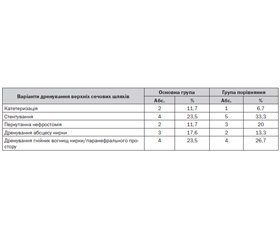
Об’єктивними критеріями оцінки ефективності лікування служили зміни таких показників, як гіпертермія, тахікардія, лейкоцитоз, паличкоядерний нейтрофільоз, підвищення швидкості осідання еритроцитів (ШОЕ), рівень креатиніну крові, діурез. Всім хворим було проведено дренування верхніх сечових шляхів завдяки катетеризації, стентування або перкутанну нефростомію, перкутанне дренування гнійних вогнищ нирки і паранефрального простору (табл. 2).
Слід зазначити, що і в основній групі, і в групі порівняння частіше спостерігалися камені сечоводу (29,4 % в ОГ і 26,6 % у ГП), потім — абсцес нирки (23,5 % в ОГ, 13,3 % у ГП), гнійний паранефрит (17,6 % в ОГ, 20,0 % у ГП), поєднана патологія (17,6 % в ОГ, 26,6 % у ГП).
Супутня патологія значною мірою сприяє розвитку бактеріотоксичного шоку. Зокрема, цукровий діабет мав місце у 35,3 % хворих ОГ і 40,0 % — ГП, ожиріння траплялося у 25,7 % пацієнтів ОГ і 26,7 % — ГП, гіпертонічна хвороба — у 41,7 % в ОГ і 46,6 % — у ГП, атеросклеротичний кардіосклероз — у 47,0 % хворих ОГ і у 46,7 % — ГП.
Дренування верхніх сечових шляхів проводилося переважно шляхом стентування: у 23,5 % пацієнтів ОГ й у 33,3 % — ГП, катетеризація — в 11,7 % в ОГ й у 6,7 % — ГП, перкутанна нефростомія виконувалася при неможливості катетеризації в 11,7 % хворих ОГ й у 20 % — ГП, дренування абсцесу нирки — у 17,6 % в ОГ й у 13,3 % — ГП, дренування гнійного вогнища — у 23,5 % ОГ й у 26,7 % пацієнтів ГП.
Всі хворі отримували базисну терапію, що включає антибактеріальні, протизапальні, імуномодулюючі препарати, дезагреганти й антикоагулянти. У складі інфузійної терапії хворі ОГ отримували Волютенз у дозі 15 мл/кг на добу.
Також проведено оцінку ефективності збалансованої інфузійної терапії на основі постійної інфузії Волютензу при урологічних операціях із крововтратою понад 20 % ОЦК у 7 хворих (у 4 пацієнтів — нефректомія, у 3 — простатектомія).
У групі А (n = 7) з метою корекції гіповолемії та стабілізації гемодинаміки використовувалася інфузія плазмокоректора Волютензу. Темп інфузії визначався станом гемодинаміки і становив у середньому 13,0 ± 2,2 мл/кг на безкровному етапі, збільшуючись до струминного введення за рахунок Волютензу на етапі крововтрати. Групу В становили пацієнти (n = 13), яким у складі ІТТ застосовували різні поєднання колоїдів і кристалоїдів за дефіцитним принципом. В обох групах показанням до використання еритроцитарної маси було зниження рівня Hb менше 70 г/л (табл. 3).
Результати та їх обговорення
Застосування Волютензу сприяло істотному покращанню гемодинамічних показників і нормалізації центральної гемодинаміки порівняно з пацієнтами ГП, у яких була потреба у введенні вазопресорів (табл. 4). Слід зазначити, що гемодинамічна та протишокова дія Волютензу починає проявлятися практично відразу ж після початку лікування і зберігається в подальшому. Це обумовлено тим, що при застосуванні Волютензу у хворих із гіповолемією збільшується ОЦК і поліпшуються гемодинамічна і серцева функції, а нормальний об’єм крові підтримується протягом не менше 6 год.
Аналіз динамічного спостереження свідчить про прогресивне поліпшення стану хворих в обох групах. Найбільш виражені ознаки зменшення інтоксикації в групі хворих, які отримували Волютенз: значно менша загальна слабкість (0,30 ± 0,07 в основній групі і 1,20 ± 0,07 — у групі порівняння, р < 0,05), головний біль (0,005 ± 0,045 — в основній групі і 1,80 ± 0,07 — у групі порівняння, р < 0,05), лихоманка з ознобом (1,30 ± 0,08 — в основній групі і 1,80 ± 0,09 — у групі порівняння). Відзначається виражене поліпшення загального стану хворих основної групи (2,30 ± 0,05 — до лікування, 0,40 ± 0,02 — після лікування (р < 0,05)) порівняно з групою порівняння (2,60 ± 0,03 — до лікування, 1,70 ± 0,05 — після лікування). Безсумнівно, у ГП відзначалася позитивна динаміка суб’єктивних параметрів, але в цілому хворі ОГ почувалися значно краще.
Динаміка об’єктивних параметрів наведена в табл. 5. На 6-ту добу спостерігається нормалізація температури тіла у 15 хворих основної групи і в 11 — групи порівняння, зменшення тахікардії у 14 хворих основної групи і у 12 із групи порівняння, нормалізація кількості лейкоцитів крові у 16 хворих основної групи і у 13 із групи порівняння, зниження ШОЕ у 12 хворих основної групи і у 8 із групи порівняння.
Зниження рівня креатиніну крові (з 120,0 ± 5,4 мкмоль/л до 67,3 ± 5,2 мкмоль/л в основній групі, p < 0,05) і збільшення діурезу (з 1,1 ± 0,3 л до 2,3 ± 0,2 л) у хворих, які отримували Волютенз, є наслідком поліпшення ниркової гемодинаміки й осмодіуретичної дії препарату.
Стосовно переносимості Волютензу слід зазначити, що ніхто з пацієнтів не відзначив побічних реакцій або непереносимості безпосередньо після інфузії, що свідчить про його високий профіль безпеки.
Загальний обсяг інфузійної терапії при значній крововтраті не розрізнявся між групами і становив у середньому 5378 ± 283 мл (група А) і 5415 ± 371 мл (група В). Дані про кількісний та якісний склад ІТТ наведені в табл. 6.
Як видно з табл. 6, постійна інфузія Волютензу в групі А визначила його більший обсяг у складі ІТТ, ніж інфузія плазмокоректорів за показаннями у групі В (р < 0,05).
Разом із тим свіжозаморожена плазма й еритроцитарна маса в групі А використовувалися в меншій кількості, ніж у групі В (р < 0,05), а вазоактивна підтримка мезатоном застосовувалася у 2,5–3 рази рідше (р < 0,01).
Незважаючи на рівнозначні об’єми використаних розчинів, корекція метаболічного ацидозу в групі В була менш ефективною (р < 0,05) і дефіцит у ній перевищував допустимі значення (р < 0,05). Загальний гемогідробаланс у групах А і В був помірно позитивним (+575 ± 210 мл і +920 ± 340 мл відповідно). Інтраопераційний діурез у групі А становив 520 ± 105 мл, у групі В — 375 ± 96 мл (р < 0,05).
При операціях із великою крововтратою постійна інфузія плазмокоректора Волютенз запобігає розвитку гіповолемії та нестабільності гемодинаміки, сприяючи меншому використанню алогенних еритроцитів і плазми.
Висновки
1. Отримані в нашій роботі результати показали, що використання багатокомпонентного колоїдно–гіперосмолярного розчину Волютенз для протишокової терапії при гострому обструктивному пієлонефриті супроводжувалося більш вираженою стабільністю показників гемодинаміки, ніж у пацієнтів групи порівняння.
2. Можливість усунення ацидозу, електролітних порушень і гіповолемії сприяла більш швидкому поліпшенню цілої низки суб’єктивних і об’єктивних показників.
3. Використання збалансованої інфузійної терапії на основі постійної інфузії Волютензу при операціях із крововтратою понад 20 % ОЦК забезпечує адекватну функцію нирок і помірний позитивний гемогідробаланс.
Наведені дані свідчать про доцільність застосування багатокомпонентного полііонного колоїдно-гіперосмолярного розчину Волютенз в комплексній терапії при невідкладних станах в урології.
1. Арбулиев М.Г., Арбулиев К.М. Бактериотоксический шок при остром гнойном пиелонефрите // Урология. — 2002. — № 3. — С. 18–21.
2. Барышев А.А. Гемодинамические плазмозаменители // Мир медицины. — 2001. — № 3–4. — С. 21–23.
3. Владыка А.С., Суслов В.В., Тарабрин О.А. Инфузионная терапия при критических состояниях. — К.: Логос, 2010. — 274 с.
4. Курсов С.В. Гідродинаміка у хворих з абдомінальним сепсисом при низьких оцінках за шкалою APACHE–II // Харківська хірургічна школа. — 2011. — № 6. — С. 89–92.
5. Гуменюк Н.И., Киркилевский С.И. Инфузионная терапия. — К.: Книга плюс, 2004. — 208 с.
6. Лишневская В.Ю. Посиндромная инфузионная терапия в практике врача-терапевта // Украинский химиотерапевтический журнал. — 2010. — № 1–2. — С. 21–23.
7. Рациональная инфузионная терапия / В.И. Черний, А.Н. Колесников, К.Н. Олейников и др. — Донецк: Издатель Заславский А.Ю., 2012. — 184 с.
8. Инфузионная терапия в периоперационном периоде / С.Г. Решетников, А.В. Бабаянц, Д.Н. Проценко [и др.] // Медицина неотложных состояний. — 2009. — № 7. — С. 55–62.
9. Руководство по интенсивной терапии / А.В. Беляев, М.В. Бондарь, А.М. Дубов и др. / Под ред. А.И. Трещинского. — К.: Вища школа, 2004. — 582 с.
10. Воротынцев С.И. Сбалансированная инфузионная терапия при операциях с большой кровопотерей // Украинский химиотерапевтический журнал. — 2008. — № 1–2. — С. 108–110.
11. Effect of fluid loading with saline or colloids on pulmonary permeability, oedema and lung injury score after cardiac and major vascular surgery / J. Verheij, A. van Lingen, P.G.H.M. Raijmakers [et al.] // British Journal of Anaesthesia. — 2006. — Vol. 96, № 1. — P. 21–30.
12. Reengineering intravenous drug and fluid administration processes in the operating room: step one: task analysis of existing processes / D.B. Fraind, J.M. Slagle, V.A. Tubbesing, S.A. Hughes [et al.] // Anesthesiology. — 2002. — Vol. 97, № 1. — Р. 139–147.
13. Joshi G.P. Intraoperative fluid restriction improves outcome after major elective gastrointestinal surgery // Anesth. Analg. — 2005. — Vol. 101, № 2. — Р. 601–605.
14. A rational аpproach to perioperative fluid management / D. Chappell, M. Jacob, K. Hofmann-Kiefer, P. Conzen, M. Rehm // Аnesthesiology. — 2008. — Vol. 109, № 4. — P. 723–740.
15. Jacob M. Perioperative fluid administration: another form of «worklifebalance» / М. Jacob, D. Chappell, M. Rehm // Anesthesiology. — 2011. — Vol. 114, № 3. — Р. 483–484.
16. Jungheinrich C. The starch family: are they all equal? // Transfusion Alternatives in Transfusion Medicine. — 2007. — 9(3). — 152–163.
17. Impact of high-molecular hydroxyethyl starch solutions on plasma volume and haemodynamics in porcine faecal peritonitis / T. Simon, T. Schuerholz, P. Petzel [et al.] // Critical Care. —2006. — Vol. 10 (Suppl.1). — P. 174.
18. Surviving Sepsis Campaign: International guidelines for management of severe sepsis and septic shock: 2008 / R.P. Dellinger, M.M. Levy, J.M. Carlet [et al.] // Intensive Care Medicine. — 2008. — Vol. 34, № 1. — P. 17–60.

/53/53.jpg)
/54/54.jpg)
/55/55.jpg)