Газета «Новости медицины и фармации» 21-22 (523-524) 2014
Вернуться к номеру
Метаболічні та органопротекторні ефекти телмісартану в пацієнтів із гіпертонічною хворобою
Авторы: Свіщенко Є.П., Міщенко Л.А., Мхітарян Л.С., Євстратова І.Н., Боженко Г.М., Радченко В.В. — Державна установа «Національний науковий центр «Інститут кардіології ім. акад. М.Д. Стражеска»
НАМН України, м. Київ
Рубрики: Кардиология
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 10-12 (Мир)
Основною метою лікування пацієнта з гіпертонічною хворобою (ГХ) є максимальне зменшення сумарного ризику серцево-судинних катастроф як за рахунок досягнення та підтримання цільового артеріального тиску (АТ), так і шляхом корекції інших факторів серцево-судинного ризику (дисліпідемія, цукровий діабет та порушення толерантності до вуглеводів, ожиріння й куріння) [1]. Крім того, суттєвий негативний вплив на прогноз пацієнта з ГХ має субклінічне ураження органів-мішеней. Саме тому якість антигіпертензивної терапії сьогодні розглядається не тільки з позиції ефективного контролю АТ, а і з точки зору органопротекторних та метаболічних властивостей препаратів. Останнім часом усе більше уваги приділяється вивченню впливу антигіпертензивних препаратів на стан хронічного системного запалення, що зумовлено доведеним тісним зв’язком між субклінічним ураженням серця, судин і нирок з активацією запалення низької градації у хворих на ГХ [2, 3].
Блокатори рецепторів 1-го типу до ангіотензину ІІ (АТ1-рецептори) є одними з лідерів поміж п’яти класів антигіпертензивних препаратів першої лінії з точки зору органопротекції та позитивних метаболічних ефектів. Одним із найбільш вивчених представників цього класу є телмісартан. У дослідженнях ONTARGET і TRANSCEND переконливо продемонстровано поліпшення прогнозу пацієнтів високого ризику за рахунок зниження ризику серцево-судинних ускладнень під впливом телмісартану [4, 5]. У ряді досліджень (DETAIL, VIVALDI, INNOVATION та інші) доведено нефропротекторні властивості телмісартану у хворих на діабетичну хронічну хворобу нирок, проте недостатньо вивченим залишається його вплив на функцію нирок у пацієнтів із ГХ за відсутності цукрового діабету. Поліпшення вуглеводного обміну є класовим ефектом сартанів, проте, за даними метааналізу H. Takagi та співавт. (2012), телмісартан демонструє преваги над іншими представниками блокаторів АТ1-рецепторів до ангіотензину ІІ у зниженні натще рівня інсуліну та індексів чутливості до нього [6]. Маловивченим залишається його вплив на активність системного запалення низької градації, що, за результатами клінічних робіт, зменшується на тлі застосування лосартану, валсартану, кандесартану та олмесартану.
Метою нашого дослідження було оцінити вплив блокатора АТ1-рецепторів до ангіотензину ІІ телмісартану на стан вуглеводного й ліпідного обміну, активність системного запалення низької градації, структурні показники лівого шлуночка (ЛШ) та функціональний стан нирок у хворих на ГХ.
Матеріал і методи дослідження
У дослідження включено 30 хворих на ГХ І і ІІ стадії 1-го ступеня (25 осіб) та 2-го ступеня (5 осіб), середній вік яких становив 60,0 ± 2,0 року, серед них було 14 чоловіків, що становило 46,7 %. Переважна більшість пацієнтів, включених у дослідження, мала зайву вагу (14 осіб) і ожиріння (13 осіб), тільки у 3 пацієнток індекс маси тіла визначався в межах норми. До включення в дослідження переважна більшість пацієнтів (27 осіб) отримували антигіпертензивну терапію, проте лікування було неефективним.
Після 7-денного безмедикаментозного періоду пацієнтам призначали телмісартан («Хіпотел» виробництва компанії «Кусум Фарм», Україна) у дозі 40 мг/добу протягом 2 тижнів; якщо через 2 тижні лікування за даними офісних вимірювань АТ перебільшував 140/90 мм рт.ст., дозу телмісартану збільшували до 80 мг/добу. Лікування тривало від 4 до 6 міс., 13 пацієнтів приймали препарат протягом 4 міс., 17 хворих — протягом 6 міс.; контроль офісного АТ здійснювали через 2 тижні, 1 міс., 3 міс. та в кінці лікування (через 4–6 міс. монотерапії телмісартаном).
Для оцінки характеристик циркадного ритму АТ проводили амбулаторне добове моніторування АТ (ДМАТ) за допомогою монітора ABPM-04 (Meditech, Угорщина) згідно зі стандартним протоколом: вимірювання АТ кожні 15 хвилин у період денної активності (з 7.00 до 22.00) і кожні 30 хвилин під час нічного сну (з 22.00 до 7.00).
Імунотурбідиметричним методом визначали вміст високочутливого С-реактивного протеїну (СРП) в крові та вміст альбуміну в добовому зразку сечі. Концентрацію в плазмі крові глюкози визначали ферментативним пероксидазним методом, креатиніну — методом Яффе. Дослідження ліпідного профілю передбачало визначення вмісту в крові загального холестерину (ЗХС), тригліцеридів (ТГ), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) — ферментативним методом, холестерин ліпопротеїнів низької щільності (ХС ЛПНЩ) та холестерин ліпопротеїнів дуже низької щільності (ХС ЛПДНЩ) розраховували за формулою W. Friedwald. Всі біохімічні тести проводились на біохімічному автоматичному аналізаторі Biosystems A25 (Іспанія).
Вміст базального імунореактивного інсуліну визначали радіоімунним методом із використанням стандартних ІРМА-наборів (Immunotech, Чехія). Інсулінорезистентність оцінювали за індексом НОМА, який розраховували за формулою:
НОМА = [інсулін (мкОд/мл) х глюкоза (ммоль/л)] / 22,5 (ум.од.).
Функціональний стан нирок оцінювали за швидкістю клубочкової фільтрації (ШКФ), яку розраховували за формулою MDRD:
ШКФ = 186 х креатинін сироватки (мкмоль/л) – 1,154 х вік (роки) – 0,208 х 0,742 (для жінок) (мл/хв/1,73 м2).
Структурно-функціональні показники лівого шлуночка досліджували методом ехокардіографії в режимах М-сканування і секторального сканування на приладах Sonoline SL-1 (Siemens, Німеччина) та Sonoline-Omnia (Siemens, Німеччина) за загальноприйнятою методикою у 28 хворих на ГХ. Масу міокарда ЛШ (ММЛШ) розраховували за формулою Troy:
ММЛШ = 0,8 х {1,04 х ([ (КДР + ТЗС + + ТМШП)3 – КДР3]} + 0,6 (г).
Індекс ММЛШ (ІММЛШ) вираховували як відношення ММЛШ до площі поверхні тіла. Критеріями гіпертрофії ЛШ згідно з рекомендаціями Європейського товариства кардіологів із лікування артеріальної гіпертензії були показники ІММЛШ, що перевищували значення 95 та 115 г/м2 у чоловіків і жінок відповідно.
Лабораторні тести та інструментальні дослідження проводили після 7-денного безмедикаментозного періоду та через 4–6 міс. терапії телмісартаном.
Статистичну обробку результатів дослідження проводили за допомогою програми SPSS, версія 13. Всі змінні, що підлягали аналізу, підпорядковувались нормальному розподілу за результатом тесту Колмогорова — Смирнова для однієї вибірки. При порівняльному аналізі використовували t-критерій Стьюдента. Всі значення наведені у вигляді M ± m, де М — середнє арифметичне значення показника, m — стандартна помилка середньої величини. Різниця між сукупностями порівнюваних даних вважалася достовірною при р < 0,05.
Результати дослідження
Лікування телмісартаном протягом 2 тижнів сприяло нормалізації АТ в 11 пацієнтів (37 % від загальної кількості), через 1 міс. терапії на тлі збільшення дози препарату до 80 мг/добу частка ефективно лікованих хворих збільшилась до 62 % (19 осіб), а через 6 міс. їх кількість становила 22 особи. Протягом спостереження відмічали стабільний антигіпертензивний ефект телмісартану (рис. 1), про що свідчить зниження систолічного АТ (САТ) на 13,2 %, діастолічного АТ (ДАТ) на 12,9 % наприкінці лікувального періоду.
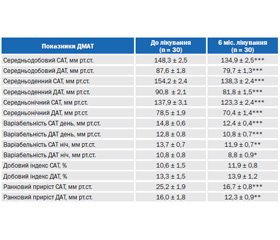
Результати амбулаторного ДМАТ підтверджують високу антигіпертензивну ефективність телмісартану. Через 6 міс. терапії зареєстровано достовірне зниження середньодобового систолічного та діастолічного АТ за рахунок дії препарату як у денний (на 10,3 %, p < 0,001), так і в нічний (на 10,7 %, p < 0,001) періоди (табл. 1). Телмісартан не впливав на нормальні показники добового індексу АТ, проте сприяв відновленню нормального двофазного ритму АТ у пацієнтів із його вихідним недостатнім зниженням уночі — non-dipper, кількість яких на початку дослідження становила 10 осіб. Трансформацію добового ритму у тип dipper через 6 міс. лікування відмічено у 5 пацієнтів цієї групи, при цьому добовий індекс САТ у середньому збільшився з 5,9 ± 0,9 % до 8,4 ± 0,8 % (p < 0,001), ДАТ — з 6,4 ± 1,5 % до 12,2 ± 2,4 % (p < 0,01). Під впливом лікування спостерігали вірогідне зменшення варіабельності АТ у денний і нічний період (табл. 1), а також зниження ранкового приросту САТ на 33,7 % (p < 0,001) та ДАТ — на 23,1 % (p < 0,01).
Аналіз стану вуглеводного метаболізму під впливом тривалої терапії телмісартаном засвідчив суттєве поліпшення його показників, а саме зменшення вмісту в сироватці крові імунореактивного інсуліну на 21,5 % (р = 0,001), що супроводжувалось достовірним зниженням рівня глюкози з 5,5 ± 0,2 ммоль/л до 5,2 ± 0,1 ммоль/л (р = 0,03) і HbA1с з 5,6 ± 0,1 % до 5,4 ± 0,1 % (р = 0,04). Позитивна динаміка з боку показників вуглеводного обміну зареєстрована переважно в пацієнтів із вихідною інсулінорезистентністю (n = 14), критерієм якої був показник НОМА ≥ 2,77 ум.од. У цій групі під впливом телмісартану відбулось суттєве поліпшення чутливості тканин до інсуліну, про що свідчили нормалізація індексу НОМА з 3,51 ± 0,20 ум.од. до 2,70 ± 0,20 ум.од. (р = 0,01), на тлі зменшення вмісту в крові інсуліну з 13,9 ± ± 0,1 мкОд/мл до 11,5 ± 1,1 мкОд/мл, глюкози з 5,6 ± 0,1 ммоль/л до 5,3 ± ±0,2 ммоль/л (р = 0,02).
За результатами аналізу динаміки показників ліпідного метаболізму встановлено, що терапія телмісартаном призвела до зниження рівня тригліцеридів із 1,58 ± 0,10 ммоль/л до 1,31 ± 0,10 ммоль/л (р = 0,03), з боку ЗХС спостерігалась тенденція до зменшення його вмісту в крові переважно за рахунок зниження рівня ХС ЛПНЩ (табл. 2).
Телмісартан продемонстрував здатність знижувати активність запалення низької градації, що сьогодні визнається однією з характерних рис ГХ. Переважна більшість включених у дослідження хворих, а саме 21 особа, мали ознаки активації хронічного запалення (критерій — вміст у крові СРП > 3 мг/л). Під впливом лікування спостерігали вірогідне зменшення вмісту маркерів запалення: СРП — на 12,8 % (р = 0,04) та фібриногену — на 12,9 % (р = 0,006) (табл. 2).
Висока антигіпертензивна ефективність телмісартану — досягнення цільового АТ у 73 % хворих із м’якою та помірною ГХ, а також сприятливі метаболічні ефекти цього сартану створили передумови для поліпшення структурних показників серця та функціонального стану нирок в обстежених пацієнтів. При первинному обстеженні нормальна геометрія ЛШ спостерігалась у 9 пацієнтів, концентричне ремоделювання ЛШ — у 4 хворих, ГЛШ було діагностовано в 16 осіб. Через 6 міс. терапії телмісартаном кількість пацієнтів із ГЛШ зменшилась до 9, в інших 19 хворих ІММЛШ та відносна товщина стінки ЛШ перебували в межах нормальних значень (табл. 3). У середньому по групі ІММЛШ знизився на 12,9 % (р = 0,001) за рахунок зменшення товщини стінок ЛШ. Розміри порожнини лівого передсердя та ЛШ, а також показник систолічної функції ЛШ протягом лікування залишились незмінними (табл. 3). Найбільш виражену динаміку ІММЛШ спостерігали в пацієнтів із вихідною ГЛШ, у яких він на початку лікування становив 127,5 ± 5,6 г/м2, а наприкінці — 107,6 ± 4,3 г/м2 (р < 0,001), а товщина задньої стінки ЛШ та товщина міжшлуночкової перегородки (ТМШП) зменшились відповідно з 1,12 ± 0,02 см до 0,98 ± 0,03 см (р < 0,001) та з 1,21 ± 0,04 см до 1,03 ± 0,04 см (р < 0,001).
Поряд із поліпшенням структурних характеристик серця під впливом телмісартану відмітили також його позитивний вплив на функціональний стан нирок (табл. 3), що проявилось переважно в пацієнтів із вихідним зниженням ШКФ менше 60 мл/хв/1,73 м2. У цій групі налічувалось 9 хворих, і в них уміст креатиніну в крові зменшився з 100,3 ± 4,4 мкмоль/л до 85,5 ± 4,1 мкмоль/л (р = 0,01), що супроводжувалось зростанням ШКФ із 53,7 ± 1,8 мл/хв/1,73 м2 до 65,4 ± 4,4 мл/хв/1,73 м2 (р = 0,02) та зменшенням екскреції альбуміну з сечею на 40 % — з 18,2 ± 4,8 мг/л до 10,9 ± 2,6 мг/л (р = 0,002).
У пацієнтів із нормальною вихідною ШКФ рівень креатинінемії демонстрував тенденцію до зниження — з 86,8 ± 3,9 до 81,1 ± 3,1 (р > 0,05), та це достовірно не позначилось на величині ШКФ (до лікування 73,8 ± 2,2 мл/хв/1,73 м2 та 78,1 ± 2,2 мл/хв/1,73 м2, р > 0,05). Проте в цій групі, як і у хворих зі зниженою функцією нирок, спостерігалася значна регресія рівня альбуміну в сечі — з 20,1 ± 2,2 мг/л до 13,3 ± 1,4 мг/л (p < 0,001).
У нашому дослідженні препарат продемонстрував хороший профіль переносимості. Побічні явища у вигляді головного болю та приливу жару до обличчя на 7-й день прийому препарату зафіксовано в одної пацієнтки, вони мали транзиторний характер і не призвели до відміни терапії.
Обговорення
Результати нашого дослідження засвідчили високу антигіпертензивну ефективність телмісартану: у 73 % пацієнтів удалось досягти цільового рівня АТ при застосуванні монотерапії, при цьому слід зазначити, що у 37 % хворих нормалізація АТ відбулась уже через 2 тижні лікування. Аналогічна ефективність контролю АТ на тлі застосування телмісартану (69–81 %) прослідковується і в інших клінічних дослідженнях. Так, за результатами об’єднаного аналізу рандомізованих досліджень PRISMA I та PRISMA II ефективне зниження офісного САТ було зафіксовано в 76,2 % хворих, ДАТ — у 69,1 % через 14 тижнів монотерапії телмісартаном у дозі 80 мг [7]. У цьому ж дослідженні переконливо продемонстрована здатність телмісартану надійно контролювати АТ протягом доби, що зумовлено тривалим періодом напіввиведення цього сартану, який становить 20–24 години. Наші дані також указують на ефективний контроль АТ у денні та нічні години та корегуючий вплив телмісартану на порушений добовий ритм АТ: у половини пацієнтів із вихідним типом non-dipper відбулась його трансформація в нормальний двофазний ритм АТ. Крім того, телмісартан сприяв суттєвому зниженню варіабельності АТ та надійному його контролю в ранкові години. Такі властивості телмісартану надають йому додаткових переваг з огляду на прогностичну значимість показників циркадного ритму АТ. Відомо, що порушення нормальної фазності добового ритму, підвищення варіабельності АТ та надмірний ранковий приріст АТ сприяють формуванню та прогресуванню ураження органів-мішеней та підвищують ризик серцево-судинних ускладнень у хворих на ГХ [8, 9].
Враховуючи тісний зв’язок між порушенням вуглеводного та ліпідного обміну, з одного боку, та субклінічним і клінічно маніфестованим гіпертензивним ураженням органів-мішеней — з іншого, позитивні метаболічні властивості антигіпертензивних препаратів можуть сприятливо впливати на перебіг ГХ. У нашій роботі показано підвищення чутливості тканин до інсуліну та зниження рівнів глюкози натще і HbA1c під впливом тривалої терапії телмісартаном. Подібний інсулінсенситизуючий ефект телмісартану продемонстровано в експериментальних та клінічних роботах [10, 11]. Переконливі дані отримано в метааналізі рандомізованих контрольованих досліджень при метаболічному синдромі, що включив 10 досліджень (546 пацієнтів), у 7 з яких телмісартан порівнювався з іншими сартанами, у 2 — із плацебо та в 1 — з амлодипіном. Було встановлено, що терапія телмісартаном має переваги над препаратами порівняння у зниженні рівня глікемії натще, HbA1c, індексу інсулінорезистентності НОМА та в підвищенні вмісту адипонектину в крові [12]. Виражений позитивний вплив телмісартану на вуглеводний метаболізм пов’язують із його унікальними властивостями до активації PPAR-гамма-рецепторів, що відіграють важливу роль у регуляції вуглеводного та ліпідного метаболізму шляхом модуляції ядерних факторів транскрипції генів, відповідальних за ці процеси [10]. Саме тому, окрім підвищення чутливості тканини до інсуліну, телмісартан здатен також поліпшувати й показники ліпідного обміну. У нашому дослідженні це проявлялось зменшенням вмісту в крові тригліцеридів, хоча в інших клінічних роботах спостерігалась позитивна динаміка з боку ЗХС, ХС ЛПНЩ та ХС ЛПВЩ [11, 13].
Крім того, отримані нами дані свідчать на користь зниження активності системного запалення під впливом телмісартану, що проявлялось зменшенням вмісту в крові хворих на ГХ маркерів запалення — СРП та фібриногену. Протизапальні властивості цього сартану раніше були показані в пацієнтів із гострим коронарним синдромом та з цукровим діабетом [14, 15]. Активація запалення низької градації робить негативний внесок у прогресування ГХ та сприяє розвитку атеротромботичних ускладнень (інфаркт міокарда, мозковий інсульт) [16], тому пригнічення цієї активності поряд зі зменшенням проявів дисліпідемії та інсулінорезистентності, ймовірно, матиме сприятливе прогностичне значення для хворих на ГХ.
Ефективна антигіпертензивна терапія телмісартаном протягом 6 міс. супроводжувалась регресом ГЛШ — зменшення ІММЛШ у середньому становило 12,9 %, що подібно до результатів інших клінічних робіт, у яких встановлено кардіопротекторні властивості телмісартану [17, 18]. У масштабних рандомізованих дослідженнях ONTARGET і TRANSCEND доведено здатність телмісартану не тільки викликати зворотний розвиток ГЛШ, а й запобігати її формуванню в пацієнтів високого серцево-судинного ризику [19].
Нефропротекторні властивості телмісартану досконало вивчені у хворих із діабетичною нефропатією в ряді масштабних рандомізованих досліджень — INNOVATION, DETAIL, AMADEO, VIVALDI [20–23]. Уповільнення прогресування хронічної хвороби нирок під впливом телмісартану продемонстровано в дослідженні ONTARGET у пацієнтів високого серцево-судинного ризику, проте поміж них тільки 69 % мали артеріальну гіпертензію, а цукровий діабет — близько 38 % [24]. Лише в одному дослідженні (ARAMIS) було показано антипротеїнуричну дію телмісартану в пацієнтів з ізольованою систолічною гіпертензію без цукрового діабету [25]. Застосування телмісартану протягом 6 міс. в обстежених нами хворих на ГХ сприяло поліпшенню функціонального стану нирок, що проявлялось зростанням ШКФ та суттєвим регресом мікроальбумінурії.
Органопротекторні властивості телмісартану перш за все зумовлені ефективною блокадою АТ1-рецепторів до ангіотензину ІІ, що суттєво зменшує його вазоконстрикторну та проліферативну дію на міокард, судинну стінку та нирки. Крім того, зменшення тканинних ефектів ангіотензину ІІ супроводжується зменшенням інтенсивності оксидативного стресу, поліпшенням ендотеліальної функції та пригніченням активності системного запалення, що мають вирішальне патогенетичне значення для розвитку та прогресування атеросклерозу. Всі ці ефекти в сукупності з вираженими позитивними метаболічними властивостями телмісартану, ймовірно, запобігають ураженню органів-мішеней та сприяють зниженню ризику серцево-судинних катастроф у хворих на ГХ.
1. Рекомендації Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії / Є.П. Свіщенко, А.Е. Багрій, Л.М. Єна [та ін.]. — Київ, 2012. — 69 с.
2. Міщенко Л.А. Предиктори прогресування гіпертрофії лівого шлуночка у хворих на гіпертонічну хворобу / Л.А. Міщенко // Український кардіологічний журнал. — 2012. — № 3. — С. 15–21.
3. C–reactive protein and target organ damage in patients with primary hypertension / E. Ratto, G. Leoncini, F. Viazzi [et al.] // Am. J. Kidney Dis. — 2010. — Vol. 55 — P. 1050–1059.
4. Telmisartan, Ramipril, or both for patients of high risk of vascular events / S. Yusuf, P. Sleight, C. Anderson [et al.] // New Engl. J. Med. — 2008. — Vol. 358. — P. 1547–1559.
5. Effects of the angiotensin-receptor blocker telmisartan on cardiovascular events in high-risk patients intolerant to angiotensin-converting enzyme inhibitors: a randomised controlled trial / S. Yusuf, K. Teo, C. Anderson [et al.]; for Telmisartan Randomised AssessmeNt Study in aCE iNtolerant subjects with cardiovascular Disease (TRANSCEND) Investigators // Lancet. — 2008. — Vol. 372. — P. 1174–1183.
6. Takagi H. Telmisartan improves insulin sensitivity: A meta-analisys of randomized head-to-head trials / H. Takagi, T. Umemoto // Int. J. Cardi–ol. — 2012. — Vol. 156. — P. 92–96.
7. Antihypertensive efficacy of telmisartan vs ramipril over the 24-h dosing period, including the critical early morning hours: a pooled analysis of the PRISMA I and II randomized trials / B. Williams, Y. Lacourcie’re, H. Schumacher [et al.] // J. Hum. Hypertens. — 2009. — Vol. 23. — P. 610–619.
8. Morning surge in blood pressure as a predictor of silent and clinical cerebrovascular disease in elderly hypertensives: a prospective study / K. Kario, T.G. Pickering, Y. Umeda [et al.] // Circulation. — 2003. — Vol. 107. — P. 1401–1406.
9. Kario K. Morning surge and variability in blood pressure: a new therapeutic target? // Hypertension. — 2005. — Vol. 45. — P. 485–486.
10. Identification of telmisartan as an unique angiotensin II receptor antagonist with selective PPAR-gamma-modulating activity / S.C. Benson, H.A. Pershadsingh, C.I. Ho [et al.] // Hypertension. — 2004. — Vol. 43. — P. 993–1002.
11. Effects of telmisartan on hypertensive patients with dyslipidemia and insulin resistance / D. Xu, J. Liu, C. Ji [et al.] // J. Geriatr. Cardiol. — 2007. — Vol. 4. — P. 149–152.
12. Telmisartan as a metabolic sartan: the first meta-analisys of randomized control trials in metabolic syndrome / H. Takagi, M. Niva, Y. Mizuno [et al.] // J. Am. Society of hypertens. — 2013. — Vol. 7. — P. 229–235.
13. Vanitha M. Effect of telmisartan on serum lipid profile in patients with hypertension and dyslipidemia / M. Vanitha, K. Vijayal // Int. J. Med. Res. Health Sci. — 2013. — Vol. 2. — P. 745–749.
14. Comparison of the effects of ramipril versus telmisartan on high-sensitivity C-reactive protein and endothelial progenitor cells after acute coronary syndrome / I. Porto, L. Di Vito, G.L. De Maria [et al.] // Am. J. Cardiol. — 2009. — Vol. 103. — P. 1500–1505.
15. Comparison of the effects of ramipril versus telmisartan in reducing serum levels of high-sensitivity C-reactive protein and oxidized low-density lipoprotein cholesterol in patients with type 2 diabetes mellitus / S. Koulouris, P. Symeonides, K. Triantafyllou [et al.] // Am. J. Cardiol. — 2005. — Vol. 95. — P. 1386–1388.
16. Emerging Risk Factors Collaboration. C-reactive protein concentration and risk of coronary heart disease, stroke, and mortality: an individual participant meta-analysis / Emerging Risk Factors Collaboration, S. Kaptoge, E. Di Angelantonio, G. Lowe // Lancet. — 2010. — Vol. 375. — P. 132–40.
17. Freehand three-dimensional echocardiographic evaluation of the effect of telmisartan compared with hydrochlorothiazide on left ventricular mass in hypertensive patients with mild-to-moderate hypertension: a multicentre study / D. Galzerano, P. Tammaro, A. Cerciell [et al.] // J. Hum. Hypertens. — 2004. — Vol. 18. — P. 53–59.
18. Three-dimensional echocardiographic and magnetic resonance assessment of the effect of telmisartan compared with carvedilol on left ventricular mass a multicenter, randomized, longitudinal study / D. Galzerano, P. Tammaro, L. del Viscovo [et al.] // Am. J. Hypertens. — 2005. — Vol. 18. — P. 1563–1569.
19. Effects of telmisartan, ramipril, and their combination on left ventricular hypertrophy in individuals at high vascular risk in the ongoing telmisartan alone and in combination with ramipril global end point trial and the telmisartan randomized assessment study in ACE intolerant subjects with cardiovascular disease / P. Verdecchia, P. Sleight, G. Mancia [et al.]; for ONTARGET/TRANSCEND Investigators // Circulation. — 2009. — Vol. 120. — P. 1380–1389.
20. Prevention of transition from incipient to overt nephropathy with telmisartan in patients with type 2 diabetes / H. Makino, M. Haneda, T. Babazono [et al.]; for INNOVATION Study Group // Diabetes Care. — 2007. — Vol. 30. — P. 1577–1578.
21. Angiotensin–receptor blockade versus converting-enzyme inhibition in type 2 diabetes and nephropathy / A.H. Barnett, S.C. Bain, P. Bouter [et al.]; for Diabetics Exposed to Telmisartan and Enalapril Study Group // N. Engl. J. Med. — 2004. — Vol. 351. — P. 1952–1961.
22. Telmisartan is more effective than losartan in reducing proteinuria in patients with diabetic nephropathy / G. Bakris, E. Burgess, M. Weir [et al.]; for AMADEO Study Investigators // Kidney Int. — 2008. — Vol. 74. — P. 364–369.
23. Antiproteinuric effects of angiotensin receptor blockers: telmisartan versus valsartan in hypertensive patients with type 2 diabetes mellitus and overt nephropathy / J. Galle, E. Schwedhelm, S. Pinnetti [et al.]; for VIVALDI investigators // Nephrol. Dial. Transplant. — 2008. — Vol. 23. — P. 3174–3183.
24. Renal outcomes with telmisartan, ramipril, or both, in people at high vascular risk (the ONTARGET study): a multicentre, randomised, double–blind, controlled trial / J.F. Mann, R.E. Schmieder, M. McQueen [et al.]; for ONTARGET investigators // Lancet. — 2008. — Vol. 372. — P. 547–553.
25. The angiotensin II receptor antagonist telmisartan reduces urinary albumin excretion in patients with isolated systolic hypertension: results of a randomized, double-blind, placebo-controlled trial / L. Vogt, G. Navis, J. Koster [et al.] for Angiotensin II Receptor Antagonist telmisartan Micardis in Isolated Systolic hypertension (ARAMIS) study group // J. Hypertens. — 2005. — Vol. 23. — P. 2055–2061.

/10_m/10_m.jpg)
/10_m/10_m2.jpg)
/12_m/12_m.jpg)