Журнал «Травма» Том 16, №1, 2015
Вернуться к номеру
Зв’язок між структурно-функціональним станом кісткової тканини та частотою низькоенергетичних переломів у жінок у постменопаузальному періоді
Авторы: Поворознюк В.В., Орлик Т.В., Дзерович Н.І. - ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова» НАМН України», м. Київ; Український науково-медичний центр проблем остеопорозу, м. Київ
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Втрата кісткової тканини при остеопорозі відбувається непомітно, тому захворювання часто виявляється вже після розвитку перелому. Частота переломів збільшується з віком як у жінок, так і в чоловіків. Остеопороз і пов’язані з ним переломи ведуть до збільшення показників захворюваності, інвалідності, знижують якість життя і призводять до збільшення смертності.
Золотим стандартом діагностики остеопорозу на сьогодні залишається двохенергетична рентгенівська абсорбціометрія (ДРА). За даними ДРА, основною кількісною характеристикою структурно-функціонального стану кісткової тканини є показник мінеральної щільності (МЩКТ), основною якісною — показник якості трабекулярної кісткової тканини (TBS). Відомо, що з віком обидва показники зменшуються і погіршується стан кісткової тканини.
Мета — вивчити частоту низькоенергетичних переломів у жінок у постменопаузальному періоді залежно від структурно-функціонального стану кісткової тканини.
Об’єкт дослідження. Обстежено 1369 жінок у постменопаузальному періоді віком 45–89 років (середній вік — 62,5 [55,0; 73,0] року, середній ІМТ — 28,6 ± 6,5 кг/м2, середня тривалість постменопаузального періоду — 14,5 ± 9,5 року). Обстежені пацієнтки були розподілені на групи залежно від показників МЩКТ відповідно до критеріїв ВООЗ: норма (Т-критерій > (–1,0) SD; n = 563), остеопенія (≤ (–1,0) Т-критерій > (–2,5) SD; n = 498), остеопороз (Т-критерій ≤ (–2,5) SD; n = 308); а також за показником TBS (TBS L1-L4) на квартилі (групи): Q-І — найнижчий квартиль (TBS = 0,362–1,077; n = 152); Q-ІІ — нижній квартиль (TBS = 1,078–1,203; n = 156); Q-ІІІ — верхній квартиль (TBS = 1,204–1,321; n = 148); Q-ІV — найвищий квартиль (TBS = 1,322–1,793; n = 133).
Методи дослідження. Наявність, локалізацію, механізм та термін виникнення переломів вивчали за допомогою спеціалізованої карти Українського науково-медичного центру проблем остеопорозу.
Мінеральну щільність та якість трабекулярної кісткової тканини визначали на рівні поперекового відділу хребта (L1-L4) з використанням двохенергетичного рентгенівського денситометра Prodigy (GE Medical systems, Lunar, model 8743, 2005). Показник якості трабекулярної кісткової тканини визначали з використанням програмного забезпечення TBS Insight (Med-Imaps, Бордо, Франція, 2006).
Результати дослідження. У всіх групах жінок залежно від показників МЩКТ зустрічаються низькоенергетичні переломи, у тому числі у хворих з остеопорозом — 45,5 % (140) випадків, з остеопенією — 26,9 % (134) та при нормальних показниках МЩКТ 18,1 % (102) жінок мають переломи. Найбільша частота низькоенергетичних переломів спостерігається у хворих з остеопорозом (46,5 %), причому за рахунок осіб із вертебральними переломами та переломами комбінованої локалізації. Частка пацієнтів з остеопорозом серед осіб із невертебральними переломами становить 25,5 %.
50,8 % вертебральних, 43,7 % невертебральних та 32,8 % переломів комбінованої локалізації розвиваються на тлі низької якості трабекулярної кісткової тканини.
Наявність вертебральних переломів у жінок у постменопаузальному періоді вірогідно збільшує ризик болю у грудному відділі в 1,32 раза.
Висновок. Розвиток низькоенергетичних переломів частково пов’язаний із показниками мінеральної щільності та якості трабекулярної кісткової тканини.
Потеря костной ткани при остеопорозе происходит незаметно, поэтому заболевание часто выявляется уже после развития перелома. Частота переломов увеличивается с возрастом как у женщин, так и у мужчин. Остеопороз и связанные с ним переломы ведут к увеличению показателей заболеваемости, инвалидности, снижают качество жизни и приводят к увеличению смертности.
Золотым стандартом диагностики остеопороза на сегодняшний день остается двухэнергетическая рентгеновская абсорбциометрия (ДРА). По данным ДРА, основной количественной характеристикой структурно-функционального состояния костной ткани является показатель минеральной плотности (МПКТ), основной качественной — показатель качества трабекулярной костной ткани (TBS). Известно, что с возрастом оба показателя уменьшаются и ухудшается состояние костной ткани.
Цель — изучить частоту низкоэнергетических переломов у женщин в постменопаузальном периоде в зависимости от структурно-функционального состояния костной ткани.
Объект исследования. Обследовано 1369 женщин в постменопаузальном периоде в возрасте 45–89 лет (средний возраст — 62,5 [55,0; 73,0] года, средний ИМТ — 28,6 ± 6,5 кг/м2, средняя продолжительность постменопаузального периода — 14,5 ± 9,5 года). Обследованные пациентки были разделены на группы в зависимости от показателей МПКТ в соответствии с критериями ВОЗ: норма (Т-критерий > (–1,0) SD; n = 563), остеопения (≤ (–1,0) Т-критерий > (–2,5) SD; n = 498), остеопороз (Т-критерий ≤ (–2,5) SD; n = 308); а также по показателю TBS (TBS L1-L4) на квартили (группы): Q-І — самый низкий квартиль (TBS = 0,362–1,077; n = 152); Q-II — нижний квартиль (TBS = 1,078–1,203; n = 156); Q-III — верхний квартиль (TBS = 1,204–1,321; n = 148); Q-IV — самый высокий квартиль (TBS = 1,322–1,793; n = 133).
Методы исследования. Наличие, локализацию, механизм и сроки возникновения переломов изучали с помощью специализированной карты Украинского научно-медицинского центра проблем остеопороза.
Минеральную плотность и качество трабекулярной костной ткани определяли на уровне поясничного отдела позвоночника (L1-L4) с использованием двухэнергетического рентгеновского денситометра Prodigy (GE Medical systems, Lunar, model 8743, 2005). Показатель качества трабекулярной костной ткани определяли с использованием программного обеспечения TBS Insight (Med-Imaps, Бордо, Франция, 2006).
Результаты исследования. Во всех группах женщин в зависимости от показателей МПКТ встречаются низкоэнергетические переломы, в том числе у больных с остеопорозом — 45,5 % (140) случаев, с остеопенией — 26,9 % (134) и при нормальных показателях МПКТ — у 18,1 % (102) женщин встречаются переломы. Наибольшая частота низкоэнергетических переломов наблюдается у больных с остеопорозом (46,5 %), причем за счет лиц с вертебральными переломами и переломами комбинированной локализации. Доля пациентов с остеопорозом среди лиц с невертебральными переломами составляет всего 25,5 %.
50,8 % вертебральных, 43,7 % невертебральных и 32,8 % переломов комбинированной локализации (вертебральные и невертебральные) развиваются на фоне низкого качества трабекулярной костной ткани.
Наличие вертебральных переломов у женщин в постменопаузальном периоде достоверно увеличивает риск боли в грудном отделе в 1,32 раза.
Вывод. Развитие низкоэнергетических переломов частично связано с показателями минеральной плотности и качества трабекулярной костной ткани.
Bone loss in osteoporosis is inconspicuous, so the disease often manifests itself after the fracture. Fracture incidence increases with age in both women and men. Osteoporosis and related fractures lead to an increase in morbidity, disability, reduce quality of life and result in increased mortality.
Today gold standard in diagnosis of osteoporosis is dual energy X-ray absorptiometry (DXA). According to the DXA main quantitative characteristic of the structural and functional state of the bone tissue is bone mineral density (BMD), the main quality parameter — trabecular bone score (TBS). It is known that both parameters are reduced with age, which worsens the bone health.
The objective — to study the incidence of low-energy fractures in postmenopausal women, depending on the structural and functional state of bone.
Subject of the Study. 1369 postmenopausal women aged 45–89 years (mean age — 62.5 [55.0; 73.0] years, mean body mass index — 28.6 ± ± 6.5 kg/m2, average duration of postmenopausal period — 14.5 ± 9.5 years) were examined. Surveyed patients were divided into groups depending on BMD in accordance with the WHO criteria: normal (T-score > (– 1.0) SD; n = 563), osteopenia (≤ (1.0) T-test > (–2.5) SD; n = 498), osteoporosis (T-score ≤ (–2.5) SD; n = 308), and also depending on TBS (TBS L1-L4) into quartiles (groups): Q-I — the lowest quartile (TBS = 0.362–1.077; n = 152); Q-II — the lower quartile (TBS = 1.078–1.203; n = 156); Q-III — the higher quartile (TBS = 1.204–1.321; n = 148); Q-IV — the highest quartile (TBS = 1.322–1.793; n = 133).
Methods of the Study. The presence, location, mechanism and timing of fracture were examined using a specialized card of Ukrainian scientific and medical center of osteoporosis problems.
BMD and TBS were determined at lumbar spine (L1-L4) using Prodigy dual-energy X-ray densitometer (GE Medical systems, Lunar, model 8743, 2005). Trabecular bone score was evaluated by means of TBS Insight software (Med-Imap, Bordeaux, France, 2006).
Results of the Study. In all groups of women, depending on BMD parameters, low energy fractures are being detected, including patients with osteoporosis — 45.5 % (140) of cases, with osteopenia — 26.9 % (134), and 18.1 % (102) of women with normal values of BMD have fractures. The highest incidence of low-energy fractures is observed in patients with osteoporosis (46.5 %), and, predominantly, in persons with vertebral fractures and fractures with combined localization. The part of patients with osteoporosis among persons with non-vertebral fractures is only 25.5 %.
50.8 % of vertebral, 43.7 % of nonvertebral and 32.8 % of fractures with combined localization occur on the background of low trabecular bone score.
The presence of vertebral fractures significantly increases the risk of thoracic pain — by 1.32 times.
Conclusion. The presence of low-energy fractures is partially due to the parameters of bone mineral density and trabecular bone quality.
Статья опубликована на с. 54-59
Актуальність
Остеопороз (ОП) став однією з основних проблем охорони здоров’я майже у всіх промислово розвинених країнах [1, 5]. Щороку очікується до 9 мільйонів нових переломів, обумовлених остеопорозом [5]. Рівень смертності, пов’язаної з переломами стегна та хребта, може перевищити 20 % [5]. У США остеопороз уражає від 4 до 6 млн жінок у постменопаузі [13], серед них щорічно реєструється близько 2 млн переломів. Приблизно 10 % жінок у 50-річному віці вже мають принаймні один остеопоротичний перелом [2]. У Канаді остеопороз розвивається в кожної четвертої жінки віком понад 50 років [13]. Інші дослідники повідомляють про високий ризик розвитку остеопорозу й у чоловіків [5]. З огляду на постійне збільшення тривалості життя як чоловіків, так і жінок, ці цифри, згідно з прогнозами, подвояться протягом наступних 40–50 років [10].
Мінеральна щільність кісткової тканини (МЩКТ), виміряна методом двохенергетичної рентгенівської абсорбціометрії (ДРА), — еталон діагностики остеопорозу за відсутності встановлених низькоенергетичних переломів [5]. МЩКТ є одним з основних факторів, що визначають міцність кістки і ризик переломів [11], але існує значне перекриття значень МЩКТ серед осіб, які мають переломи, та тих, які не мають [7]. Серед інших факторів, що впливають на міцність кісток і ризик переломів, можна назвати такі, як макрогеометрія кортикальної та мікроархітектура губчастої кістки, наявність мікроушкоджень, мінералізація кісткового матриксу та швидкість ремоделювання [14, 19]. Протягом останніх років було розроблено ряд методів оцінки кісткової мікроархітектури. Серед неінвазивних методів значного вдосконалення технології візуалізації набули кількісна (периферична) комп’ютерна томографія та магнітно-резонансна томографія, що дає можливість прямого вимірювання кісткової мікроархітектури [2]. Тим не менше обидва методи залишаються непрактичними для рутинного скринінгу та контролю лікування [9].
Оцінка якості трабекулярної кісткової тканини (TBS, безрозмірна величина) — це новий метод виміру мікротекстури, що може бути застосований до будь-яких рентгенівських зображень, включаючи ДРА, шляхом кількісної оцінки локальних змін «відтінків сірого» [7, 17]. Для визначення TBS використали експериментальну варіограму 2D-проекційних зображень із метою розрізнення 3D-мікроархітектури, яка має однакові значення МЩКТ, але різні характеристики трабекулярної кісткової тканини [7, 17]. Були виявлені значимі кореляції між TBS і 3D-параметрами кісткової мікроархітектури у трупів. Найбільший зв’язок був між TBS і щільністю з’єднання, що пояснювало 67,2 % дисперсії. На підставі багатофакторного регресійного аналізу була створена модель інтерпретації зв’язку між TBS і 3D-параметрами кісткової мікроархітектури. Більш високі значення TBS відображали кращі характеристики міцності кістки, тоді як низькі вказували на слабкість кісткової тканини та схильність до переломів [7, 17]. TBS може визначатися ретроспективно на основі тих зображень ДРА, що зроблені попередньо, без необхідності будь-яких додаткових досліджень. Крім того, показник може порівнюватися з МЩКТ, оскільки визначає стан кісткової тканини у тому ж регіоні кістки. Проведено ряд досліджень щодо інформативності одночасного використання TBS та МЩКТ [14, 18, 19]. Доведено, що в жінок у постменопаузальному періоді, які мали переломи в анамнезі, значення показника менше порівняно з особами відповідного віку без переломів [18].
Мета — вивчити частоту низькоенергетичних переломів у жінок у постменопаузальному періоді залежно від структурно-функціонального стану кісткової тканини.
Об’єкт дослідження
Обстежено 1369 жінок у постменопаузальному періоді віком 45–89 років (середній вік — 62,5 [55,0; 73,0] року, середній ІМТ — 28,6 ± 6,5 кг/м2, середня тривалість постменопаузального періоду — 14,5 ± 9,5 року). У дослідження не включалися особи з тяжкою супутньою патологією, високоенергетичними переломами чи травмами в анамнезі, високим рівнем фізичного навантаження, вторинним остеопорозом або станами, що могли би вплинути на структурно-функціональний стан кісткової тканини, розвиток її порушень (захворювання сполучної тканини, злоякісні новоутворення в анамнезі, прийом глюкокортикоїдів, зловживання алкоголем та ін.), клінічно маніфестованими вертебральними переломами з тривалістю постпереломного періоду менше 6 місяців та інтенсивністю болю у спині 9–10 балів за візуально-аналоговою шкалою (ВАШ) із будь-якої причини.
Обстежені пацієнтки були розподілені на групи у два етапи згідно з метою дослідження. На І етапі — залежно від показників МЩКТ відповідно до критеріїв ВООЗ: норма (Т-критерій > (–1,0) SD), остеопенія (ОПн) (≤ (–1,0) Т-критерій > (–2,5) SD), остеопороз (Т-критерій ≤ (–2,5) SD). Обстежених жінок було розподілено на групи: ОП — 308 пацієнток з остеопорозом, ОПн — 498 пацієнток з остеопенією; норма — 563 пацієнтки з показниками МЩКТ у межах норми.
На ІІ етапі — залежно від TBS. Показник TBS на сьогодні не має нормативних значень. На сучасному етапі в різних країнах, у тому числі і в Україні, тільки проводяться дослідження щодо визначення його референтних показників [1]. Нормативі значення TBS, як і для показника МЩКТ, мають бути специфічними для окремих географічних територій та етнічних груп. З огляду на це в даному розділі був використаний статистичний підхід, що застосовується у випадках ненормованих кількісних значень, а саме квартильний розподіл груп.
Обстежених жінок було розподілено на групи (квартилі) за показником TBS (TBS L1-L4): Q-І — найнижчий квартиль (TBS = 0,362–1,077; n = 152); Q-ІІ — нижній квартиль (TBS = 1,078–1,203; n = 156); Q-ІІІ — верхній квартиль (TBS = 1,204–1,321; n = 148); Q-ІV — найвищий квартиль (TBS = 1,322–1,793; n = 133).
Методи дослідження
Наявність, локалізацію, механізм та термін виникнення переломів визначали за допомогою спеціалізованої карти перенесених травм та переломів, прийнятої стандартами обстеження в Українському науково-медичному центрі проблем остеопорозу. Наявність та інтенсивність больового синдрому у грудному та поперековому відділах хребта оцінювали за допомогою візуально-аналогової шкали у балах від 0 до 10, яка також входить до складу спеціалізованої карти пацієнта центру.
Мінеральну щільність та якість трабекулярної кісткової тканини визначали на рівні поперекового відділу хребта (L1-L4) з використанням двохенергетичного рентгенівського денситометра Prodigy (GE Medical systems, Lunar, model 8743, 2005). Показник якості трабекулярної кісткової тканини визначали з використанням програмного забезпечення TBS Insight (Med-Imaps, Бордо, Франція, 2006).
Статистичний аналіз проводили з використанням пакетів програм Statistiсa 6.0 Copyright© StatSoft, Inc. 1984–2001, Serial number 31415926535897. Вивчали відносні та абсолютні частоти методом таблиць спорідненості. Відносний ризик (ВР) обчислювали на основі таблиць кростабуляції за формулою: ВР = (а/А) / (с/В), визначали довірчий інтервал (ДІ 95 %). Для оцінки зв’язків між змінними використовували кореляційний аналіз Спірмена (R). Критичним рівнем значущості при перевірці статистичних гіпотез вважали р < 0,05.
Результати дослідження
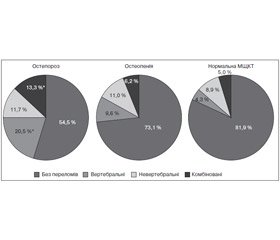
Встановлено, що в усіх групах жінок незалежно від показників МЩКТ зустрічаються низькоенергетичні переломи: з ОП — у 45,5 % (140) випадків, з ОПн — 26,9 % (134) та 18,1 % (102) жінок із нормальними показниками мають переломи. Причому частота невертебральних переломів вірогідно не відрізнялася в жінок з ОП (11,7 % (36)), ОПн (11,0 % (55)) та нормальною МЩКТ (9,8 % (50)). Вірогідні відмінності (x2 = 95,66, р < 0,0001) спостерігалися за рахунок вертебральних переломів (ОП — 20,5 % (63), ОПн — 9,6 % (48) та норма — 4,3 % (24) жінок мали переломи) та комбінованої локалізації (ОП — 13,3 % (41), ОПн — 6,2 % (31) та норма — 5,0 % (28) жінок мали переломи). Частота переломів комбінованої локалізації (вертебральних та невертебральних) у групах із показниками МЩКТ, що відповідають ОПн та нормі, вірогідно не відрізнялася (рис. 1).
Серед 135 обстежених хворих із вертебральними переломами частка пацієнтів з ОП (46,6 % (63)) була вірогідно більшою порівняно з особами з нормальною МЩКТ (р = 0,02). Крім того, 53,4 % жінок, які мали вертебральні переломи, мали МЩКТ у межах норми (17,8 % (24)) та ОПн (35,6 % (48)).
Серед жінок, які мали невертебральні переломи (141 особа), пацієнтки з ОП становили тільки четверту частину (25,5 % (36)) від загальної кількості обстежених (з ОПн — 39,0 % (55) та з нормальною МЩКТ — 35,5 % (50)).
Частка хворих з ОП, які мали переломи комбінованої локалізації, становила 41,0 % (41) та вірогідно не відрізнялась від показників у пацієнток з ОПн (31,0 % (31)) та нормальною МЩКТ (28,0 % (28)) (рис. 2).
Серед обстежених жінок зі встановленими вертебральними переломами 95,9 % (233) осіб мали біль у спині, що було вірогідно більше порівняно з пацієнтками з невертебральними переломами (88,0 % (205)), комбінованими переломами (88,5 % (314)) та без переломів (85,3 % (1821)) (x2 = 23,17, р < 0,001).
За результатами визначення ризику розвитку болю в спині встановлено, що у випадку наявності вертебральних переломів ризик розвитку болю у грудному відділі хребта вірогідно збільшується (ВР = 1,32; ДІ 95%: 1,09–1,60, р = 0,004); ризик розвитку больового синдрому в поперековому відділі вірогідно не змінюється (ВР = 1,03; ДІ 95%: 0,98–1,09, р = 0,19).
На наступному етапі вивчали особливості розвитку переломів у жінок залежно від іншого показника структурно-функціонального стану кісткової тканини — якості трабекулярної кісткової тканини.
При аналізі частоти розвитку різних типів переломів (вертебральні, невертебральні, комбінованої локалізації) встановлено, що на тлі найнижчих показників TBS (Q-І) розвивається 50,8 % вертебральних переломів, 43,7 % — невертебральних та 32,8 % — комбінованої локалізації (рис. 3).
За результатами кореляційного аналізу встановлено вірогідні зв’язки між наявністю переломів різної локалізації та віком, МЩКТ та TBS (рис. 4).
Висновок
Найбільша частота низькоенергетичних переломів спостерігається у хворих з остеопорозом (45,5 %), причому за рахунок осіб із вертебральними переломами та переломами комбінованої локалізації. Частка пацієнтів з остеопорозом серед осіб із невертебральними переломами становить 25,5 %. 50,8 % вертебральних, 43,7 % невертебральних та 32,8 % переломів комбінованої локалізації розвиваються на тлі низької якості трабекулярної кісткової тканини.
Наявність низькоенергетичних переломів частково пов’язана з показниками мінеральної щільності та якості трабекулярної кісткової тканини.
1. Поворознюк В.В., Дзерович Н.И. Качество трабекулярной костной ткани у женщин различного возраста // Боль. Суставы. Позвоночник. — 2011. — 4. — С. 29-31.
2. Boutroy S., Bouxsein M.L., Munoz F., Delmas P.D. In vivo assessment of trabecular bone microarchitecture by high-resolution peripheral quantitative computed tomography // J. Clin. Endocrinol. Metab. — 2005. — 90(12). — Р. 6508-6515.
3. Burge R., Dawson-Hughes B., Solomon D.H. et al. Incidence and economic burden of osteoporosis-related fractures in the United States, 2005–2025 // J. Bone Miner. Res. — 2007. — 22. — Р. 465-475.
4. Czerwinski E., Badurski J.E., Marcinowska-Suchowierska E., Osieleniac J. Current understanding of osteoporosis according to the position of the World Health Organization (WHO) and International Osteoporosis Foundation // Ortop. Traumatol. Rehabil. — 2007. — 9. — Р. 337-356.
5. Davies K.M., Stegman M.R., Heaney R.P., Recker R.R. Prevalence and severity of vertebral fracture: The Saunders County Bone Quality Study // Osteoporos Int. — 2005. — 6(2). — Р. 160-165.
6. Hannan E.L., Magaziner J., Wang J.J. et al. Mortality and locomotion 6 months after hospitalization for hip fracture: risk factors and risk-adjusted hospital outcomes // JAMA. — 2001. — 285. — Р. 2736-2742.
7. Hans D., Barthe N., Boutroy S. et al. Correlations between TBS, measured using antero-posterior DXA acquisition, and 3D parameters of bone micro-architecture: an experimental study on human cadavre vertebrae // J. Clin. Densitom. — 2011. — 14(3). — Р. 302-312.
8. Hordon L.D., Raisi M., Paxton S. et al. Trabecular architecture in women and men of similar bone mass with and without vertebral fracture: Part I. 2-D histology // Bone. — 2000. — 27(2). — Р. 271-276.
9. Griffith J.F., Engelke K., Genant H.K. Looking Beyond bone mineral density: imaging assessment of bone quality // Ann. N. Y. Acad. Sci. — 2010. — 1192. — Р. 45-56.
10. Johnnell O., Kanis J.A. An estimate of the worldwide prevalence and disability associated with osteoporotic fractures // Osteoporos Int. — 2006. — 17. — Р. 1726-1733.
11. Johnell O., Kanis J.A., Oden E. et al. Predictive value of BMD for hip and other fractures // J. Bone Miner. Res. — 2005. — 20(7). — Р. 1185-1194.
12. Kanis J.A., Johnell O., Oden A. et al. FRAX and the assessment of fracture probability in men and women from the UK // Osteoporos Int. — 2009. — 19 (4). — Р. 385-397.
13. Leslie W.D., Lix L.M., Langsetmo L. et al. Construction of a FRAX® model for the assessment of fracture probability in Canada and implications for treatment // Osteoporos Int. — 2011. — 22(3). — Р. 817-827.
14. Leslie W.D., Pahlavan P.S., Tsang J.F., Lix L.M. Prediction of hip and other osteoporotic fractures from hip geometry in a large clinical cohort // Osteoporos Int. — 2009. — 10. — Р. 1767-1774.
15. Link T.M., Majumdar S. Current diagnostic techniques in the evaluation of bone architecture // Curr. Osteoporos Rep. — 2004. — 2(2). — Р. 47-52.
16. Looker A.C., Orwoll E.S., Johnston C.C. Jr. et al. Prevalence of low femoral bone density in older U.S. adults from NHANES III // J. Bone Miner. Res. — 2009. — 12. — Р. 1761-1768.
17. Pothuaud L., Barthe N., Krieg M.-A. et al. Evaluation of the potential use of trabecular bone score to complement bone mineral density in the diagnosis of osteoporosis: a preliminary spine BMD-matched, case-control study // J. Clin. Densitom. — 2009. — 12(2). — Р. 170-176.
18. Rabier B., Héraud A., Grand-Lenoir C. et al. A multicentre, retrospective case-control study assessing the role of trabecular bone score (TBS) in menopausal Caucasian women with low areal bone mineral density (BMDa): Analysing the odds of vertebral fracture // Bone. — 2010. — 46(1). — Р. 176-181.
19. Rubin C.D. Emerging concepts in osteoporosis and bone strength // Curr. Med. Res. Opin. — 2005. — 21(7). — Р. 1049-1056.
20. Winzenrieth R., Dufour R., Pothuaud L., Hans D. A retrospective case-control study assessing the role of trabecular bone score in postmenopausal Caucasian women with osteopenia: analyzing the odds of vertebral fracture // Calcif. Tissue Int. — 2010. — 86(2). — Р. 104-109.

/56/56.jpg)
/57/57.jpg)