Журнал «Травма» Том 16, №1, 2015
Вернуться к номеру
Діагностика гетеротопічної осифікації у хворих із пошкодженням спинного мозку
Авторы: Поворознюк В.В., Бистрицька М.А. - ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України»;
Український науково-медичний центр проблем остеопорозу
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Нейрогенна гетеротопічна осифікація (ГО) характеризується утворенням нової додаткової кісткової тканини у м’яких тканинах, що оточують периферичні суглоби, у хворих із неврологічними розладами. Метою дослідження було визначити особливості ремоделювання кісткової тканини у пацієнтів із хребетно-спинномозковою травмою (ХСМТ) та виділити показники, специфічні для розвитку ГО.
Методи. Визначення маркерів ремоделювання кісткової тканини в периферичній крові — остеокальцин, P1NP, С-телопептид зшивок колагену І типу (β-CTX) — проводилось за допомогою електрохемілюмінесцентного методу на аналізаторі Eleсsys 2010 (Roche Diagnostics, Німеччина) за допомогою тест-систем cobas. У дослідження були включені 23 пацієнти з тяжкою ХСМТ (Frankel A, B) з тривалістю посттравматичного періоду від 3 до 12 місяців (середній вік 26,8 ± 3,9 року) — група І та 23 практично здорові особи — група ІІ (середній вік 30,6 ± 6,0 року); групи були порівнянні за віком та статтю. Група І була розподілена на дві підгрупи залежно від наявності ГО: підгрупа І — пацієнти з ХСМТ та ГО (n = 11), підгрупа ІІ — пацієнти з ХСМТ без ГО (n = 12).
Результати обстеження показали, що пацієнти першої групи мали значно вищі маркери ремоделювання кісткової тканини, ніж особи контрольної групи: P1NP (256,7 ± 48,2 нг/мл і 49,3 ± 5,1 нг/мл відповідно, p < 0,001), β-CTX (1,47 ± 0,23 і 0,45 ± 0,04 нг/мл відповідно, p < 0,001), остеокальцин (52,2 ± 9,8 нг/мл і 24,9 ± 2,08 нг/мл
відповідно, p< 0,001). Серед хворих із ХСМТ у пацієнтів із ГО рівні маркерів метаболізму кісткової тканини були значно вищими порівняно з пацієнтами, які не мали ГО: P1NP (404,9 ± 84,9 нг/мл і 133,2 ± 15,7 нг/мл відповідно, p < 0,001), β-CTX (1,75 ± 0,23 і 0,28 ± 0,14 нг/мл відповідно, p < 0,0001), остеокальцин (87,1 ± 18,9 нг/мл
і 29,4 ± 3,7 нг/мл відповідно, p < 0,001).
Висновок: маркери формування і резорбції кісткової тканини у пацієнтів першої групи були значно вищими, ніж у здорових осіб відповідного віку. Показники маркерів кісткового метаболізму в пацієнтів із ГO були вірогідно вищими, ніж у пацієнтів без ГO, і процеси формування кісткової тканини переважали над процесами резорбції у пацієнтів із ГO.
Нейрогенная гетеротопическая оссификация (ГО) характеризуется образованием новой дополнительной костной ткани в мягких тканях, которые окружают периферические суставы, у больных с неврологическими расстройствами. Целью исследования было определить особенности ремоделирования костной ткани у пациентов с позвоночно-спинномозговой травмой (ПСМТ) и выделить показатели, специфические для развития ГО.
Методы. Определение маркеров ремоделирования костной ткани в периферической крови — остеокальцин, P1NP, С-телопептид сшивок коллагена І типа (β-CTX) — проводилось при помощи электрохемилюминесцентного метода на анализаторе Eleсsys 2010 (Roche Diagnostics, Германия) при помощи тест-систем cobas. В исследование были включены 23 пациента с тяжелой ПСМТ (Frankel A, B) с длительностью посттравматического периода от 3 до 12 месяцев (средний возраст — 26,8 ± 3,9 года) — группа І и 23 практически здоровых лица — группа ІІ (средний возраст 30,6 ± 6,0 года); группы были сопоставимы по возрасту и полу. Группа І была разделена на две подгруппы в зависимости от наличия ГО: подгруппа І — пациенты с ПСМТ и ГО (n = 11) и подгруппа ІІ — пациенты с ПСМТ без ГО (n = 12).
Результаты обследования показали, что у пациентов первой группы были значительно выше маркеры ремоделирования костной ткани, чем у лиц контрольной группы: P1NP (256,7 ± 48,2 нг/мл и 49,3 ± 5,1 нг/мл соответственно, p < 0,001), β-CTX (1,47 ± 0,23 и 0,45 ± 0,04 нг/мл соответственно, p < 0,001), остеокальцин (52,2 ± 9,8 нг/мл и 24,9 ± 2,08 нг/мл
соответственно, p < 0,001). Среди больных с ПСМТ у пациентов с ГО уровни маркеров метаболизма костной ткани были значительно выше по сравнению с пациентами, у которых не было ГО: P1NP (404,9 ± 84,9 нг/мл и 133,2 ± 15,7 нг/мл соответственно, p < 0,001), β-CTX (1,75 ± 0,23 и 0,28 ± 0,14 нг/мл соответственно, p < 0,0001), остеокальцин (87,1 ± 18,9 нг/мл и 29,4 ± 3,7 нг/мл соответственно, p < 0,001).
Вывод: маркеры формирования и резорбции костной ткани у пациентов первой группы были значительно выше, чем у здоровых лиц соответствующего возраста. Показатели маркеров костного метаболизма у пациентов с ГO были достоверно выше, чем у пациентов без ГO, и процессы формирования костной ткани преобладали над процессами резорбции у пациентов с ГO.
Neurogenic heterotopic ossification (HO) is characterized by the formation of a new additional bone tissue in the soft tissues surrounding the peripheral joints in patients with neurological disorders. The objective of the study was to define the features of bone remodeling in patients with vertebral and cerebrospinal injury (VCSI) and to isolate indicators specific to HO development.
Methods. Identification of bone remodeling markers (osteocalcin, P1NP, C-telopeptide cross-linked collagen type 1 (β-CTX)) in peripheral blood was carried out using electrochemiluminescence method on Elessys 2010 analyzer (Roche Diagnostics, Germany) by means of cobas test kits. The study included 23 patients with severe VSCI (Frankel A, B) with duration of posttraumatic period from 3 to 12 months (mean age 26.8 ± 3.9 years) — group I and 23 apparently healthy individuals matched for age and sex — group II (mean age 30.6 ± 6.0 years). Group I was divided into two subgroups according to HO presence: subgroup I — patients with VSCI and HO (n = 11), and subgroup II — patients with VSCI and without HO (n = 12).
Results of the study showed that the patients of the first group had significantly higher bone remodeling markers than those of the control group: P1NP (256.7 ± 48.2 ng/ml and 49.3 ± 5.1 ng/ml, respectively, p < 0.001), β-CTX (1.47 ± 0.23 ng/ml and 0.45 ± 0.04 ng/ml, respectively, p < 0.001), osteocalcin (52.2 ± 9.8 ng/ml and 24.90 ± 2.08 ng/ml,
respectively, p < 0.001). Among patients with VSCI, in persons with HO the levels of bone metabolism markers were significantly higher compared with patients who did not have HO: P1NP (404.9 ± 84.9 ng/ml
and 133.2 ± 15.7 ng/ml, respectively, p < 0.001), β-CTX (1.75 ± ± 0.23 ng/ml and 0.28 ± 0.14 ng/ml, respectively, p < 0.0001), osteocalcin (87.1 ± 18.9 ng/ml and 29.4 ± 3.7 ng/ml, respectively, p < 0.001).
Conclusion. Markers of bone tissue formation and resorption in patients of the first group were significantly higher than in healthy age-matched individuals. Indicators of bone metabolism markers in patients with HO were significantly higher than in patients without HO, and processes of bone tissue formation dominated the processes of resorption in patients with HO.
гетеротопічна осифікація, пошкодження спинного мозку, маркери ремоделювання кісткової тканини.
гетеротопическая оссификация, повреждение спинного мозга, маркеры ремоделирования костной ткани.
heterotopic ossification, spinal cord injury, bone remodeling markers.
Статья опубликована на с. 79-86
Нейрогенна ГО характеризується утворенням нової додаткової кісткової тканини в м’яких тканинах, що оточують периферичні суглоби, у хворих на неврологічні розлади. У хворих із травматичним пошкодженням спинного мозку частота розвитку цього ускладнення варіює: 16–53 % пацієнтів за даними Rehabilitation Institute of Chicago [34], 13 % — за даними Hospital Nacional de Paraplejicos, Toledo [15] та 8 % — за Swiss Paraplegic Centre, Nottwil. До значного обмеження рухів у суглобах призводить від 10–20 % [5] до 30 % [34] випадків. Така різниця в показниках обумовлена застосуванням різних методів діагностики та різних діагностичних критеріїв [19, 35, 40, 53, 57].
Фактори ризику. Етіологія виникнення гетеротопічної осифікації невідома, що обумовлює пошуки факторів ризику та виділення категорій пацієнтів із великою ймовірністю розвитку ГО. Встановлені загальні фактори, що сприяють формуванню ектопічної кісткової тканини, а саме: масивні травми або хірургічні втручання, тяжкі неврологічні ушкодження, наявність ГО в анамнезі, генетична схильність, трофічні виразки, ураження електричним струмом, хвороба Педжета, хвороба Бехтерєва, ревматоїдний артрит, посттравматичний артрит, остеонекроз, інфекції сечовивідних шляхів, нефролітіаз тромбоз глибоких вен, гемофілія, серпоподібноклітинна анемія, правець, ампутація кінцівок.
Виділено лише декілька факторів ризику формування саме нейрогенної ГО. Так, при вивченні демографічних факторів не виявлено суттєвої різниці поширеності та вираженості клінічних проявів ГО залежно від віку, але в дітей осифікати трапляються рідше, ніж у дорослих (у 3–10 %), і не досягають великих розмірів [33]. Не знайдено відмінностей у поширеності ГО у хворих різної статі та раси, хоча в деяких дослідженнях частота розвитку ГО була вищою у чоловіків молодого віку, але цей контингент становить близько 75 % хворих із травматичною хворобою спинного мозку.
Найбільш вивченим провокуючим фактором виникнення ГО є скелетна травма. Відомо, що масивні ушкодження м’язів та переломи кісток при тяжких травмах ЦНС часто асоціюються з розвитком ГО [71]. Але навіть незначні травми опорно–рухового апарату чи пасивні рухи паралітичними кінцівками, які були нерухомі протягом певного часу (більше 7 днів), можуть ініціювати формування осифікату [11, 43, 49].
Серед медичних факторів також не знайдено специфічних для розвитку ГО, але були виділені фактори, що найчастіше трапляються в пацієнтів із ГО на тлі спінальної травми. Серед них:
— ступінь пошкодження спинного мозку — повне поперечне ураження, рівень пошкодження — шийний та верхньогрудний, при цьому ступінь пошкодження більше впливає на ризик розвитку ГО, ніж рівень пошкодження [71];
— кома — тривала кома асоціюється з розвитком ГО, проте досліджень впливу коми на ГО не проводилось [71];
— штучна вентиляція легень — тривала штучна вентиляція може призвести до зміни гомеостазу пацієнта, особливо вмісту електролітів (кальцію і фосфору) та кислотно–лужного балансу (зменшити насиченість тканин киснем та змінити рН), проте в жодному дослідженні не встановлений чіткий зв’язок між цими факторами та розвитком ГО;
— м’язова спастичність — надзвичайно поширений симптомом у пацієнтів із травмами ЦНС, виділена як фактор ризику розвитку ГО в численних дослідженнях [61, 68] у зв’язку з гіпоксією м’язів та підвищеним рівнем травматизації під час активних та пасивних рухів;
— наявність трофічних ран;
— наявність інфекційних ускладнень та конкрементів нирок і сечового міхура;
— тромбози судин нижніх кінцівок.
Клінічні прояви. Формування та ріст осифікату не супроводжується специфічними клінічними ознаками. У зоні розвитку ГО може виникати твердий набряк, почервоніння, локальне підвищення температури та значне обмеження обсягу рухів у суглобах, що зазвичай розцінюється як тромбофлебіт чи артрит [2, 59]. У хворих із частково збереженою чутливістю першим симптомом може бути біль в ураженій ділянці.
ГО завжди розвивається нижче рівня травми спинного мозку, частіше за все процес локалізується навколо кульшового суглоба (70–97 %) з залученням перед–ньої та медіальної групи м’язів стегна [39]. Можливий розвиток ГО і в інших ділянках тіла, зокрема навколо колінних, ліктьових, плечових суглобів та паравертебрально (нижче рівня травми) [31, 48].
Спектр клінічних проявів ГО варіює від незначних змін на рентгенограмах, які є випадковою знахідкою, до вираженого обмеження об’єму рухів. У більшості випадків ГО мінімальна й діагностується тільки при використанні інструментальних методів дослідження. Проте у 20–30 % пацієнтів із хребетно–спинномозковою травмою (ХСМТ) клініка ГО виражена й супроводжується значним обмеженням рухів у суглобах, а в 3–8 % пацієнтів розвивається анкілоз суглобів [15, 31].
Розвиток осифікації частіше починається в період між 1–м та 6–м місяцем після травми спинного мозку. Першими ознаками розвитку ГО є зменшення об’єму рухів у суглобах та періартикулярний набряк м’яких тканин, що можуть з’явитися вже в перші тижні після травми. На тлі розвитку ГО підвищується ступінь спастичності, з’являється обмеження рухів у суглобах, що погіршує можливості сидіння та взагалі якість життя хворого і ставить під загрозу ефективність реабілітаційних заходів [25, 65]. Існують дані, що ГО викликає компресію судинних структур і прилеглих периферичних нервів, що вже у свою чергу провокує розвиток анкілозу та нейротрофічних порушень.
ГО починається з ділянки набряку, запальної реакції та порушення мікроциркуляції. Спочатку відбувається інфільтрація тканин попередниками фібробластів, потім їх проліферація та диференціація з формуванням матриксу кісткової тканини. Первинний остеоїд формується на периферії ділянки як прошарок фібробластної мезенхімальної реакції. Потім через 2 тижні остеобласти продукують тропоколаген, що полімеризується з формуванням колагену, й виділяють лужну фосфатазу. Лужна фосфатаза інактивує пірофосфат, який запобігає фіксації кальцію. Отже, інактивація пірофосфату сприяє мінералізації матриксу кістки [1, 16, 47].
Процес мінералізації остеоїда складається з поступової заміни аморфної фази фосфату кальцію на кристали гідроксіапатиту. Процес відбувається в доцентровому напрямку. Осифікат має зональну будову. У центральній зоні відбувається швидка проліферація недиференційованих фібробластів, а також розвивається некроз м’яких тканин. Проміжна зона містить прошарок остеобластів, що формують незрілу кісткову тканину та трабекулярну облямівку на межі з тонкою зовнішньою зоною. Периферична облямівка проміжної зони стає рентгенологічно темною завдяки прогресивній мінералізації [11, 17, 35]. Повна послідовність процесів дозрівання кісткової тканини завершується в межах 6–18 місяців [26, 46]. Зріла ГО нагадує нормальну кісткову тканину як гістологічно, так і рентгенологічно й складається з трубчатої кістки з гаверсовими каналами, кірковим шаром, кровоносними судинами й кістковим мозком з незначним рівнем гемопоезу.
Діагностика перш за все базується на клінічних ознаках. Ранні прояви ГО необхідно диференціювати з артритом, тромбофлебітом, гематомою, пухлинами м’яких тканин.
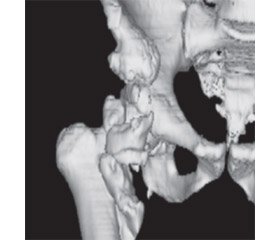
Інструментальні дослідження. Для ранньої діагностики найбільш інформативним є радіологічне дослідження з використанням технецію 99м. Перші ознаки можна виявити вже через 2,5 тижня після ТХСМ, проте недоліком методу є його низька специфічність, що призводить до потенційних труднощів у диференційній діагностиці ГО від інших запальних, травматичних або дегенеративних процесів у скелеті, а також переломів, пухлин кістки, метастазів або остеомієліту, що також супроводжуються підвищеним накопиченням остеотропних ізотопів [60]. Через 4–6 тижнів після перших клінічних ознак, коли ГО досягає щільності кістки, можливе застосування ультразвукової діагностики та рентгенографії. Для контролю розвитку ГО застосовують рентгенографію, проте при великому розмірі осифікату інтерпретація рентгенограм складна, бо незрілі елементи можуть закривати зрілу кісткову тканину (рис. 1А). Комп’ютерна томографія (КТ) дозволяє краще візуалізувати ектопічну кісткову тканину відносно м’яких тканин. КТ також застосовують при плануванні хірургічного лікування, особливо тривимірну томографію, щоб уникнути в процесі оперативного втручання ділянок незрілої кісткової тканини (рис. 1Б.) Магнітно–резонансна томографія (MРТ) — найкраща методика для визначення об’єму залучених м’яких тканин, але цей метод не застосовується в ранній діагностиці ГО у зв’язку з відсутністю специфічного МРТ–сигналу від осифікованих тканин [60, 63].
Лабораторні тести. Рутинні лабораторні дослідження не відіграють суттєвої ролі в діагностиці та моніторингу ГО. Привертають увагу високі цифри швидкості осідання еритроцитів (ШОЕ), але цей показник не є специфічним [22]. Рівень кальцію вірогідно не змінюється. Лужна фосфатаза (ЛФ) є чутливим, але також неспецифічним показником для ГО. Під час формування ГО рівень ЛФ вірогідно збільшується, але як тільки ріст осифікату припинявся, рівень ферменту знижувався і повертався до норми, що не дозволяє використовувати його для діагностики ГО [46]. Взагалі рівень ЛФ починає підвищуватися в середньому за 7 тижнів перед тим, як з’являються перші клінічні ознаки, й досягає пікового рівня за 3 тижні до появи клінічних проявів. З того часу рівень ЛФ поступово зменшується й досягає норми протягом близько 5 місяців. Проте масивне утворення кістки може призводити до тривалого збільшення рівня ЛФ, а незначна ГО може не супроводжуватись змінами рівня ЛФ взагалі. Таким чином, нормалізація рівнів ЛФ не є адекватним доказом стабілізації процесу остеогенезу й припинення росту осифікату. Проте на сьогодні визначення рівня лужної фосфатази є єдиним широкодоступним методом у диференціальній діагностиці ранньої ГО з іншими запальними процесами, тому що ЛФ помітно збільшується під час активного остеогенезу й суттєво не змінюється при запальних процесах.
Серед інших лабораторних показників виявлено підвищення концентрації в сечі гідроксиполіну (метаболіт колагену). Але цей показник підвищений майже в усіх хворих із травматичним пошкодженням спинного мозку, що не дозволяє використовувати його як діагностичний критерій ГО [4, 50]. На сьогодні не виділені маркери ремоделювання кісткової тканини, специфічні для розвитку нейрогенної гетеротопічної осифікації. До того ж тяжкі травми ЦНС викликають суттєві зміни кісткового метаболізму, й на цьому тлі складно визначити параметри, специфічні саме для ГО.
Таким чином, діагностика ГО базується на клінічних проявах та рентгенологічних змінах. З метою ранньої діагностики та моніторингу ефективності лікування можливе застосування остеосцинтиграфії. Серед лабораторних показників специфічних маркерів не знайдено, проте під час розвитку осифікату суттєво змінюється рівень лужної фосфатази та збільшується показник ШОЕ. Враховуючи специфічний контингент пацієнтів (хворі з тяжкою хребетно–спинномозковою травмою, яких тяжко транспортувати в медичні заклади для проведення специфічних досліджень), найбільш перспективним напрямком ранньої діагностики нейрогенної ГО є маркери метаболізму кісткової тканини.
У відділі клінічної фізіології та патології опорно–рухового апарату ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України» проведено дослідження особливостей ремоделювання кісткової тканини у пацієнтів із ХСМТ та гетеротопічною осифікацією.
Метою дослідження було визначити особливості ремоделювання кісткової тканини в пацієнтів із ХСМТ та виділити показники, специфічні для розвитку ГО.
Критерії включення:
1. Тяжка хребетно–спинномозкова травма на шийному чи грудному рівні хребта (Frankel A, B).
2. Тривалість посттравматичного періоду до 12 місяців.
3. Наявність клінічних ознак розвитку ГО.
Критерії виключення:
1. Тяжка хребетно–спинномозкова травма з неусуненою компресією спинного мозку.
2. Інфекційні ускладнення хребетно–спинномозкової травми в гострій стадії.
3. Супутні масивні травми кістково–м’язової системи.
4. Ендокринні розлади, які б могли впливати на кальцієвий обмін або потребували б спеціальної терапії (цукровий діабет, гіпотиреоз), прийом глюкокортикостероїдів та антиконвульсантів.
Методи дослідження: обстежено 23 пацієнти з тяжкою ХСМТ (Frankel A, B) з тривалістю посттравматичного періоду від 3 до 12 місяців (середній вік 26,8 ± 3,9 року) — група І та 23 практично здорові особи відповідного віку та статі — група ІІ (середній вік 30,6 ± 6,0 року). Група І була розділена на дві підгрупи залежно від наявності ГО: підгрупа І — пацієнти з ХСМТ та ГО (n = 11, віком від 23 до 34 років, середній вік 27,6 ± 4,1 року) і підгрупа ІІ — пацієнти з ХСМТ без ГО (n = 12, віком від 21 до 28 років, середній вік 26,2 ± 3,8 року). Обидві підгрупи основної групи були порівнянні за віком, тривалістю посттравматичного періоду, ступенем неврологічних проявів.
Визначення маркерів ремоделювання кісткової тканини в периферичній крові (остеокальцин, P1NP, С–телопептид зшивок колагену І типу (b–CTX)) проводилось за допомогою електрохемілюмінесцентного методу на аналізаторі Eleсsys 2010 (Roche Diagnostics, Німеччина) за допомогою тест–систем cobas.
Результати дослідження маркерів ремоделювання кісткової тканини наведені в табл. 1, 2. Дані наведені у вигляді М ± m.
Результати дослідження показали, що в пацієнтів із ХСМТ рівень ремоделювання кісткової тканини вірогідно вищий, ніж у здорових осіб відповідного віку. При цьому підвищуються як маркери формування (остеокальцин і P1NP), так і маркери резорбції кісткової тканини (bCTX). Сироваткові рівні маркерів P1NP та b–CTX значно перевищують нормативні значення, а рівень остеокальцину наближається до верхньої межі норми. При розподілі групи пацієнтів із ХСМТ на дві підгрупи виявлено, що ремоделювання кісткової тканини суттєво відрізняється в пацієнтів із ГО та без неї. У пацієнтів із ХСМТ переважають процеси резорбції, що відображається у підвищенні bCTX у середньому у 2,8 раза порівняно зі значеннями у групі ІІ та в 1,5 раза — відносно нормативних значень. Маркери формування кісткової тканини в цієї групи пацієнтів підвищуються несуттєво, а саме концентрація P1NP збільшена в 2,7 раза щодо практично здорових осіб, проте незначно перевищує нормативні значення — в 1,3 раза; концентрація остеокальцину в цих пацієнтів не відрізняється від такої у практично здорових осіб та знаходиться в рамках нормативних значень. У пацієнтів з осифікатами переважають процеси формування кісткової тканини. Концентрації маркерів ремоделювання кісткової тканини вірогідно перевищують значення для практично здорових осіб та значення пацієнтів із ХСМТ без осифікатів (табл. 2).
Отже, ХСМТ характеризується переважанням процесів резорбції над процесами формування кісткової тканини, у той час як формування ГО супроводжується переважанням процесів формування кісткової тканини. Відмінністю метаболізму кісткової тканини, характерною для ГО у пацієнтів із ХСМТ, є значне підвищення, що перевищує в декілька разів (три і більше) нормативні значення, рівня маркеру формування — P1NP та збільшення вище нормативних значень сироваткового рівня остеокальцину. Підвищення маркера резорбції –CTX більш специфічне для ХСМТ, ніж для формування ГО.
У результаті проведеного дослідження вдалось виділити зміни маркерів ремоделювання кісткової тканини, що свідчать про розвиток ГО та можуть використовуватись для ранньої діагностики ГО.
Рання діагностика ГО на етапі формування матриксу осифікату дозволяє запобігти мінералізації м’якотканинної основи осифікату і зберегти об’єм рухів у суглобах та можливості адаптації пацієнта до інвалідного візка.
Клінічний приклад 1
Пацієнт Р., 1985 р.н., отримав травму нирця 27.06.2010 р., при рентгенологічному та МРТ дослідженні шийного відділу хребта діагностований перелом С5–С6 хребців з ушкодженням спинного мозку (Frankel А). Через 2,5 місяця після ХСМТ з’явився твердий набряк обох стегон, більше виражений справа, помірно гарячий без ознак гіперемії. Діагноз не встановлено, лікування не отримував. Пацієнт звернувся в ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України» через 6 тижнів від початку симптоматики. На момент звернення тривалість посттравматичного періоду — 4 місяці.
При об’єктивному обстеженні: верхній змішаний глибокий парапарез, нижня спастична параплегія, гіпестезія за провідниковим типом від рівня С7. Обмеження згинання в колінних суглобах до 120° з двох сторін, що не дозволяє посадити пацієнта у візок та проводити реабілітацію.
Проведено дослідження маркерів метаболізму кісткової тканини. У пацієнта виявлено P1NP = 341 (N = 20–100) нг/мл, остеокальцин = 114 (N = 11–43) нг/мл, bCTX = 1,73 (N > 0,807) нг/мл, що дозволяє діагностувати ГО. Для підтвердження діагнозу додатково виконано прицільну рентгенографію ділянки твердого набряку, виявлено вогнище осифікації округлої форми в м’яких тканинах нижньої третини стегна (рис. 2А).
Рання діагностика ГО дозволила вчасно провести консервативне лікування, запобігти мінералізації м’якої основи матриксу та зберегти функцію колінних суглобів, що дало змогу проводити активні реабілітаційні заходи.
Приклад 2
Пацієнт К., 1986 р.н., отримав травму нирця 27.06.2009 р., при рентгенологічному та МРТ–дослідженні діагностований перелом С5–С6 хребців із пошкодженням спинного мозку (Frankel A). Перші симптоми ГО (набряк нижніх кінцівок без ознак гіперемії в лютому 2010 року, тривалість посттравматичного періоду — 7 місяців). Діагноз не встановлено, лікування не отримував. Пацієнт звернувся в ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України» через 5 місяців від початку симптоматики. На момент звернення тривалість посттравматичного періоду — 12 місяців.
При об’єктивному обстеженні: верхній змішаний глибокий парапарез, нижня спастична параплегія, гіпестезія за провідниковим типом від рівня С7. Обмеження згинання в колінних суглобах до 130° з двох сторін, що не дозволяє посадити пацієнта у візок та проводити реабілітацію.
Проведено дослідження маркерів метаболізму кісткової тканини. У пацієнта виявлено P1NP = 572 (N = 20–100) нг/мл, остеокальцин = 124 (N = 11–43) нг/мл, bCTX = 2,6 (N > 0,807) нг/мл, що вказує на формування ГО. Для додаткового підтвердження діагнозу проведена рентгенографія стегнових кісток та колінних суглобів, виявлені масивна ГО в зоні медальної та задньої поверхні колінних суглобів, що перешкоджають будь–яким рухам у колінних суглобах (рис. 2Б).
У наведеному прикладі консервативне лікування неефективне у зв’язку з пізнім виявленням ГО. Для відновлення реабілітаційного потенціалу пацієнта необхідне лише оперативне видалення осифікованих тканин, але це оперативне втручання дуже складне й супроводжується високим відсотком тяжких ускладнень.
Таким чином, наведені результати біохімічних досліджень безперечно вказують на ефективність застосування маркерів ремоделювання кісткової тканини в ранній діагностиці розвитку ГО у пацієнтів із ХСМТ.
Обговорення результатів. Згідно з останніми тенденціями в генезі формування ГО провідне місце належить гуморальним факторам. Ймовірно, тригерним механізмом виступає поєднання декількох факторів. Окрема роль конкретних факторів досі дискутується в літературі. Зокрема, відомо, що в пацієнтів із тяжкими травмами ЦНС визначають підвищені рівні маркерів запалення: ШОЕ, С–реактивний білок та ін. І хоча в запальних процесах саме кісткової тканини активну роль відіграє інтерлейкін 6, його роль у формуванні ГО досі не вивчалась, проте інший фактор — фактору некрозу пухлини альфа наразі розглядається як потенційний маркер ранньої діагностики розвитку ГО [69]. Серед маркерів ремоделювання кісткової тканини досі не виділені фактори, специфічні для тяжких травм ЦНС та нейрогенної ГО. За даними одних досліджень, рівень паратгормону значно збільшується у пацієнтів із травмами ЦНС у ранньому періоді (через 6 годин після травми) [66, 70]. Проте, за результатами інших досліджень [67], не виявлено істотних відмінностей у сироваткових рівнях паратгормону між різними групами дослідження в різні періоди посттравматичного періоду. Для лужної фосфатази дані також є спірними, оскільки в останніх дослідженнях не було показано статистично значущих відмінностей рівнів лужної фосфатази між пацієнтами з травмою ЦНС та групою контролю [67]. В експерименті доведена роль остеокальцину в формуванні м’якотканинного матриксу осифікату, проте не визначена його роль як предиктора чи специфічного маркера формування ГО [70, 71]. Trentz et al. [70] висловили теорію дисбалансу між проостеоіндуктивними та антиостеоіндуктивними факторами, досліджуючи рівні С–телопептиду проколагену І типу і С–телопептиду зшивок колагену у 80 пацієнтів із черепно–мозковою травмою та ГО. Згідно з їх результатами, не тільки рівні С–телопептиду проколагену І типу були вищі від нормального діапазону і вищі, ніж в інших групах у пацієнтів із ЧМТ (демонструючи підвищену активність остеобластів), але й рівні С–телопептиду зшивок колагену були нижчі, що свідчить про знижену активність остеокластів [71].
У нашому дослідженні реєструвалось підвищення рівнів як маркерів формування кісткової тканини, так і маркера резорбції, проте процеси формування також переважали над процесами резорбції.
Висновки
Ремоделювання кісткової тканини в пацієнтів із ХСМТ характеризується прискоренням резорбції кісткової тканини, що ілюструється вищими значеннями маркерів резорбції кісткової тканини, зокрема bCTX, у сироватці крові пацієнтів із ХСМТ порівняно з особами контрольної групи та нормативними значеннями.
Особливістю ремоделювання кісткової тканини, притаманною нейрогенній ГО у пацієнтів із ХСМТ, є переважання процесів формування кісткової тканини над процесами резорбції.
У результаті проведеного дослідження вдалось виділити зміни маркерів ремоделювання кісткової тканини, що свідчать про розвиток ГО та можуть використовуватись для ранньої діагностики ГО, а саме значне підвищення, що перевищує в декілька разів (три і більше) нормативні значення, рівня маркера формування — P1NP та збільшення вище нормативних значень сироваткового рівня остеокальцину. Рання діагностика ГО на етапі формування матриксу осифікату дозволяє запобігати мінералізації м’якотканинної основи осифікату і зберігати об’єм рухів у суглобах та можливості адаптації пацієнта.
1. Белова А.Н. Нейрореабилитация: Руководство для врачей. — М.: Антидот, 2000. — С. 172–180, 347–404.
2. Корж А.А., Дедух Н.В. Гетеротопическая оссификация (взгляд на проблему) // Ортопедия, травматология и протезирование. — 2004. — № 4. — С. 89–93.
3. Поворознюк В.В., Бистрицька М.А. Особливості ремоделювання кісткової тканини у спінальних хворих з гетеротопічною осифікацією // Літопис травматології та ортопедії. — 2011. — 1–2. — С. 65–68.
4. Повреждение позвоночника и спинного мозга / Под ред. Полищука Н.Е., Коржа Н.А., Фищенко В.Я. — К.: Книга плюс, 2001. — 388 с.
5. Banovac K., Gonzalez F., Wade N. et al. Intravenous disodium etidronate therapy in spinal cord injury patients with heterotopic ossification // Paraplegia. — 1993. — V. 31, № 10. — P. 660–666.
6. Bravo–Payno P., Esclarin A., Arzoz T. et al. Incidence and risk factors in the appearance of heterotopic ossification in spinal cord injury // Paraplegia. — 1992. — V. 30, № 10. — P. 740–745.
7. Buschbacher R. Heterotopic ossification. A review // Crit. Rev. Phys. Rehabil. Med. — 1992. — V. 4. — Р. 199–213.
8. Cassar–Pullincino V.N. et al. Sonographic diagnosis of hete–rotopic bone formation in spinal cord patients // Paraplegia. — 1993. — V. 31. — Р. 40–50.
9. DiMaio V.J., Francis J.R. Heterotopic ossification in unidentified skeletal remains // Am. J. Forensic Mcd. Pathol. — 2001. — V. 22, № 2. — P. 160–164.
10. Estrores I.M., Harrington A., Banovac K. C–reactive protein and erythrocyte sedimentation rate in patients with heterotopic ossification after spinal cord injury // J. Spinal. Cord. Med. — 2004. — V. 27, № 5. — P. 434–437.
11. Fuller D.A., Mark A., Keenan M.A. Excision of heterotopic ossification from the knee: a functional outcome study // Clin. Orthop. Relat. Res. — 2005. — V. 438. — P. 197–203.
12. Garland D.E. A clinical perspective on common forms of acquired heterotopic ossification // Clin. Orthop. — 1991. — V. 263. — Р. 13–29.
13. Kapanen A., Ryhanen J., Birr E. et al. Bone morphogenetic protein 3b expressing reindeer antler // J. Biomed. Mater. Res. — 2002. — V. 59, № 1. — P. 78–83.
14. Kaplan F.S., Glaser D.L., Hebela N. et al. Heterotopic ossification // J. Am. Acad. Orthop. Surg. — 2004. — V. 12, № 2. — P. 116–25.
15. Kluger G., Kochs A., Holthausen H. Heterotopic ossification in childhood and adolescence // J. Child Neurol. — 2000. — V. 15. — P. 406–413.
16. Lal S., Hamilton B.B., Heinemann A. et al. Risk factors for heterotopic ossification in spinal cord injury // Arch. Phys. Med. Rehabil. — 1989. — V. 70, № 5. — P. 387–90.
17. Lane J.E., Dean RJ., Foulkes G.D. et al. Chandler P.W. Idio–pathic heterotopic ossification in the intensive care setting // Postgrad. Med. J. — 2002. — V. 78, № 922. — P. 494–495.
18. Mavrogenis A., Guerra G., Staals E. A classification method for neurogenic heterotopic ossification of the hip // J. Orthop. Traumatol. — 2012. — V. 13, № 2. — P. 69–78.
19. McAfee P.C., Cunningham B.W., Devine J. et al. Classification of heterotopic ossification № HO) in artificial disk replacement // J. Spinal. Disord. Tech. — 2003. — V. 16, № 4. — P. 384–389.
20. Nottwil C. Riklin, M. Baumberger, L. Wick et al. Deep vein thrombosis and heterotopic ossification in spinal cord injury: a 3 year experience at the Swiss Paraplegic Centre // Spinal. Cord. — 2003. — V. 41. — P. 192–198.
21. Orzel J.A., Rudd T.G. Heterotopic bone formation. Clinical, laboratory, and imaging correlation // J. Nucl. Med. — 1985. — V. 26. — Р. 125–132.
22. Peck R.J., Metreweli C. Early myositis ossificans: a new echographic sign // Clin. Radiol. — 1988. — V. 39. — Р. 586–588.
23. Pelissicr J. et al. Treatment of neurogenic heterotopic ossifications № NHO) in brain injured patients: review of literature // Ann. Readapt. Med. Phys. — 2002. — V. 45, № 5. — P. 188–197.
24. Perkash A., Sullivan G., Toth L. et al. Persistent hypercoagulation associated with heterotopic ossification in patients with spinal cord injury long after injury has occurred // Paraplegia. — 1993. — V. 31, № 10. — P. 653–659.
25. Povorznyuk V., Bystrytska M. Рeculiarity of bone turnover in patients with chronic spinal cord injury // Osteoporosis International. — 2011. — 22 (1). — P. 619.
26. Schara K., Herman S. Heterotopy bone formation in total hip arthroplasty: predisposing factors, classification and the significance for clinical outcome // Acta. Chir. Orthop. Traumatol. Cech. — 2001. — V. 68, № 2. — P. 105–108.
27. Stannard J.P., Wilson T.C., Sheils T.M. et al. Heterotopic ossification associated with knee dislocation // Arthroscopy. — 2002. — V. 18, № 8. — P. 835–839.
28. Tow A.P., Kong K.H. Prolonged fever and heterotopic ossification in a C4 tetraplegic patient. Case report // Paraplegia. — 1995. — V. 33, № 3. — P. 170–174.
29. Van Kuijk A.A, Geurts A.C., van Kuppevelt H.J. Neurogenic heterotopic ossification in spinal cord injury // Spinal Cord. — 2002. — V. 40, № 7. — P. 313–326.
30. Vanden Bossche L., Vanderstraeten G. Heterotopic ossification: a review // J. Rehabil. Med. — 2005. — V. 37, № 3. — P. 129–136.
31. Wick L., Berger M., Knecht H. et al. Magnetic resonance signal alterations in the acute onset of heterotopic ossification in patients with spinal cord injury // Eur. Radiol. — 2005. — V. 15, № 9. — P. 1867–75.
32. Yin K.S, James J., Lew K. et al. Refractory heterotopic ossification with complications // J. Spinal. Cord. Med. — 2001. — V. 24, № 2. — P. 119–122.
33. Gautschi O.P., Cadosch D., Frey S.P. et al. Serum–mediated osteogenic effect in traumatic brain–injured patients // ANZ J. Surg. — 2009. — V. 79. — P. 449–455.
34. Cadosch D., Toffoli A.M., Gautschi O.P. et al. Serum after traumatic brain injury increases proliferation and supports expression of osteoblast markers in muscle cells // J. Bone Joint Surg. Am. — 2010. — V. 92(3). — Р. 645–653.
35. Da Paz A.C., Carod Artal F.J., Kalil R.K. The function of propioceptors in bone organization: a possible explanation for neurogenic heterotopic ossification in patients with neurological damage // Med. Hypotheses. — 2007. — V. 68. — Р. 67–73.
36. Crespo A.R., Da Rocha A.B., Jotz G.P. et al. Increased serum sFas and TNF alpha following isolated severe head injury in males // Brain Inj. — 2007. — V. 21 (4). — Р. 441–447.
37. Trentz O.A., Handschin A.E., Bestmann L. et al. Influence of brain injury on early posttraumatic bone metabolism // Crit. Care Med. — 2005. — V. 33(2). — Р. 399–406.
38. Sakellariou V.I., Grigoriou E., Mavrogenis A.F. et al. He–terotopic ossification following traumatic brain injury and spinal cord injury: insight into the etiology and pathophysiology // J. Musculoskelet Neuronal. Interact. — 2012. — V. 12(4). — Р. 230–240.

/81/81.jpg)
/82/82.jpg)
/83/83.jpg)
/83/83_2.jpg)