Газета «Новости медицины и фармации» 3 (532) 2015
Вернуться к номеру
Место висмута субцитрата в комплексной терапии пациентов с язвенной болезнью, ассоциированной с Helicobacter pylori
Авторы: Фадеенко Г.Д., Колесникова Е.В. — ГУ «Национальный институт терапии имени Л.Т. Малой НАМН Украины», г. Харьков
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 16-18 (Мир)
Язвенная болезнь — одно из наиболее частых заболеваний гастродуоденальной зоны. Имеющиеся данные свидетельствуют о большом количестве пациентов с этим заболеванием: в Японии — 11,2 %, в Швейцарии — до 7,5 %, на Среднем Востоке — до 25 %, в США — до 10 % населения. Чаще всего язвенная болезнь возникает в 25–40–летнем возрасте, но может обнаруживаться у людей любой возрастной категории. У женщин встречается реже, чем у мужчин, — в соотношении 1 : 2 — 1 : 5 [1, 4].
К наиболее частым причинам развития язвенной болезни относится инфекция Helicobacter pylori. Эпидемиологические данные свидетельствуют о том, что 100 % язв двенадцатиперстной кишки и 80 % язв желудка связаны с персистенцией H.pylori [11]. В развитых странах Европы количество инфицированных H.pylori достигает 15–20 %, а в некоторых странах Азии и Африки — до 76 % населения [10]. В Украине средний уровень инфицированности H.pylori среди взрослого населения достаточно высок — около 70 % [6].
Основной целью терапии пациентов с язвенной болезнью является проведение этиологического лечения, устранение ведущей причины заболевания — H.pylori, быстрое купирование симптомов заболевания, заживление язвенного дефекта, предупреждение развития рецидивов и осложнений, а также хорошая переносимость и безопасность терапии, уменьшение сроков лечения, частых повторных (контрольных) видеоэзофагогастродуоденоскопий (ВЭГДС) и госпитализаций. Однако это не всегда является возможным, несмотря на наличие широкого выбора схем антихеликобактерной терапии (АХБТ), что обусловливает актуальность исследования данной проблемы.
Современный этап клинического применения АХБТ характеризуется рядом негативных тенденций, в первую очередь снижением эффективности классической тройной схемы эрадикационной терапии. Основными факторами, снижающими эффективность АХБТ, являются резистентность H.pylori к антибактериальным средствам, нерациональное использование антибактериальных препаратов и некорректное их назначение, возникновение побочных эффектов АХБТ, что требует назначения дополнительных лекарственных препаратов для их коррекции. Это снижает приверженность пациентов к такой терапии. Существующие схемы АХБТ не гарантируют стабильно максимальный уровень эрадикации H.pylori. В последние годы эффективность стандартной тройной АХБТ продолжает значительно снижаться и не достигает 80% уровня, рекомендованного Маастрихтским соглашением [2, 4, 5].
В большинстве случаев подбор антибактериальной терапии с учетом резистентности H.pylori врачом поликлиники или стационара невозможен, так как методики определения чувствительности H.pylori к антибиотикам не относятся к повседневной клинической практике врача, отсутствует возможность идентификации индивидуальных генетических детерминант определения эффективности АХБТ [13, 14]. Ведется поиск других схем терапии язвенной болезни, ассоциированной с H.pylori, которые были бы лишены упомянутых недостатков.
Квадротерапия с включением препаратов коллоидного висмута (ингибитор протонной помпы (ИПП), препарат висмута и два антибиотика) считается идеальной заменой стандартной тройной терапии и способствует достоверному снижению антибиотикорезистентности H.pylori. Важно отметить, что препараты висмута субцитрата являются единственными антихеликобактерными средствами, к которым не было отмечено формирования резистентности данного микроорганизма [3, 9]. Во многом это объясняется многокомпонентным механизмом их действия на H.pylori. В проспективном исследовании X. Liang и соавт. (2013) у пациентов с неудачным предыдущим лечением кларитромицином, метронидазолом и фторхинолонами эффективность висмутсодержащих схем квадротерапии составила от 83,8 (с амоксициллином и тетрациклином) до 95,2 % (с амоксициллином и фуразолидоном) [11, 12].
Благодаря отсутствию как первичной, так и вторичной резистентности H.pylori к препаратам висмута и таких побочных эффектов, как антибиотикоассоциированная диарея и дисбиоз кишечника, в IV Маастрихтском соглашении уделено особое внимание упомянутым препаратам [2, 4, 5]. При наличии антибиотикорезистентности к H.pylori рекомендуется использовать препараты висмута в схемах эрадикационной терапии как 1-й, так и 2-й линии. Добавление висмута повышает эффективность эрадикации на 20 % [5–8].
Доказано, что препараты висмута субцитрата обладают многогранным действием, оказывая влияние на разные звенья патогенеза язвенной болезни. К основным фармакологическим эффектам препарата можно отнести вяжущее, гастроцитопротекторное и противомикробное действие. Висмута субцитрат характеризуется высокой степенью растворимости, благодаря этому препарат способен проникать глубоко в слой слизи, инактивируя микроорганизмы, находящиеся под слизистой оболочкой. Таким образом, при применении упомянутых препаратов снижается риск развития рецидива язвенной болезни [3, 11, 12].
Цель исследования — изучить цитопротективную активность и антихеликобактерные свойства препаратов висмута субцитрата у больных язвенной болезнью, ассоциированной с H.pylori, путем оценки влияния на уменьшение и исчезновение основных клинических признаков заболевания, заживление язвенного дефекта, эрадикацию H.pylori (показатели уреазного теста и стул-теста), а также эндоскопическую картину, отражающую степень выраженности изменений слизистой оболочки гастродуоденальной зоны.
Материалы и методы
В клинике ГУ «Национальный институт терапии имени Л.Т. Малой НАМН Украины» было обследовано 60 пациентов с язвенной болезнью, ассоциированной с H.pylori, в возрасте от 18 до 70 лет (в среднем 41,2 ± 4,5 года), из них 35 мужчин и 25 женщин. Пациентам проведены стандартные общеклинические исследования.
Больных распределили на две группы: основную (n = 30) и контрольную (n = 30). В обеих группах было по 9 пациентов с пептической язвой желудка (ПЯЖ) и по 21 — с пептической язвой двенадцатиперстной кишки (ПЯДПК).
Пациенты основной группы получали стандартную тройную терапию (ИПП, кларитромицин в дозе 500 мг 2 раза в сутки, амоксициллин в дозе 1000 мг 2 раза в сутки) и отечественный препарат висмута субцитрата Гастро-Норм (корпорация «Артериум», ПАО «Киевмедпрепарат») по 120 мг 3 раза в сутки за 30 мин до еды и четвертый раз перед сном. Пациенты контрольной группы получали стандартную тройную терапию (ИПП, кларитромицин по 500 мг 2 раза в сутки, амоксициллин по 1000 мг 2 раза в сутки) и референтный препарат коллоидного висмута субцитрата Де-Нол (Astellas Pharma Europe B. V., Нидерланды) по 120 мг 3 раза в сутки за 30 мин до еды и четвертый раз перед сном. Длительность терапии составила 14 дней.
Схема обследования пациентов с язвенной болезнью, ассоциированной с H.pylori, предусматривала опрос и осмотр больного с оценкой ведущих клинических синдромов еженедельно. Степень выраженности каждого клинического признака оценивали по следующей шкале: 0 — отсутствие признака, 1 — слабая степень выраженности, 2 — умеренная степень выраженности, 3 — значительная степень выраженности. Измеряли частоту сердечных сокращений (ЧСС) и АД, пальпацию живота проводили еженедельно и на 21-е сутки после окончания лечения. Выполняли клинико-инструментальное обследование: общеклинические исследования, ВЭГДС (до начала лечения и на 35-е сутки после окончания лечения). Степень обсеменения слизистой оболочки желудка и двенадцатиперстной кишки H.pylori определяли с помощью уреазного теста и стул-теста (определение антигена H.pylori в кале). Уреазный тест оценивали так: желтое окрашивание среды — тест отрицательный (–), оранжевое — слабо положительный (+), розовое — умеренно положительный (++), красное — резко положительный (+++) — до начала лечения и на 35-е сутки после окончания курса лечения.
Верификация диагноза проводилась с помощью ВЭГДС с биопсией.
Обе группы больных были репрезентативными не только по возрасту и соотношению полов, но и по эндоскопической характеристике язвенного дефекта слизистой оболочки: средний размер (диаметр) язв желудка и двенадцатиперстной кишки в основной группе составлял 1,00 ± 0,26 см и 0,8 ± 0,5 см, в контрольной — 1,1 ± 0,46 см и 0,84 ± 0,48 см соответственно, р > 0,01. Статистически значимых различий в глубине язвенных дефектов не отмечено (табл. 1).
Наличие H.pylori до начала лечения было подтверждено у всех пациентов уреазным тестом и стул-тестом.
Оценку клинической эффективности висмутсодержащих препаратов в терапии язвенной болезни, ассоциированной с H.pylori, проводили по единой схеме, состоящей из 5 визитов: 1-й — до лечения, 2-й — на 7-е сутки от начала лечения, 3-й — на 14-е сутки, 4-й — на 21-е сутки после окончания лечения и 5-й — на 35-е сутки после окончания курса лечения с выполнением контрольной ВЭГДС, уреазного и стул-теста для оценки эффективности проведенной терапии.
Полученные результаты анализировали с использованием стандартного пакета программ Statistica for Windows. Достоверность различий определяли с помощью t-критерия Стьюдента. Различия показателей расценивали как статистически значимые при р < 0,05.
Результаты и обсуждение
На 3-и – 7-е сутки от начала лечения отмечена тенденция к улучшению клинической симптоматики (табл. 2).
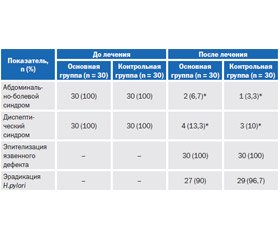
Купирование болевого синдрома на 2-е – 3-и сутки от начала терапии наблюдали у большинства пациентов как основной (у 96,3 %), так и контрольной группы (98,0 %). Статистически значимых отличий в самостоятельном купировании боли и боли при проведении пальпации живота на фоне проведения терапии между группами не выявлено (р > 0,01). Более длительное сохранение болевого синдрома отмечено у 26,6 % пациентов основной группы против 23,3 % в контрольной группе. Болезненность при пальпации более 3 дней сохранялась у 14 пациентов в основной и у 11 — в контрольной группе (различия между группами статистически незначимы). Сохранение болевого синдрома более 3 дней и пальпаторной болезненности, вероятно, обусловлено тем, что данные пациенты принадлежали к более старшей возрастной группе (средний возраст 52,4 ± 3,6 года, тогда как у пациентов, у которых болевой синдром удалось купировать к 3-м суткам, — 38,7 ± 4,5 года, р < 0,01). Кроме того, пациенты с болевым синдромом, сохраняющимся более 3 дней, имели сопутствующую кардиоваскулярную патологию в виде ишемической болезни сердца и гипертонической болезни.
К 21-м суткам терапии отсутствовали субъективные и объективные признаки болевого синдрома у пациентов обеих групп. Отмечена положительная динамика регресса диспептических явлений к 7-м суткам терапии (у 82,1 % в основной группе и у 82,8 % — в контрольной).
Одним из критериев эффективности лечения были результаты контрольного эндоскопического исследования на 35-е сутки после первичной ВЭГДС. У всех больных после окончания курса терапии отмечено рубцевание язвенного дефекта: язв двенадцатиперстной кишки — у всех пациентов в обеих группах, язв желудка — у 8 больных основной группы и у 9 — контрольной. При визуальной оценке состояния слизистой оболочки гастродуоденальной зоны у пациентов обеих групп отсутствовали признаки активного воспаления (отек, гиперемия, контактная кровоточивость). При морфологической оценке биоптатов отмечено уменьшение воспалительного процесса в основной группе у 88,2 % пациентов, в контрольной — у 88,9 %, уменьшение степени инфильтрации эпителия желудка и собственной пластинки плазматическими клетками, что подтверждает выраженный гастроцитопротективный эффект висмутсодержащих препаратов. Способность препаратов висмута стимулировать биосинтез простагландина Е2, под действием которого повышается образование муцина и выработка бикарбонат-ионов, которые образуют защитный мукозно-бикарбонатный барьер, а также улучшать микроциркуляцию в оболочке антрального отдела желудка и двенадцатиперстной кишки, что способствует улучшению метаболизма на клеточном уровне, приводила к ускорению регенерации клеток и способствовала восстановлению микроструктуры слизистых оболочек, уменьшению количества соляной кислоты. Кроме того, высокие показатели эпителизации язвенных дефектов при назначении схем АХБТ с включением висмута субцитрата достигнуты благодаря вяжущему действию препаратов — способности осаждать белки путем образования с ними хелатных соединений. На поверхности слизистой оболочки желудка и двенадцатиперстной кишки образуется защитная пленка только на участках с эрозивно-язвенными поражениями, что способствует их скорейшему рубцеванию за счет исключения негативного воздействия кислой среды желудка.
На 35-е сутки как в основной, так и в контрольной группе отмечена положительная динамика показателей эрадикационной способности сравниваемых схем АХБТ по данным уреазного (86,7 и 90,0 % соответственно) и стул-теста (у 90,0 и 93,3 %), без статистически значимой разницы между группами. Из всех исходно H.pylori-позитивных пациентов после проведенного лечения хеликобактериоз выявлен у 13,3 % пациентов основной группы и у 10 % — контрольной (табл. 3).
Схемы АХБТ с включением препаратов висмута продемонстрировали высокие показатели эрадикации за счет бактерицидной активности Гастро-Норма в отношении H.pylori, которая оказалась сопоставимой с активностью Де-Нола по результатам данного исследования. Достоверных статистически значимых различий не выявлено.
Несмотря на то что у некоторых пациентов сохранялись положительные результаты тестов на наличие H.pylori, рубцевание язвенного дефекта достигнуто в обеих группах (результаты сопоставимы, статистически значимых различий не выявлено), что подтверждает способность препаратов висмута субцитрата нарушать проницаемость и микроструктуру клеточной мембраны H.pylori, снижая ее жизнеспособность и способность к дальнейшей адгезии и повреждению слизистой оболочки.
При сравнении двух схем АХБТ в исследуемых группах отмечена высокая эффективность терапии — клиническая и эндоскопическая ремиссия заболевания (отсутствие клинических симптомов заболевания, эпителизация язвенного дефекта, отсутствие гиперемии слизистой оболочки желудка при ВЭГДС) (табл. 4).
Выявлена положительная динамика основных клинических синдромов в виде уменьшения частоты встречаемости, продолжительности и интенсивности проявлений диспептического и абдоминально-болевого синдромов.
Использование висмутсодержащих препаратов в составе АХБТ способствовало эпителизации язвенного дефекта в краткие сроки, что достоверно подтверждено ВЭГДС. Полученные результаты у пациентов основной группы, сопоставимые с таковыми в контрольной, позволяют считать отечественный препарат висмута субцитрата Гастро-Норм эффективным и имеющим существенное преимущество по показателю «эффективность — стоимость».
Все больные, принимавшие участие в исследовании, отмечали хорошую переносимость препаратов висмута субцитрата, которую оценивали по субъективным критериям (наличие или отсутствие неприятных ощущений со стороны разных органов и систем, появление побочных эффектов или аллергических реакций после приема препарата (табл. 5)).
При анализе частоты и выраженности побочных эффектов висмутсодержащих препаратов отмечены единичные случаи возникновения таких симптомов, как усиление болей в эпигастрии и боли по ходу кишечника. Наиболее частыми побочными эффектами были изменения стула и метеоризм. Побочные эффекты у пациентов обеих групп исчезли самостоятельно в течение 2 дней, поэтому отмены проводимой терапии не потребовалось.
Комплексная терапия с применением препаратов висмута субцитрата у пациентов с язвенной болезнью, ассоциированной с H.pylori, всеми пациентами оценена как эффективная. Отмечена их высокая приверженность к терапии.
Полученные результаты использования висмутсодержащего препарата как компонента комплексного лечения язвенной болезни, ассоциированной с H.pylori, подтверждают его высокую клиническую эффективность и позволяют считать его важным компонентом АХБТ. Включение в схему стандартной тройной терапии больных язвенной болезнью желудка и ДПК висмута субцитрата позволяет улучшить эффективность лечения и уменьшить нежелательные побочные эффекты.
Проведенное исследование подтвердило активность отечественного препарата висмута субцитрата Гастро-Норм в отношении H.pylori, его способность предотвращать развитие резистентности H.pylori к действию антибиотиков, а также эффективно защищать клетки слизистой оболочки желудка и ДПК от повреждающего действия продуктов воспаления. Низкая частота побочных эффектов и приемлемая цена позволяют рекомендовать его для широкого применения в клинической практике.
На основании полученных результатов можно считать висмута субцитрат перспективным средством, отвечающим современным требованиям, предъявляемым к препаратам с цитопротективными свойствами, что позволяет рекомендовать включить его в состав терапии первой линии язвенной болезни, ассоциированной с H.pylori, для оптимизации и повышения эффективности лечения.
1. Андреев Д.Н., Кучерявый Ю.А. Факторы микро- и макроорганизма, влияющие на эффективность антихеликобактерной терапии // Consilium Medicum. — 2013. — № 8. — С. 5–9.
2. Маастрихт-4: по материалам XXIV Международного семинара по изучению роли Helicobacter и родственных бактерий в развитии хронического воспаления пищеварительного тракта и рака желудка (симпозиум «Маастрихт-4»: Программа. URL: http://www.helicobacter. org/2011/.
3. Маев И.В., Кучерявый Ю.А., Андреев Д.Н. Причины неэффективности антихеликобактерной терапии // РЖГГК. — 2013. — № 6. — С. 62–72.
4. Маев И.В., Самсонов А.А., Андреев Д.Н. и др. Клиническое значение инфекции Helicobacter pylori // Клин. медицина. — 2013. — № 8. — С. 4–12.
5. Осипенко М.Ф., Бикбулатова Е.А., Шакалите Ю.Д., Чернова Л.Н. Резистентность Helicobacter pylori к кларитромицину в Новосибирске // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2012. — № 5 (прил. 40). — С. 36.
6. Скрыпник И.Н. Современная антихеликобактерная терапия: успехи и пути преодоления неудач // Здоров’я України. — 2014. — № 3 (33). — С. 21.
7. De Francesco V., Ierardi E., Hassan C., Zullo A. Helicobacter pylori therapy: Present and future // World J. Gastrointest. Pharmacol. Ther. — 2012. — Vol. 3 (4). — P. 68–73.
8. Gasparetto M., Pescarin M., Guariso G. Helicobacter pylori eradication therapy: current availabilities // ISRN Gastroenterol. — 2012. — 2012. — P. 18673.
9. Malfertheiner P. The intriguing relationship of H.pylori infection and acid secretion in peptic ulcer disease and gastric cancer // Dig. Dis. — 2011. — Vol. 29. — P. 459–464.
10. Megraud F., Coenen S., Versporten A. et al. Helicobacter pylori resistance to antibiotics in Europe and its relationship to antibiotic consumption // Gut. — 2013. — Vol. 62 (1). — P. 34–42.
11. Sonnenberg A. Review article: historic changes of Helicobacter pylori-associated diseases // Aliment. Pharmacol. Ther. — 2013. — Vol. 38. — P. 329–342.
12. Uygun A., Ozel A.M., Sivri B. et al. Efficacy of a modified sequential therapy including bismuth subcitrate as first-line therapy to eradicate Helicobacter pylori in a Turkish population // Helicobacter. — 2012. — Vol. 17 (6). — P. 486–490.
13. Wu W., Yang Y., Sun G. Recent insights into antibiotic resistance in Helicobacter pylori eradication // Gastroenterol. Res. Pract. — 2012. —Vol. 723. — P. 183.
14. Yon J.H., Baik G.H., Kim Y.S. et al. Comparison of the eradication rate between 1st and 2nd week bismuth-containing quadruple rescue therapies for Helicobacter pylori eradication // Gut Liver. — 2012. — Vol. 6 (4). — P. 434–439.
Впервые опубликовано в журнале «Сучасна гастроентерологія», № 1 (81), 2015.

/16_m/16_m.jpg)
/18_m/18_m.jpg)
/18_m/18_m2.jpg)