Журнал «» 1 (39) 2015
Вернуться к номеру
Особенности интра- и экстракраниального кровотока, структурно-геометрическая и функциональная перестройка сердца и состояние вегетативной нервной системы у больных гипертонической болезнью II стадии в зависимости от статуса курильщика
Авторы: Сыволап В.В., Познанская Е.А., Визир Е.В. — Запорожский государственный медицинский университет
Рубрики: Кардиология
Разделы: Клинические исследования
Версия для печати
Систематическое курение табака является серьезной угрозой для здоровья населения, особенно для лиц с повышенным риском сердечно-сосудистых заболеваний. Остаются нерешенными вопросы, в какой степени табакокурение влияет на прогрессирование артериальной гипертензии, нарушение вегетативного баланса, мозговой кровоток, поражение органов-мишеней.
Цель. Анализ особенностей состояния мозгового кровотока, структурно-геометрической и функциональной перестройки сердца, нарушений вегетативного баланса у больных гипертонической болезнью (ГБ) ІІ стадии.
Материал и методы. Обследовано 100 пациентов: 53 мужчины и 47 женщин. Средний возраст пациентов составил 52,51 ± 1,46 года. В зависимости от статуса курения (не менее 10 лет) все пациенты были разделены на 2 группы: в группу курильщиков включено 30 пациентов, в группу некурящих — 70. Всем больным проведено общеклиническое обследование с измерением массы тела и роста, с расчетом индекса массы тела, офисное измерение артериального давления (АД) и частоты сердечных сокращений, лабораторные исследования, суточное мониторирование АД, ультразвуковое исследование экстра- и интракраниальных артерий шеи и головы, определялась вариабельность сердечного ритма, выполнялась трансторакальная эхокардиоскопия.
Результаты. У больных ГБ, имеющих статус курильщика, выявлено статистически достоверное увеличение мощности спектра в диапазоне низких частот на 16,5 % (р = 0,04), снижение мощности спектра в диапазоне высоких частот на 18,2 % (р = 0,04), увеличение симпатовагального индекса на 70,0 % (р = 0,01), повышение среднесуточного систолического АД (САД) на 6,5 % (р = 0,04) и среднесуточного диастолического АД (ДАД) на 7,9 % (р = 0,04), размера левого предсердия в диастолу на 8,1 % (р = 0,014), в систолу на 10,8 % (р = 0,026), толщины задней стенки левого желудочка (ЛЖ) сердца на 6,1 % (р = 0,028), толщины межжелудочковой перегородки в диастолу на 11,6 % (р = 0,004), в систолу на 10,7 % (р = 0,034), индекса массы миокарда ЛЖ на 12,2 % (р = 0,034), диастолического внутримио-кардиального напряжения на 13,9 % (р = 0,025), удлинение периода изометрического расслабления на 33,3 % (р = 0,026), индекса сосудистого сопротивления в русле правой общей сонной артерии (ОСА) на 3,3 % (р = 0,033), в русле правой средней мозговой артерии (СМА) на 8,5 % (р = 0,05), в бассейне левой СМА на 7,1 % (р = 0,042), превышение показателя «резерв вазоконстрикции» в 4,63 раза (р = 0,029) в бассейне левой внутренней сонной артерии (ВСА) и в 3,01 раза (р = 0,031) — в русле правой ВСА. Получено достоверное повышение у женщин-курильщиц по сравнению с мужчинами-курильщиками индекса сопротивления в ВСА справа на 10,8 % (0,65 ± 0,02 у.е. против 0,58 ± 0,01 у.е.; р = 0,03) и максимальной линейной скорости кровотока в ВСА слева на 22,0 % (2,88 ± 0,08 см/с против 2,36 ± 0,04 см/с; р = 0,05). При этом у женщин-курильщиц наблюдались достоверно меньшие значения систолодиасто-
лического индекса в русле ОСА справа на 8,7 % (3,55 ± 0,19 у.е. против 3,86 ± 0,16 у.е.; р = 0,027) и индекса сопротивления в русле левой СМА на 4,9 %, чем у мужчин-курильщиков (0,450 ± 0,034 у.е. против 0,472 ± 0,024 у.е.; р = 0,027).
Выводы. Курение у гипертоников ассоциируется с повышением активности симпатического и угнетением парасимпатического звеньев вегетативной нервной системы. Курильщики, страдающие ГБ, имеют достоверно более высокие цифры среднесуточного САД на 6,5 % (р = 0,04), среднесуточного ДАД на 7,9 % (р = 0,04) по сравнению с некурящими больными с ГБ. Модулирующее влияние курения на процессы патологического ремоделирования сердца у гипертоников проявляется в увеличении систолического и диастолического размеров левого предсердия, толщины стенок и массы миокарда левого желудочка, без расширения полостей сердца, при этом наблюдается увеличение диастолического внутримиокардиального напряжения левого желудочка. Структурная перестройка сердца у гипертоников под влиянием табакокурения создает условия для снижения активной релаксации и изменения диастолического наполнения левого желудочка: увеличения вклада позднего наполнения и удлинения времени изометрического расслабления. Нарушения мозгового кровотока у больных гипертонической болезнью, имеющих статус курильщика, по сравнению с некурящими гипертониками характеризуются более выраженным спазмом артерий каротидного бассейна, о чем свидетельствует повышение индексов сосудистого сопротивления и показателя «резерв вазоконстрикции» в общих сонных и средних мозговых артериях у курильщиков. Показатели кровотока в вертебробазилярном бассейне у курящих и некурящих гипертоников достоверно не различаются. Гендерные различия показателей допплерографии магистральных артерий шеи и головы у больных гипертонической болезнью, имеющих статус курильщика, характеризуются более высоким сосудистым сопротивлением в общих и внутренних сонных артериях у женщин, в средних мозговых артериях у мужчин.
Систематичне паління тютюну є серйозною загрозою для здоров’я населення, особливо для осіб, які мають підвищений ризик серцево-судинних захворювань. Залишаються невирішеними питання, якою мірою тютюнопаління впливає на прогресування артеріальної гіпертензії, порушення вегетативного балансу, мозковий кровоток, ураження органів-мішеней.
Мета. Аналіз особливостей стану мозкового кровотоку, структурно-геометричної та функціональної перебудови серця, порушень вегетативного балансу у хворих на гіпертонічну хворобу (ГХ) ІІ стадії.
Матеріал і методи. Обстежено 100 пацієнтів: 53 чоловіки і 47 жінок. Середній вік пацієнтів становив 52,51 ± 1,46 року. Залежно від статусу паління (не менше 10 років) усі пацієнти були розподілені на 2 групи: до групи курців увійшло 30 пацієнтів, до групи осіб, які не палять, — 70. Усім хворим проведено загальноклінічне обстеження з вимірюванням маси тіла і зросту, з розрахунком індексу маси тіла, офісне вимірювання артеріального тиску (АТ) і частоти серцевих скорочень, лабораторні дослідження, добове моніторування АТ, ультра-
звукове дослідження екстра- та інтракраніальних артерій шиї і голови, трансторакальна ехокардіоскопія, визначалася варіабельність серцевого ритму.
Результати. У хворих на ГХ, які мають статус курця, виявлено статистично достовірне збільшення потужності спектра в діапазоні низьких частот на 16,5 % (р = 0,04), зниження потужності спектра в діапазоні високих частот на 18,2 % (р = 0,04), збільшення симпатовагального індексу на 70,0 % (р = 0,01), підвищення середньодобового систолічного АТ (САТ) на 6,5 % (р = 0,04) і середньодобового діастолічного АТ (ДАТ) на 7,9 % (р = 0,04), розміру лівого передсердя в діастолу на 8,1 % (р = 0,014), в систолу на 10,8 % (р = 0,026), товщини задньої стінки лівого шлуночка (ЛШ) серця на 6,1 % (р = 0,028), товщини міжшлуночкової перетинки у діастолу на 11,6 % (р = 0,004), товщини міжшлуночкової перетинки у систолу на 10,7 % (р = 0,034), індексу маси міокарда ЛШ на 12,2 % (р = 0,034), діастолічного внутрішньоміокардіального напруження на 13,9 % (р = 0,025), подовження періоду ізометричного розслаблення на 33,3 % (р = 0,026), індексу судинного опору в руслі правої загальної сонної артерії (ЗСА) на 3,3 % (р = 0,033), у руслі правої середньої мозкової артерії (СМА) на 8,5 % (р = 0,05), у басейні лівої СМА на 7,1 % (р = 0,042), перевищення показника «резерв вазоконстрикції» у 4,63 рази (р = 0,029) у басейні лівої внутрішньої сонної артерії (ВСА) і в 3,01 рази (р = 0,031) — у руслі правої ВСА. Отримано достовірне підвищення у жінок-курців порівняно з чоловіками-курцями індексу опору у ВСА праворуч на 10,8 %, (0,65 ± 0,02 у.о. проти 0,58 ± 0,01 у.о.; р = 0,03), максимальної лінійної швидкості кровотоку у ВСА ліворуч на 22,0 % (2,88 ± 0,08 см/с проти 2,36 ± 0,04 см/с; р = 0,05). При цьому у жінок-курців спостерігалися достовірно менші значення систолодіастолічного індексу в руслі ЗСА праворуч на 8,7 % (3,55 ± 0,19 у.о. проти 3,86 ± 0,16 у.о.; р = 0,027) та індексу опору в руслі лівої СМА на 4,9 %, ніж у чоловіків-курців (0,450 ± 0,034 у.о. проти 0,472 ± 0,024 у.о.; р = 0,027).
Висновки. Куріння у хворих на ГХ асоціюється з підвищенням активності симпатичної та пригніченням парасимпатичної ланок вегетативної нервової системи. Курці, які страждають від ГХ, мають достовірно більш високі цифри середньодобового САТ на 6,5 % (р = 0,04), середньодобового ДАТ на 7,9 % (р = 0,04) порівняно з хворими на ГХ, які не палять. Модулюючий вплив паління на процеси патологічного ремоделювання серця у хворих на ГХ проявляється у збільшенні систолічного і діастолічного розмірів лівого передсердя, товщини стінок і маси міокарда лівого шлуночка, без розширення порожнин серця, при цьому спостерігається збільшення діастолічного внутрішньоміокардіального напруження лівого шлуночка. Структурна перебудова серця у хворих на ГХ під впливом тютюнопаління створює умови для зниження активної релаксації і зміни діастолічного наповнення лівого шлуночка: збільшення вкладу пізнього наповнення і подовження часу ізометричного розслаблення. Порушення мозкового кровотоку у хворих на ГХ, які мають статус курця, порівняно з хворими, які не палять, характеризуються більш вираженим спазмом артерій каротидного басейну. Показники кровотоку в вертебробазилярному басейні достовірно не розрізняються в групах. Гендерні відмінності показників допплерографії магістральних артерій шиї і голови у хворих на гіпертонічну хворобу, які мають статус курця, характеризуються більш високим судинним опором у загальних і внутрішніх сонних артеріях у жінок, у середніх мозкових артеріях у чоловіків.
Systematic tobacco smoking is a serious public health threat, especially in individuals who have an increased risk of cardiovascular diseases. Questions about the extent, in which smoking affects the progression of the hypertension, impaired autonomic balance, cerebral blood flow, target organ damage, remain unsolved.
Objective. Analysis of the specific features of the cerebral blood flow, structural-geometrical, functional reconstruction of the heart, autonomic imbalance in patients with essential hypertension (EH) stage II.
Material and Methods. The study involved 100 patients: 53 men and 47 women. The average age of the patients was 52.51 ± 1.46 years. Depending on the smoking status (at least 10 years), all patients were divide into 2 groups: group of smokers included 30 patients, group of non-smokers — 70. All patients underwent clinical examination with measurement of body weight and height, with the calculation body mass index, office measurement of blood pressure (BP) and heat rate, laboratory tests, ambulatory BP monitoring, ultrasound of the extra- and intracranial arteries of the neck and head, heart rate variability was determined, transthoracic echocardioscopy was performed.
Results. Hypertensive smokers revealed a statistically significant increase in low frequency by 16.5 % (p = 0.04), a decrease in high frequency by 18.2 % (p = 0.04), and increased sympathovagal index by 70.0 % (p = 0.01), the predominance of average daily systolic BP (SBP) by 6.5 % (p = 0.04) and average daily diastolic BP (DBP) by 7.9 % (p = 0.04), the size of the left atrium in diastole by 8.1 % (p = 0.014), in systole — by 10.8 % (p = 0.026), thickness of posterior left ventricular (LV) wall by 6.1 % (p = 0.028), interventricular septum thickness in diastole by 11.6 % (p = 0.004), interventricular septum thickness in systole by 10.7 % (p = 0.034), LV mass index by 12.2 % (p = 0.034), diastolic intramyocardial tension by 13.9 % (p = 0.025), lengthening of the period of isometric relaxation by 33.3 % (p = 0.026), resistivity index in the right common carotid artery (CCA) by 3.3 % (p = 0.033), in the middle cerebral artery (MCA) by 8.5 % (p = 0.05), in the left MCA by 7.1 % (p = 0.042), exceeding «vasoconstriction reserve» indicator by 4.63 times (p = 0.029) in the internal carotid artery (ICA) and by 3.01 times (p = 0.031) in the right ICA. We have obtained a significant predominance of female smokers compared with male smokers in terms of resistivity index in the right ICA by 10.8 % (0.65 ± 0.02 c.u. vs 0.58 ± 0.01 c.u.; p = 0.03) and maximum linear blood flow velocity in ICA on the left by 22.0 % (2.88 ± 0.08 cm/s vs 2,36 ± 0.04 cm/s, p = 0.05). At the same time, female smokers reported significantly lower values of systolic and diastolic index in the CCA on the right by 8.7 % (3.55 ± 0.19 c.u. vs 3.86 ± 0.16 c.u.; p = 0.027), and resistivity index in the left MCA by 4.9 % than that of male smokers (0.450 ± 0.034 c.u. vs 0.472 ± 0.024 c.u.; p = 0.027).
Conclusions. Smoking in hypertensive patients is associated with increased activity of the sympathetic part and decreased of parasympathetic part of autonomic nervous system. Hypertensive smokers have significantly higher average daily SBP by 6.5 % (p = 0.04), the average daily DBP by 7.9 % (p = 0.04) compared with non-smokers patients with EH. The modulating effect of smoking on the pathological cardiac remodeling in hypertensive patients results in increased systolic and diastolic dimensions of the left atrium, wall thickness and left ventricular mass, without dilation of cardiac cavities, with an increase in diastolic left ventricular intramyocardial tension. Changes of the heart in hypertensive patients under the influence of smoking enable the reduction of the active relaxation and changes in left ventricular diastolic fil-
ling: increase the contribution of late filling and lengthening of isometric relaxation time. Cerebral blood flow acute disturbances in hypertensive smokers compared with hypertensive non-smokers are characterized by a more pronounced spasm of the carotid arteries, as evidenced by the prevalence of vascular resistivity index and «vasoconstriction reserve» indicator in the common carotid and middle cerebral arteries in smokers. Blood flow parameters in vertebrobasilar system in hypertensive smokers and non-smokers have not significant changes. Gender differences at Doppler ultrasonography of the great vessels of the neck and head in smokers with EH are characterized by a higher vascular resistance in the common and internal carotid arteries in women, and in the middle cerebral arteries in men.
гипертоническая болезнь, табакокурение, поражение органов-мишеней.
гіпертонічна хвороба, тютюнопаління, ураження органів-мішеней.
essential hypertension, smoking, target organ damage.
Статья опубликована на с. 47-59
По данным эпидемиологических исследований, стойкое повышение артериального давления (АД) регистрируют у 15–30 % взрослого населения [2]. В последние годы в структуре артериальной гипертензии (АГ) растет доля лиц с сочетанием эндогенных факторов риска: ожирения, дислипидемии, нарушений углеводного обмена [10]. Высока распространенность курения среди молодых пациентов, страдающих АГ [7].
Факторы кардиоваскулярного риска оказывают значимое влияние на прогрессирование АГ, развитие атеросклероза, формирование ишемической болезни сердца (ИБС), возникновение ассоциированных клинических состояний [20]. Однако исследований, посвященных изучению влияния табакокурения на структурно–геометрическую и функциональную перестройку сердца, недостаточно [25].
Анализ данных литературы свидетельствует о малочисленности и противоречивости сведений об изменении функционального состояния различных систем организма при стаже курения более 5 лет. Cообщается о повышении тонуса симпатического отдела вегетативной нервной системы (ВНС), что проявляется в росте частоты сердечных сокращений (ЧСС) и АД [11, 22, 30], а также о повышении ударного и минутного объема крови [1, 36], сердечного индекса [1] и индекса напряжения миокарда [30].
Ряд авторов отмечает повышение тонуса мозговых сосудов и снижение их кровенаполнения при курении [6], а другие, наоборот, указывают на снижение тонуса мозговых сосудов (особенно мелких разветвлений артериол и венул), периферического сопротивления и улучшение венозного оттока [5].
В работе [5] сообщается, что при выкуривании очередной сигареты снижается интенсивность мозгового кровотока. В то же время в исследовании [4] показано, что выкуривание очередной сигареты у курящих девушек улучшает интенсивность мозгового кровотока за счет снижения тонуса средних и мелких артерий и вен. Улучшение мозгового кровотока рассматривается авторами в качестве «награды» за курение.
Несмотря на то, что курение сигарет в значительной мере оказывает неблагоприятное воздействие на здоровье человека, существуют противоречивые данные о влиянии курения на уровень артериального давления, массу тела, сосудистое воспаление. По данным L.A. Bazzano (2003), с курением было связано повышение биомаркеров воспаления и хронического системного воспаления [14]. E.A. Bermudez и соавт. (2002) отмечают повышение уровня воспалительных биомаркеров как у бывших, так и у нынешних курильщиков [15] и более высокий исходный уровень С-реактивного белка, которые связаны с повышенным риском последующего развития гипертензии [31].
В то же время отказ от курения может уменьшать воспаление [12], но привести к увеличению массы тела [26], что, в свою очередь, вызывает повышение артериального давления и увеличение степени гипертензии у больных ГБ [21].
Есть несколько других потенциальных биологических механизмов, посредством которых воздействие сигаретного дыма может привести к повышению артериального давления [17, 28]. Долгосрочное курение приводит к нарушениям коронарного и мозгового кровотока, которые могут быть связаны с нарушениями сосудистого эндотелия [16]. Курение увеличивает жесткость артерий, особенно выражены данные изменения у хронических курильщиков [23]. Курение у лиц молодого возраста связано с артериальной гипертензией и ассоциируется с увеличением толщины интимы-медиа общей сонной артерии (ОСА) в зрелом возрасте [29]. Курение у взрослых связано с прогрессированием атеросклероза, и эти негативные последствия носят кумулятивный и необратимый характер [20], однако долгосрочные эффекты курения полностью не выяснены [35].
Остаются также открытыми вопросы, в какой степени табакокурение влияет на прогрессирование артериальной гипертензии [25], нарушение вегетативного баланса, мозговой кровоток, поражение органов-мишеней.
Цель работы: изучить влияние фактора риска кардиоваскулярных заболеваний курения на состояние вегетативного баланса, суточный профиль артериального давления, структурно-геометрическую и функциональную перестройку сердца, состояние мозгового кровотока у больных гипертонической болезнью II стадии.
Пациенты и методы исследования
Нами обследовано 100 больных гипертонической болезнью II стадии: 53 мужчины и 47 женщин. Исследование проводилось на клинической базе кафедры пропедевтики внутренних болезней с уходом за больными КУ «6-я городская клиническая больница» г. Запорожья. Проведение исследования согласовано с локальным этическим комитетом ЗГМУ. До начала исследования каждый пациент проходил процедуру подписания информированного согласия на участие в исследовании. В зависимости от статуса курения (не менее 10 лет) все пациенты были разделены на 2 группы: в группу курильщиков включено 30 пациентов, в группу некурящих — 70. Группы больных были сопоставимы по возрасту, полу, индексу массы тела, уровню тощаковой глюкозы, величине офисного систолического АД (САД), диастолического АД (ДАД), пульсового АД (ПАД), среднего АД, ЧСС (табл. 1).
Всем больным согласно протоколу оказания медицинской помощи больным гипертонической болезнью (Приказ Министерства охраны здоровья Украины № 436 от 03.07.2006) проведено общеклиническое обследование с измерением массы тела и роста, с расчетом индекса массы тела, офисное измерение АД и ЧСС, лабораторные исследования. Дополнительно, в соответствии с поставленными задачами, всем больным проводилось суточное мониторирование АД на аппарате Meditech CardioTens и с использованием программы Medibase (Кишпешт, Венгрия), определялась вариабельность сердечного ритма с помощью диагностической системы CardioLab 2000, трансторакальная эхокардиоскопия выполнена на ультразвуковом диагностическом приборе MyLab 50 (Esaote, Италия) с использованием фазированного датчика 2,5 мГц.
Всем больным также проводили ультразвуковое исследование экстра- и интракраниальных артерий шеи и головы с использованием аппарата MyLab 50 (Италия) датчиками 7,5 и 2,5 мГц. Для оценки мозговой гемодинамики применяли дуплексное сканирование внутренних сонных артерий (ВСА); ультразвуковую допплерографию позвоночных артерий; транскраниальную допплерографию средних мозговых артерий (СМА) с цветным картированием. Исследовался кровоток в парных артериях. Ультразвуковое исследование сонных артерий выполняли в режиме линейного В-сканирования зондом 7,5 МГц в 2 проекциях: продольной и поперечной.
Определяли следующие показатели, характеризующие мозговую гемодинамику: среднюю (М), систолическую (S — systolic blood flow velocity) и диастолическую (D — diastolic blood flow velocity) скорости кровотока, пульсовой индекс (PI = (S – D) / M – pulse index) — индекс Гослинга, отражающий упруго-пластические свойства (плотность) сосудистой стенки; индекс сопротивления Пурсело (RI = (S – D) / S – resistance index), отражающий общее периферическое сосудистое сопротивление и свидетельствующий о тонусе и сопротивлении интра- и экстракраниальных сосудов; индексы сосудистой реактивности, чувствительные к гиперкапнии (СO2) и гипоксии (O2).
Систолическая скорость кровотока (S) и отношение систолической скорости к диастолической — индекс Стюарта (ISD = S / D – Stuart index) характеризуют скоростные параметры гемодинамики в зависимости от степени выраженности стенотических проявлений, если таковые имеются.
Статистическая обработка материала проводилась при помощи пакета программ Statistica 6.0 (Statsoft, США, № AXXR712D833214FAN5). После проверки гипотезы о нормальности распределения переменных (Shapiro-Wilk W-test) использовались методы параметрической (t-test для зависимых и независимых переменных, однофакторный дисперсионный анализ ANOVA, парная корреляция Пирсона) и непараметрической (Wald-Wolfowitz runs test, Kolmogorov-Smirnov two-sample test, Mann-Whitney U-test, корреляция Spearman) статистики. Различия считали статистически достоверными при значении p < 0,05.
Результаты и их обсуждение
Курение и вегетативный баланс. У больных ГБ, имеющих статус курильщика (табл. 2), выявлено статистически достоверное увеличение мощности спектра в диапазоне низких частот (рис. 1) на 16,5 % (р = 0,04), снижение мощности спектра в диапазоне высоких частот (рис. 2) на 18,2 % (р = 0,04), увеличение симпатовагального индекса (рис. 3) на 70,0 % (р = 0,01) по сравнению с аналогичными показателями у больных ГБ без статуса курильщика.
Полученные данные свидетельствует о значительной активации симпатического звена ВНС и угнетении парасимпатического звена ВНС у курильщиков.
Полученные нами результаты согласуются с данными литературы. По мнению авторов [13, 31], курение вызывает активацию симпатической нервной системы, оксидативный стресс и острые вазопрессорные эффекты [13], которые связаны с увеличением маркеров воспаления [25], связанных с гипертензией [31].
Хроническое курение также может привести к развитию эндотелиальной дисфункции [24, 32], сосудистым повреждениям, повышению жесткости артерий [23], которая приводит к развитию гипертонии [27].
/51/51.jpg)
Нами выявлена обратная корреляционная связь между мощностью спектра в диапазоне низких частот и среднесуточным САД (r = –0,41; р = 0,036) (рис. 4), и среднесуточным ДАД (r = –0,38; p = 0,048) (рис. 5).
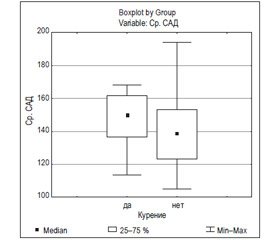
Следует отметить, что у больных ГБ, имеющих статус курильщика, наблюдалось статистически достоверное повышение среднесуточного САД на 6,5 % (р = 0,04) (рис. 6) и среднесуточного ДАД на 7,9 % (р = 0,04) (рис. 7) по сравнению с аналогичными показателями суточного мониторирования АД у некурящих больных ГБ (табл. 3).
Данные литературы указывают на связь курения и артериальной гипертензии. В крупном популяционном исследовании [28] в Англии была обнаружена независимая ассоциация между курением и уровнем артериального давления.
Проспективное исследование [17] среди мужчин среднего возраста в Финляндии подтвердило гипотезу, что курение может быть фактором риска при гипертензии, однако исследование было проведено на небольшой выборке (n = 379). Полученные нами результаты указывают на факт связи курения и артериальной гипертензии у лиц, страдающих ГБ, независимо от пола пациентов.
Таким образом, наличие такого мощного фактора сердечно-сосудистого риска, как курение у больных гипертонической болезнью, приводит к гиперактивации симпато-адреналовой системы, угнетению парасимпатического звена ВНС и, как следствие, к достоверному повышению среднесуточного САД и ДАД. Показатели суточного мониторирования АД (среднесуточные САД и ДАД) имеют обратную корреляционную связь с показателем парасимпатической активности ВНС — мощностью спектра в диапазоне высоких частот (HF).
Курение и структурно-геометрическая и функциональная перестройка сердца. У больных ГБ, которые имели статус курильщика, по данным трансторакальной эхокардиоскопии (табл. 4), выявлен достоверно больший размер левого предсердия в диастолу на 8,1 % (р = 0,014), в систолу — на 10,8 % (р = 0,026). При этом показатель сократительной способности левого предсердия (фракция опорожнения) у курящих и некурящих гипертоников не имел статистически достоверных различий (25,45 ± 1,41 против 27,74 ± 1,07 соответственно, р = 0,222), хотя и прослеживалась тенденция к снижению ФОЛП у курильщиков.
Группы курящих и некурящих гипертоников не различались по показателям конечных диастолических и систолических размеров и объемов левого желудочка и фракции выброса.
У больных ГБ, имеющих статус курильщика (табл. 4), выявлена большая степень выраженности гипертрофии миокарда левого желудочка, о чем свидетельствует достоверное увеличение толщины задней стенки левого желудочка в систолу (ТЗСЛЖс) на 6,1 % (р = 0,028), толщины межжелудочковой перегородки в систолу (ТМЖПд) на 11,6 % (р = 0,004), толщины межжелудочковой перегородки в диастолу (ТМЖПс) на 10,7 % (р = 0,034), индекса массы миокарда левого желудочка (ИММЛЖ) на 12,2 % (р = 0,034). Также отмечалась тенденция к увеличению толщины задней стенки левого желудочка в диастолу (ТЗСЛЖд), однако данная разница была статистически недостоверной.
Полученные данные указывают на увеличение индекса массы миокарда левого желудочка у курящих гипертоников преимущественно за счет утолщения стенок при неизмененных объемных показателях левого желудочка.
Увеличение индекса массы миокарда левого желудочка у курящих гипертоников сопровождалось достоверным повышением диастолического внутримиокардиального напряжения (ВМН) на 13,9 % (р = 0,025) по сравнению с аналогичным показателем у некурящих гипертоников.
По данным А.В. Поддубной (2009), курение у больных АГ вызывает статистически достоверное повышение диастолического миокардиального стресса и доминирование диастолического напряжения стенки ЛЖ в компенсации его функции. Курение у больных АГ, по мнению автора, способствует развитию эксцентрической гипертрофии (26 % у курящих больных, 4 % у некурящих больных АГ) [9].
Анализ полученных нами показателей трансмитрального кровотока выявил достоверное удлинение периода изометрического расслабления у курящих гипертоников на 33,3 % (р = 0,026) по сравнению с показателем IVRT у некурящих гипертоников. Линейные и интегральные показатели раннего и позднего наполнения левого желудочка и их соотношения у больных гипертонической болезнью со статусом и без статуса курильщика не различались достоверно.
Данные литературы указывают на влияние активного и пассивного курения на диастолическую функцию левого желудочка у практически здоровых лиц. Так, в исследовании А. Dogan [18] диастолическая функция ЛЖ существенно изменялась сразу после пассивного курения. Трансмитральная волна Е (0,89 ± 0,12 м/с против 0,70 ± 0,14 м/с, р = 0,001), легочная венозная волна D (0,52 ± 0,12 м/с против 0,49 ± 0,13 м/с, р = 0,01) и трансмитральное соотношение E/А (1,79 ± 0,48 против 1,47 ± 0,32, р = 0,001) снижались, в то время как скоростные и интегральные показатели трансмитрального потока не изменялись. Скорость митрального кольца Em снижалась (12,5 ± 2,1 см/с против 11,7 ± 1,9 см/с, р = 0,001), а скорость Am увеличивалась (6,3 ± 2,1 см/с против 6,8 ± 1,6 см/с, р = 0,001), и соответственно соотношение Em/Am снижалось (2,28 ± 0,82 против 1,78 ± 0,42, р = 0,001).
Цветное допплеровское картирование [18] определило ухудшение диастолической функции только у женщин, тогда как цветная тканевая допплерэхокардиография продемонстрировала диастолическую дисфункцию у лиц обоих полов. Острое негативное воздействие пассивного курения на параметры цветной допплеровской эхокардиографии было более заметным у женщин. Изменение волны E было связано с изменениями частоты сердечных сокращений, систолического артериального давления, уровня карбоксигемоглобина, в то время как изменение Em было связано только с уровнем карбоксигемоглобина.
В другом исследовании [19] (Ventricular diastolic function: cigarette smoking versus nicotine gum) изучались острые последствия курения на диастолическую функцию у здоровых пациентов и сравнивались последствия воздействия бездымной доставки никотина (никотиновая жевательная резинка) на диастолическую функцию ЛЖ. Получены эхокардиографические доказательства диастолической дисфункции ЛЖ после выкуривания сигареты. Отношение E/А снижалось с 2,95 до 2,22 (р < 0,002). Предсердное изменение легочного кровотока, предсердное изменение продолжительности и распространения цветового потока также показало статистически существенные изменения (р < 0,05). Когорта, жующая резинку с никотином, не показала никаких изменений традиционных диастолических параметров наполнения ЛЖ. Авторы пришли к выводу, что диастолическая функция нарушается во время острого воздействия сигаретного дыма, но не изменяется после воздействия никотиновой жевательной резинки. Маловероятно, что только никотин отвечает за сигарет-индуцированную острую диастолическую дисфункцию ЛЖ.
В 1990 году Т. Stork et al. предприняли первое исследование по изучению влияния курения на диастолическую функцию левого желудочка. В исследование вошел 21 курильщик с ангиографически подтвержденным заболеванием коронарных артерий (ИБС). Эхокардиографию проводили до и после курения одной сигареты. Результаты показали статистически значимое уменьшение отношения VE/VA и IE/IA, увеличение IVRT [33, 34].
Полученные нами результаты свидетельствуют об аналогичном влиянии табакокурения на диастолическую функцию ЛЖ и у гипертоников. Наблюдается достоверное удлинение времени изометрического расслабления левого желудочка.
Курение и мозговой кровоток. Анализ полученных данных (табл. 5) свидетельствует о достоверном повышении индекса сосудистого сопротивления в русле правой ОСА на 3,3 % (р = 0,033), в русле правой СМА на 8,5 % (р = 0,05), в бассейне левой СМА на 7,1 % (р = 0,042) у больных артериальной гипертензией, имеющих статус курильщика, по сравнению с аналогичными показателями у некурящих гипертоников.
Показатель сосудистого сопротивления в бассейне левой ОСА имел лишь тенденцию к увеличению у курящих — 0,742 ± 0,008 против 0,735 ± 0,010 у некурящих гипертоников (р = 0,643).
Достоверное повышение индексов сопротивления в общих сонных артериях и средних мозговых артериях у курящих гипертоников сопровождалось тенденцией к увеличению линейных скоростей кровотока в названных сосудах. Эти изменения указывают на наличие более выраженного спазма магистральных артерий шеи и головы у больных артериальной гипертензией со статусом курильщика.
У курящих гипертоников также выявлено статистически значимое превышение показателя «резерв вазоконстрикции» в 4,63 раза (р = 0,029) в бассейне левой ВСА и в 3,01 раза (р = 0,031) — в русле правой ВСА по сравнению с данными показателями у некурящих гипертоников. Полученные результаты свидетельствуют о более выраженном спазме внутренних сонных артерий у курильщиков с артериальной гипертензией.
Показатели кровотока в вертебробазилярном бассейне не имели достоверных различий у курящих и некурящих гипертоников.
Нам не удалось найти данные, отражающие изменение показателей мозгового кровотока под влиянием табакокурения у больных ГБ.
В то же время имеются сообщения о влиянии курения на мозговой кровоток у подростков обоих полов [3, 4, 8]. Так, по данным [4], до выкуривания очередной сигареты курящие девушки отличаются от некурящих более высоким тонусом мозговых сосудов (преимущественно в бассейне правой позвоночной артерии), более низкой эффективностью венозного оттока в бассейне правой сонной артерии и более выраженной асимметрией мозгового кровотока в передних и задних отделах мозга.
До выкуривания очередной сигареты курящие юноши отличаются от курящих девушек более низкой активностью симпатического отдела ВНС, более низкими резервными возможностями сердца и более низким тонусом мелких артерий, артериол и прекапилляров, посткапилляров, венул и вен мозга [5].
Выкуривание очередной сигареты у юношей повышает интенсивность мозгового кровотока, преимущественно в левом полушарии, что обусловлено снижением тонуса средних и мелких артерий, артериол, прекапилляров, посткапилляров, венул и вен мозга. Снижение тонуса мозговых сосудов объясняется релаксирующим влиянием СО2 и СО на гладкие мышцы сосудов мозга [3].
В то же время выкуривание очередной сигареты затрудняет венозный отток в левом полушарии (до 126,1–129,9 %), что авторы объясняют повышением интенсивности мозгового кровотока. Рост мозгового кровотока при выкуривании очередной сигареты можно расценивать как фактор, способствующий формированию курительного поведения [3].
У юношей реакция со стороны мозговой гемодинамики, то есть улучшение мозгового кровотока в ответ на выкуривание очередной сигареты, выражена в меньшей степени, чем у девушек [3, 4].
Результаты наших исследований у гипертоников выявили следующие гендерные различия показателей допплерографии магистральных артерий шеи и головы. Так, получено достоверное повышение у женщин-курильщиц по сравнению с мужчинами-курильщиками индекса сопротивления во ВСА справа на 10,8 % (0,65 ± 0,02 у.е. против 0,58 ± 0,01 у.е.; р = 0,03) и максимальной линейной скорости кровотока во ВСА слева на 22,0 % (2,88 ± 0,08 см/с против 2,36 ± 0,04 см/с; р = 0,05). При этом у женщин-курильщиц наблюдались достоверно меньшие значения систолодиастолического индекса в русле ОСА справа на 8,7 % (3,55 ± 0,19 у.е. против 3,86 ± 0,16 у.е.; р = 0,027), индекса сопротивления в русле левой СМА на 4,9 %, чем у мужчин-курильщиков (0,450 ± 0,034 у.е. против 0,472 ± 0,024 у.е.; р = 0,027).
Остальные показатели мозгового кровотока у гипертоников со статусом курильщика не имели статистически достоверных гендерных различий.
Полученные данные у больных гипертонической болезнью свидетельствуют о более высоком сосудистом сопротивлении в общих и внутренних сонных артериях у женщин-курильщиц, а в средних мозговых артериях — у курящих мужчин-гипертоников.
Выводы
1. Курение у гипертоников ассоциируется с повышением активности симпатического на 16,5 % (р = 0,04) и угнетением парасимпатического на 70,0 % (р = 0,01) звеньев ВНС. Выявлена обратная корреляционная связь между тонусом парасимпатического звена ВНС и уровнем среднесуточного САД (r = –0,41; р = 0,036) и ДАД (r = –0,38; p = 0,048).
2. Гиперсимпатикотония у курильщиков, страдающих ГБ, сопровождается статистически значимым изменением значений показателей суточного мониторирования АД, характеризующимся достоверным повышением среднесуточного САД на 6,5 % (р = 0,04), среднесуточного ДАД на 7,9 % (р = 0,04) по сравнению с некурящими больными с ГБ.
3. Модулирующее влияние курения на процессы патологического ремоделирования сердца у гипертоников проявляется в увеличении систолического и диастолического размеров левого предсердия, толщины стенок и массы миокарда левого желудочка, без расширения полостей сердца, при этом наблюдается увеличение диастолического внутримиокардиального напряжения левого желудочка.
4. Структурная перестройка сердца у гипертоников под влиянием табакокурения создает условия для снижения активной релаксации и изменения диастолического наполнения левого желудочка: увеличения вклада позднего наполнения и удлинения времени изометрического расслабления.
5. Нарушения мозгового кровотока у больных гипертонической болезнью, имеющих статус курильщика, по сравнению с некурящими гипертониками характеризуются более выраженным спазмом артерий каротидного бассейна, о чем свидетельствует повышение индексов сосудистого сопротивления и показателя «резерв вазоконстрикции» в общих сонных и средних мозговых артериях у курильщиков. Показатели кровотока в вертебробазилярном бассейне достоверно не различаются у курящих и некурящих гипертоников.
6. У больных гипертонической болезнью, имеющих статус курильщика, наиболее чувствительными показателями допплерографии магистральных артерий шеи и головы являются индексы сопротивления Пурсело в общих сонных и средних мозговых артериях, а также показатель цереброваскулярной реактивности во внутренней сонной артерии.
7. Гендерные различия показателей допплерографии магистральных артерий шеи и головы у больных гипертонической болезнью, имеющих статус курильщика, характеризуются более высоким сосудистым сопротивлением в общих и внутренних сонных артериях у женщин, в средних мозговых артериях у мужчин.
1. Андреева В.М. Дифференцированный эколого-физиологический подход к диагностике и коррекции дизадаптации отягощенных табакокурением при информационной нагрузке в вузе: Автореф. дис… к.б.н. — Ульяновск: УлГУ, 2006. — 22 с.
2. Артериальная гипертензия и сердечно-сосудистый риск / [Багрий А.Э., Дядык О.И., Жаринов О.И. и др.]; под ред. Ю.Н. Сиренко, О.И. Жаринова. — К.: Четверта хвиля, 2009. — 384 с.
3. Власова О.В. Изменения центральной гемодинамики и мозгового кровотока при курении у студентов / О.В. Власова, Г.А. Попова, А.В. Ковальногов [и др.] // Вестник НГУ. Серия: Биология, клиническая медицина. — 2008. — Т. 6, вып. 3. — С. 48–55.
4. Власова О.В. Показатели центральной гемодинамики и мозгового кровотока у женщин при курении / О.В. Власова, Г.А. Попова, В.И. Циркин // Вопросы наркологии. — 2008. — № 5. — С. 77–86.
5. Герман А.К. Мозговой кровоток у курящих / А.К. Герман, В.Л. Логийко // Лік. справа. — 1995. — № 1–2. — С. 123–125.
6. Ишекова Н.И. Изменение церебральной гемодинамики у курящих женщин с различной массой тела, проживающих на Европейском Севере / Н.И. Ишекова, А.Г. Соловьев, Н.С. Ишеков // Наркология. — 2002. — № 7. — С. 24–27.
7. Коваленко В.Н. Анализ эффективности амбулаторного лечения больных ИБС в сочетании с артериальной гипертензией в Украине / В.Н. Коваленко, М.И. Лутай // Евразийский кардиологический журнал. — 2012. — № 2. — С. 17–31.
8. Перминов А.А. Гендерные особенности влияния курения на вегетативную нервную систему у лиц юношеского возраста / А.А. Перминов, Д.Ю. Кувшинов, О.С. Рыбникова // СМЖ (Томск). — 2008. — № 3–2. — С. 64–68.
9. Поддубная А.В. Влияние факторов кардиоваскулярного риска на структурно-функциональную перестройку левого желудочка и вариабельность сердечного ритма у больных артериальной гипертонией: Автореф. дис… к.м.н.: 14.01.05 / А.В. Поддубная. — М., 2010. — 20 с.
10. Сіренко Ю.М. Артеріальна гіпертензія та супутня патологія / Ю.М. Сіренко. — Донецьк, 2010. — 384 с.
11. Arosio E. Effects of smoking on cardiopulmonary baroreceptor activation and peripheral vascular resistance / E. Arosio, S. De Marchi, A. Rigoni, M. Prior, A. Lechi // Eur. J. Clin. Invest. — 2006. — Vol. 36, № 5. — P. 320–325.
12. Bakhru A. Smoking cessation and cardiovascular disease risk factors: results from the Third National Health and Nutrition Examination Survey / Bakhru A., Erlinger T.P. // PLoS Med. — 2005. — Vol. 2. — P. 160.
13. Barutcu I. Acute cigarette smoking-induced hemodynamic alterations in the common carotid artery / Barutcu I., Esen A.M., Degirmenci B. // Circ. J. — 2004. — Vol. 64. — P. 1127–1131.
14. Bazzano L.A. Relationship between cigarette smoking and novel risk factors for cardiovascular disease in the United States / Bazzano L.A., He J., Muntner P. [et al.] // Ann. Intern. Med. — 2003. — Vol. 138. — P. 891–897.
15. Bermudez E.A. Relation between markers of systemic vascular inflammation and smoking in women / Bermudez E.A., Rifai N., Buring J.E. [et al.] // Am. J. Cardiol. — 2002. — Vol. 89. — P. 1117–1119.
16. Campisi R. Effects of long-term smoking on myocardial blood flow, coronary vasomotion and vasodilator capacity / Campisi R., Czernin J., Schoder H. // Circulation. — 1998. — Vol. 98. — P. 119–125.
17. Chika O. Cardiac Sympathetic Nervous Activity More Effectively Compared With L-Type Calcium Channel Blocker in Patients with Hypertension / Chika O., Shoichi M., Akiko I. [et al.] // Circulation. — 2011. — Vol. 124. — P. 122–131.
18. Dogan A. Acute effects of passive smoking on left ventricular systolic and diastolic function in healthy volunteers / A. Dogan, M. Yarlioglues, I. Gul [et al.] // Journal of the American Society of Echocardiography. — 2011. — Vol. 24(2). — P. 185–191.
19. Gembala M.I. Acute changes in left ventricular diastolic function: cigarette smoking versus nicotine gum / M.I. Gembala, F. Ghanem, C.A. Mann [et al.] // Clin. Cardiol. — 2006. — Vol. 29(2). — P. 61–64.
20. Howard G. Cigarette smoking and progression of atherosclerosis / Howard G., Wagenknecht L.E., Burke G.L. // JAMA. — 1998. — Vol. 279. — P. 119–124.
21. Janzon E. Changes in blood pressure and body weight following smoking cessation in women / Janzon E., Hedblad B., Berglund G. [et al.] // J. Intern. Med. — 2004. — Vol. 255. — P. 266–272.
22. Karakaya O. Acute effect of cigarette smoking on 151 heart rate variability / O. Karakaya, I. Barutcu, D. Kaya [et al.] // Angiology. — 2007. — Vol. 58, № 5. — P. 620–624.
23. Kim J.W., Park C.G., Hong S.J. Acute and chronic effects of cigarette smoking on arterial stiffness / J.W. Kim, C.G. Park, S.J. Hong // Blood Press. — 2005. — Vol. 14. — P. 80–85.
24. Li H. Vascular abnormalities in asymptomatic, healthy young adult smokers without other major cardiovascular risk factors: the Bogalusa Heart Study / Li H., Srinivasan S.R., Chen W. [et al.] // Am. J. Hypertens. — 2005. — Vol. 18. — P. 319–324.
25. Narnkiewicz K. Is smoking a causative factor of hypertension? / Narnkiewicz K., Kjeldsen S.E., Hedner T. // Blood Press. — 2005. — Vol. 14. — P. 69–71.
26. Niskanen L. Inflammation, abdominal obesity, and smoking as predictors of hypertension / Niskanen L., Laaksonen D.E., Nyyssonen // Hypertension. — 2004. — Vol. 44. — P. 859–865.
27. Oparil S. Pathogenesis of hypertension / Oparil S., Zaman A., Calhoun D. // Ann. Intern Med. — 2003. — Vol. 139. — P. 761–776.
28. Primatesta P. Association between smoking and blood pressure: evidence from the Health Survey for England / Primatesta P., Falaschetti E., Gupta S. [et al.] // Hypertension. — 2001. — Vol. 37. — Р. 187–193.
29. Raitakari O.T. Cardiovascular risk factors in childhood and carotid artery intima-media thickness in adulthood / Raitakari O.T., Juonala M., Kahonen M. // JAMA. — 2003. — Vol. 290. — P. 2277–2283.
30. Schmits N. Disabilities, quality of live, and mental disorders associated with smoking and nicotine dependence / N. Schmits, J. Rruse, J. Kugler // Am. J. Psychiatry. — 2003. — Vol. 160. — P. 1670–1676.
31. Sesso H.D. C–reactive protein and the risk of developing hypertension / Sesso H.D., Buring J.E., Rifai N. [et al.] // JAMA. — 2003. — Vol. 290. — P. 2945–2951.
32. Sharrett A. Smoking, diabetes, and blood cholesterol differ in their associations with subclinical atherosclerosis: the Multiethnic Study of Atherosclerosis (MESA) / Sharrett A., Ding J., Criqui M. // Atherosclerosis. — 2006. — Vol. 186. — P. 441–447.
33. Störk T. Changes of diastolic function induced by cigarette smoking: an echocardiographic study in patients with coronary artery disease. / T. Störk, H. Eichstädt, M. Möckel [et al.] // Clin. Cardiol. — 1992. — Vol. 15(2). — P. 80–86.
34. Störk T. Effects of nicotine on left ventricular diastolic function in patients with coronary disease. An echocardiographic study / T. Störk, R. Muller, C. Ewert [et al.] // Dtsh. Med. Wochenschr. — 1990. — Vol. 115(16). — P. 610–617.
35. Whelton P. Primary prevention of hypertension // Whelton P., He J., Appel L. // JAMA. — 2002. — Vol. 288. — P. 1882–1888.
36. Zamir Z. Acute haemodynamic effects of cigarette smoking in healthy young subjects / Z. Zamir, A. Mahmud, J. Feely // Ir. J. Med. Sci. — 2006. — Vol. 175, № 3. — P. 20–23.

/49/49.jpg)
/50/50_2.jpg)
/50/50.jpg)
/51/51_2.jpg)
/52/52.jpg)
/52/52_2.jpg)
/53/53.jpg)
/54/54.jpg)
/55/55.jpg)