Журнал «Почки» 2 (12) 2015
Вернуться к номеру
Применение нифуратела в терапии инфекций мочевыводящих путей у пациентов детского и подросткового возраста
Авторы: Мордовец Е.М. - Зав. детским нефрологическим отделением ДКБ № 1, г. Киев
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 52-55
Инфекции мочевыводящих путей (ИМП) — группа инфекционно–воспалительных заболеваний органов мочеполового аппарата, отвечающих за экскрецию мочи. Исходя из локализации, выделяют цистит, уретрит и пиелонефрит (EAU, 2013–2015) или цистит, пиелонефрит и инфекции мочевой системы без определения топики (Украина). Разумеется, следует учитывать тот факт, что изолированные поражения только одного сегмента мочевыводящих путей встречаются крайне редко. Таким образом, цистит рассматривается как преимущественное поражение слизистой оболочки мочевого пузыря, а пиелонефрит — чашечно–лоханочной системы и тубулоинтерстициальной ткани.
Кроме того, по мнению большинства специалистов и исследователей, большинство ИМП следует рассматривать как инфекции мочеполового аппарата (ИМПА), так как они часто осложняются генитальными инфекционными заболеваниями.
Следует отметить, что ИМПА занимают второе после инфекционных заболеваний дыхательной системы место среди всего множества инфекционных заболеваний человека [1].
В данной статье мы рассмотрим особенности возникновения, течения и лечения ИМП у пациентов детского возраста и подростков.
Основные эпидемиологические и статистические данные, а также данные в отношении классификации и медикаментозного лечения мы приводим, опираясь на последние рекомендации Европейской ассоциации урологов (EAU — ЕАУ) 2015 года [2].
У детей ИМП также встречаются довольно часто. Частота данной патологии у детей едва уступает инфекционным заболеваниям дыхательной и пищеварительной системы в летнее время и стоит на втором месте в холодное время года. Заболеваемость может варьировать в зависимости от возраста и пола. В течение первого года жизни, в первые 3 месяца, ИМП чаще встречается у мальчиков (3,7 %), чем у девочек (2 %), после чего происходит изменение соотношения — 3 % у девочек и 1,1 % у мальчиков.
В педиатрии ИМП являются наиболее частой причиной возникновения лихорадки неясного генеза у мальчиков в возрасте до 3 лет. По данным U. Jodal, ИМП являются наиболее распространенными бактериальными инфекциями у детей младше двух лет [3]. В большинстве случаев исходы ИМП у детей при адекватной терапии благополучные, однако возникновение их в раннем возрасте может привести к развитию рубцовых изменений в почках и нефросклерозу, особенно если они сочетаются с врожденными аномалиями развития мочевыводящих путей.
Риск развития ИМП в первой декаде жизни составляет 1 % для мальчиков и 3 % для девочек [4]. Также сообщается, что у 5 % девочек школьного возраста наблюдается по крайней мере 1 эпизод ИМП на протяжении обучения.
Также случаи бессимптомной бактериурии наблюдаются у 0,7–3,4 % новорожденных, 0,7–1,3 % детей до 3 лет, 0,2–0,8 % детей дошкольного возраста [4]. Клинически значимая бактериурия у новорожденных выявляется в 0,14 % случаев с последующим возрастанием до 0,7 % у мальчиков и 2,8 % у девочек в возрасте до 6 месяцев. Частота рецидивов за весь неонатальный период в среднем составляет 25 % [4, 5].
В целом в возрасте 1–18 лет ИМПА доминируют у девочек по сравнению с мальчиками [6].
Наиболее распространенными возбудителями ИМП у детей являются грамотрицательные бактерии, преимущественно кишечного происхождения. Так, например, Escherichia coli ответственна за 90 % эпизодов ИМП [7]. Инфекция, вызванная грампозитивной флорой, в особенности энтерококками и стафилококками, составляет 5–7 % случаев.
Отдельного внимания заслуживают нозокомиальные инфекции, вызываемые агрессивными и устойчивыми бактериями, такими как Klebsiella, Serratia и Pseudomonas sp., стрептококки группы А и B, которые относительно часто встречаются у новорожденных [8]. Обсуждается также возрастающая роль S.saprophyticus как этиологического фактора ИМП у детей [9]. И все же нозокомиальные инфекции и ИМП как часть системных инфекционно–воспалительных заболеваний играют не главную роль. В основном восходящий путь инфицирования является наиболее частым механизмом развития ИМП [10] у девочек.
Обструкция или дисфункция мочевыводящих путей — наиболее распространенная причина урологических инфекций. Такое частое явление, как фимоз, также располагает к развитию ИМП [11, 12].
Большое количество врожденных аномалий развития мочевыводящих путей может привести к ИМП в связи с появлением обструкции, например, уретральных клапанов, лоханочно–мочеточникового соединения или не связанного с обструкцией замедленного пассажа мочи, например везикоуретрального рефлюкса (ВУР). Более тривиальные, но не менее важные причины включают лабиальную адгезию (синехии малых половых губ) и хронический запор [9].
Также невропатическая дисфункция мочевого пузыря вследствие spina bifida или диссинергии сфинктера приводит к застою мочи и ВУР [5].
Клинические проявления ИМП у детей и подростков могут варьировать от бессимптомной лихорадки до желудочно–кишечных и урологических симптомов.
Следует помнить, что у детей часто встречаются ранние склеротические очаги в паренхиме почек в связи с пиелонефритом, который развился вследствие комбинации ИМП и ВУР. Иногда нефросклероз, возникший в детском возрасте по причине ИМП, может приводить к серьезным длительным осложнениям, таким как, например, артериальная гипертензия и хроническая почечная недостаточность, в связи с чем некоторым пациентам, уже во взрослом возрасте, требуется заместительная диализная терапия [13].
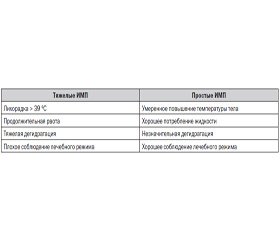
Согласно классификации ЕАУ, ИМП у детей делятся на две группы: тяжелые и простые ИМП. Основу данной классификации составляют клинические симптомы, представленные в табл. 1.
Европейская ассоциация урологов акцентирует внимание на том, что лечебные мероприятия должны быть сосредоточены на решении четырех главных задач:
— устранение симптомов и эрадикация бактериурии в острый период;
— предотвращение склеротических изменений почек;
— предотвращение рецидивов ИМП;
— коррекция ассоциированных урологических заболеваний.
Обязательным и единственным доказанно эффективным компонентом в ведении пациентов с ИМП является назначение антимикробной терапии. В медикаментозной терапии пациентов детского возраста большинство специалистов отдают предпочтение таблетированным и местно действующим формам лекарственных средств.
На сегодняшний день вопрос выбора адекватного препарата весьма актуален в связи с тем, что препараты, традиционно использовавшиеся для лечения ИМС, — цефалоспориновые антибиотики (первое–второе поколение) и уроантисептики, такие как триметоприм/сульфаметоксазол (ко–тримоксазол) и нитрофурантоин, становятся все менее эффективными в связи с постоянно возрастающей резистентностью к ним микроорганизмов. Все чаще практикующим врачам приходится назначать дополнительные или альтернативные антимикробные препараты, на чем в своих рекомендациях акцентирует внимание ЕАУ.
По данным исследования J.A. Karlowsky et al., проведенного в США, 10–20 % выделяемых из мочи штаммов Escherichia coli являются резистентными к триметоприму/сульфаметоксазолу и около 2 % из них также резистентны к нитрофурантоину [14]. Схожее исследование показывает постепенный рост резистентности Escherichia coli к препаратам первой линии, а именно комбинации триметоприма с сульфаметоксазолом, а также нитрофурантоину в США в период с 1995 по 2001 г. [15].
Кроме роста резистентности к вышеуказанным препаратам следует отметить множество неблагоприятных и опасных эффектов, связанных с их приемом.
Что касается нитрофурантоина, его применение нередко связано с развитием бронхолегочных поражений, таких как бронхоспазм, лобарная инфильтрация, плевральная экссудация, развитие пневмонита и фиброза легких. Также нитрофурантоин не рекомендовано назначать при пиелонефрите, так как он не создает необходимых концентраций в ткани почек. В 2014 Европейская ассоциация урологов в руководстве по лечению ИМС обратила внимание на «последние предупреждения государственных органов по ограничению долгосрочного профилактического применения нитрофурантоина по причине редких, но тяжелых легочных и печеночных побочных эффектов». Ранее, в феврале 2011 г., Французское агентство по безопасности лекарственных средств и продуктов питания (French Agency for the Safety of Medicine and Health Pro–ducts — ANSM) опубликовало предупреждение о том, что длительное применение нитрофурантоина может привести к развитию тяжелой печеночной и легочной токсичности.
Для ко–тримоксазола характерно возможное развитие депрессии, периферических нейропатий, бронхоспазма, гастрита, холестаза, гепатита, гепатонекроза, угнетения всех ростков кроветворения, гематурии, токсической нефропатии, асептического менингита, а также множества тяжелых аллергических реакций, в том числе токсического эпидермального некролиза (синдром Лайелла) и синдрома Стивенса — Джонсона. Европейская ассоциация урологов (2014) констатирует, что «рост резистентности E.coli во всем мире к триметоприму ставит под сомнение применение триметоприма с сульфаниламидом или без него как эффективного профилактического средства» при ИМС.
Использование столь популярных ранее препаратов группы фторхинолонов также не является больше альтернативой в связи с ростом резистентности к ним бактериальной флоры, которая в последние десятилетия приобрела огромные масштабы. Применение этих лекарственных средств рекомендовано только при популяционной резистентности менее 10 % (ЕАУ, 2014). Более того, «ввиду нежелательных экологических эффектов пероральные фторхинолоны и цефалоспорины больше не рекомендуются для рутинной практики, за исключением особых клинических ситуаций» (ЕАУ, 2014).
Рекомендации ЕАУ 2015 подчеркивают, что необходим поиск подходов, которые обеспечат более эффективное лечение ИМП. Вместе с тем препараты группы нитрофуранов обладают наиболее широким спектром антимикробной активности, и многие практикующие специалисты не хотят уходить от их использования. В постсоветском пространстве сохраняется опыт эффективного использования фурамага и Макмирора при циститах у детей и взрослых, не учтенный в рекомендациях ЕАУ.
Таким образом, в связи с быстро растущей устойчивостью уропатогенов к антибиотикам и недостатком новых возможностей терапии ИМП крайне необходима объективная оценка имеющихся в арсенале врачей лекарственных средств, а медицинским экспертам следует избегать категоричных формулировок и учитывать долгосрочные перспективы использования антибактериальных препаратов.
И если в последние годы результаты множества исследований и опыт практического применения позволяют рассматривать в качестве оптимальной альтернативы нитрофурантоину и ко–тримоксазолу фурамаг, то использование еще одного представителя антимикробных лекарственных средств из группы нитрофуранов — нифуратела, который обладает широким антибактериальным спектром и сравнительной безопасностью по сравнению с нитрофурантоином, требует более углубленного анализа. Этот препарат широко используется в гинекологии уже многие годы, в педиатрии — для лечения лямблиозной инфекции и завоевывает все большее признание в лечении ИМП, открывая эру некой ретроспективы.
Нифурател обладает антибактериальной, антипротозойной и противогрибковой активностью, высокой эффективностью в отношении грамотрицательных и грамположительных бактерий, в том числе мультирезистентных.
Спектр активности нифуратела включает: E.coli, S.faecalis, S.faecium, S.aureus, B.subtilis, S.flexneri 2a, S.flexneri 6, S.sonnei, S.typhi, S.typhimurium, S.ente–ritidis, T.vaginalis, Klebsiella spp, Enterobacter spp, Serratia spp, Citrobacter spp, Morganella spp, Rettgerella spp, Pragia fontium, Budvicia aquatica, Rachnella aquatilis, Acinetobacter spp, а также простейших: амебы, лямблии, Proteus mirabilis, P.vulgaris, Pseudomonas aeruginosa.
Говоря об антимикробной активности нифуратела, стоит упомянуть об исследовании, целью которого было определение степени активности пяти представителей нитрофуранов на 201 штамме различных микроорганизмов. Согласно результатам этого исследования, нифурател обладает намного большей антимикробной активностью, чем нитрофурантоин [16].
Многие исследования показывают высокую эффективность применения нифуратела в лечении грибковых ИМП и ИМПА, вызванных Candida, редким, но устойчивым возбудителем ИМП. При этом большинство исследований отмечают низкий уровень его минимальной подавляющей концентрации, что особенно важно с точки зрения бе–зопасности применения препарата в лечении пациентов детского и подросткового возраста [17].
Стоит отметить, что риск развития ИМП многократно возрастает при наличии урогенитальной инфекции, частота которой стремительно возрастает у лиц подросткового возраста, особенно у девочек. В свете этого применение нифуратела выглядит еще более целесообразным. Как с эмпирической точки зрения, благодаря многолетнему использованию в практике, так и с точки зрения доказательной медицины нифурател является одним из самых эффективных антимикробных средств для терапии инфекций половых путей, при этом не принося вреда естественной микрофлоре. В связи с этим становится абсолютно понятной ниша для Макмирора — ИМП, развивающиеся на фоне вульвитов, вульвовагинитов, баланитов, а также в период изменения вагинальной флоры у девочек, входящих в пубертат и начинающих половую жизнь (смена флоры). К месту отметить, что у взрослых женщин показания дополняются пременопаузой, постменопаузальным синдромом и частой сменой половых партнеров.
Нифурател уже давно зарекомендовал себя как эффективное лекарственное средство для лечения вагинальной инфекции. Особенно наглядно это проявляется при лечении вагинитов смешанной этиологии, вызываемых как минимум двумя из трех возбудителей (грибы, бактерии и Trichomonas Vaginalis) и составляющих треть всех вагинальных инфекций.
Об этом свидетельствует заключение экспертной группы представителей Польского гинекологического сообщества по использованию комбинированного препарата нифуратела с нистатином Макмирор Комплекс 500, наиболее часто используемого препарата в связи с тем, что нифурател значительно усиливает противогрибковые свойства нистатина [18].
Относительно безопасности применения нифуратела у детей стоит отметить, что данный препарат уже давно широко используется в терапии Н.pylori–ассоциированных гастритов. И именно ему отдается предпочтение при медикаментозной терапии пациентов детского возраста ввиду его легкой переносимости данным контингентом пациентов [19].
Следует заметить, что в большинстве стран мира нифурател никогда не покидал своего места в комплексном лечении ИМП, а сегодня, в связи с возросшей резистентностью микроорганизмов к ранее использовавшимся препаратам, таким как нитрофурантоин и триметоприм, а также множеством неблагоприятных эффектов их применения все больше практикующих специалистов, в том числе педиатров, которые часто сталкиваются именно с ИМП, начинают отдавать предпочтение препаратам нифуратела для лечения ИМП.
На зарубежном и отечественном фармацевтическом рынке нифурател представлен препаратом Макмирор в таблетированной форме и Макмирор Комплекс (в комбинации с нистатином) в виде вагинальных капсул и вагинального крема. Данный препарат является эталонным, так как в рамках всех масштабных международных исследований, посвященных оценке эффективности, безопасности и различных аспектов фармакодинамики нифуратела, в качестве испытуемого препарата применялся именно Макмирор и Макмирор Комплекс.
Вышеизложенное позволяет рекомендовать назначение Макмирора для лечения уретрального синдрома и цистита у детей, имеющих факторы риска и вероятную микст–флору (вульвит, вульвовагинит, пубертатный возраст, начало половой жизни, непостоянный половой партнер), в виде 5–дневного курса основной терапии, 7–дневного курса при рецидиве заболевания после ранее назначенного другого уроантисептика, а также в виде профилактической терапии в дозе 200 мг на ночь при рецидивирующем течении цистита, в особенности в группах риска (повторяющийся вульвовагинит, рецидивирующее течение синехий малых половых губ или баланопостита, смена половых партнеров, дисгормональные нарушения пубертатного периода).
1. Stamm W.E. Scientific and clinical challenges in the management of urinary tract infections // Am. J. Med. — 113 (1A): 1S–4S.
2. Grabe M., Bartoletti R., Bjerklund Johansen T.E., Cai T., Çek M., Köves B., Naber K.G., Pickard R.S., Tenke P., Wagenlehner F., Wullt B. Guidelines on Urological Infections. — 2015.
3. Jodal U. The natural history of bacteriuria in childhood // Infect. Dis. Clin. North Am. — 1987. — 1 (4). — Р. 713–29.
4. Foxman B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs // Am. J. Med. — 2002. — 113, Suppl. 1A. — Р. 5s–13s.
5. Schulman S.L. Voiding dysfunction in children // Urol. Clin. North Am. — 2004. — 31 (3). — Р. 481–90.
6. Winberg J., Bergstron T., Jacobsson B. Morbidity, age and sex distribution: recurrences and renal scarring in symptomatic urinary tract infection in childhood // Kidney Int. Suppl. — 1975. — 3 (–suppl). — S101–S106.
7. Shapiro E.D. Infections of the urinary tract // Pediatr. Infect. Dis. J. — 1992. — 11 (2). — Р. 165–8.
8. Richards M.J. et al. Nosocomial infections in pediatric intensive care units in the United States. National Nosocomial Infections Surveillance System // Pediatrics. — 1999. — 103 (4). — Р. e39.
9. Abrahamsson K. et al. Staphylococcus saprophyticus urinary tract infections in children // Eur. J. Pediatr. — 1993. — 152 (1). — Р. 69–71.
10. Ma J.F. et al. Urinary tract infection in children: etiology and epidemiology // Urol. Clin. North Am. — 2004. — 31 (3). — Р. 517–26.
11. Craig J.C. et al. Effect of circumcision on incidence of urinary tract infection in preschool boys // J. Pediatr. — 1996. — 128 (1). — Р. 23–7.
12. To T. et al. Cohort study on circumcision of newborn boys and subsequent risk of urinary–tract infection // Lancet. — 1998. — 352 (9143). — Р. 1813–6.
13. Jacobson S.H. et al. Development of hypertension and uraemia after pyelonephritis in childhood: 27 year follow up // BMJ. — 1989. — 299 (6701). — Р. 703–6.
14. Karlowsky J.A., Thornsberry C., Jones M.E., Sahm D.F. Susceptibility of antimicrobial–resistant urinary Escherichia coli isolates to fluoroquinolones and nitrofurantoin // Аntimicrob. Agents Chemother. — 2003 Jan 15. — 36 (2). — 183–7.
15. Karlowsky J.A., Kelly L.J., Thornsberry C., Jones M.E., Sahm D.F. Trends in antimicrobial resistance among urinary tract infection isolates of Escherichia coli from female outpatients in the United States. — 2002 Aug. — 46 (8). — 2540–5.
16. Hamilton–Miller J.M., Brumfitt W. Comparative in vitro activity of five nitrofurans. — 1978. — 24(3). —161–5.
17. Grüneberg R.N., Leakey A. Treatment of Candidal urinary tract infection with nifuratel // Br. Med. J. — 1976 Oct 16. — 2 (6041). — 908–10.
18. Polish Gynecological Society Expert Group. Statement of the Polish Gynecological Society Expert Group on the use of Macmiror Complex 500 // Ginekol Pol. — 2012. — 83 (12). — 956–9.
19. Nijevitch A.A., Sataev V.U., Akhmadeyeva E.N., Arsama–stsev A.G. Nifuratel–containing initial anti–Helicobacter pylori triple therapy in children // Helicobacter. — 2007. — 12 (2). — 132–5.
20. Tynan A.P., Macis F.R., Ward–McQuaid J.N. Nifuratel in urinary infections // Br. J. Urol. — 1969. — 41 (3). — 271–9.
21. Korte W. Therapy of urogenital infections of the woman with nifuratel // Ther. Umsch. — 1968. — 25 (12). — 690–5.
22. Gonzalez C.M., Schaeffer A.J. Treatment of urinary tract infection: what’s old, what’s new, and what works // World J. Urol. — 1999. — 17. — 372–382.
23. Scholes D., Hooton T.M., Roberts D.L. et al. Risk factors for recurrent urinary tract infection in young women // J. Infect. Dis. — 2000. — 182. — 1177–1182.
24. Nickel J.K. Management of urinary tract infections: historical perspective and current strategies: part 2 — modern management // J. Urol. — 2005. — 173. — 27–32.
25. Foxman B., Barlow R., d’Arcy H. et al. Urinary tract infection: estimated incidence and associated costs // Ann. Epidemiol. — 2000. — 10. — 509–515.
26. Funfstuck R. et al. The interaction of urinary tract infection and renal insufficiency // Int. J. Antimicrob. Agents. — 2006. — 28, Suppl. 1. — Р. S72–7.
27. Gupta K. et al. Short–course nitrofurantoin for the treatment of acute uncomplicated cystitis in women // Arch. Intern. Med. — 2007. — 167 (20). — Р. 2207–12.
28. Zorc J.J. et al. Diagnosis and management of pediatric urinary tract infections // Clin. Microbiol. Rev. — 2005. — 18 (2). — Р. 417–22.

/53/53.jpg)