Газета «Новости медицины и фармации» 7 (538) 2015
Вернуться к номеру
Доброякісна гіперплазія передміхурової залози: нові можливості терапії і профілактики (за матеріалами конгресу Европейської Асоціації Урологів, Мадрид, 2015)
Авторы: Пасєчников С.П. — д.м.н., професор, Національний медичний університет ім. О.О. Богомольця, м. Київ
Рубрики: Урология
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 6-7 (Укр.)
20–24 березня в Мадриді відбувся 30-й ювілейний конгрес Європейської Асоціації Урологів (ЄАУ), у рамках якого проводився симпозіум, присвячений медикаментозним аспектам лікування й профілактики доброякісної гіперплазії передміхурової залози (ДГПЗ) за участю відомих європейських і американських урологів, які подали 4 доповіді. Ми зупинимося на перших двох презентаціях симпозіуму.
Симпозіум відкрив президент регіонального відділення ЄАУ, професор кафедр урології Нью-Йоркського і Віденського медуніверситетів Bob Djavan, який подав до уваги слухачів доповідь «Чому виникає доброякісна гіперплазія передміхурової залози. Реальна історія...».
Доповідач підкреслив, що ДГПЗ є найбільш поширеним урологічним захворюванням у чоловіків літнього віку, і зупинився на трьох чинниках, що зумовлюють розвиток симптомів нижніх сечових шляхів (СНСШ), пов’язаних із ДГПЗ.
По-перше, він проаналізував роль об’єму простати, що збільшується з віком. У 50 % чоловіків після сорока п’яти років виявляються гістологічні ознаки гіперплазії тканин простати, але розвиток симптомів ДГПЗ спостерігається далеко не в усіх. Так, у дослідженні Sexton C.C. et al. (2009) було показано, що з 14 139 обстежених чоловіків віком понад 40 років у 25 % були присутні СНСШ того чи іншого ступеня вираженості. З віком гіперплазія простати посилює симптоматику й індукує прогресування захворювання, що повинно бути вчасно розпізнано урологом. Відомо, що коли симптоми слабо виражені (IPSS < 11), ризик прогресування становить 10 %, коли вони помірні (IPSS 11–13) — ризик прогресування збільшується до 24 %, а при IPSS > 14 він досягає 40 %, погіршуючи якість життя пацієнтів і сексуальну активність. У популяційному дослідженні Rosen et al. (2003) була продемонстрована висока частота еректильної дисфункції у чоловіків із СНСШ (до 90 %), що свідчило про існування значущого зв’язку між даними патологіями.
Далі професор Bob Djavan докладно розглянув запалення як другий чинник розвитку і нову терапевтичну мішень при лікуванні ДГПЗ. Згідно з результатами гістопатологічних досліджень біоптатів, отриманих D. Sieveriо від 3942 пацієнтів, було підтверджено, що в 43,1 % випадків ДГПЗ супроводжується запаленням. При цьому була встановлена виражена кореляція між розміром простати і хронічним запаленням. Також відзначений більш високий ризик розвитку даної патології у чоловіків, які мають в анамнезі простатит. У дослідженні J.L. St. Sauver і співавт. (2008) було показано, що середній час від встановлення діагнозу простатиту до встановлення діагнозу ДГПЗ становить 8,1 року, а від встановлення діагнозу до лікування простатиту — 9,8 року.
Доведено, що у пацієнтів із ДГПЗ і супутнім запаленням наявний більш високий ризик ускладнень (прогресування, гостра затримка сечі), що обумовлюють необхідність хірургічного втручання (Roehborn MTOPS Study Group, AUA 2005). Причому інфільтрація тканини простати лімфоцитами відзначається раніше, ніж її зростання. Так, за даними Fujikawa et al. (2005) (досліджували японських чоловіків), маркери запалення присутні у 60 % пацієнтів після 40 років, у той час як гіперплазія виявляється, як правило, після 50 років.
Bob Djavan зазначив, що запалення не тільки призводить до розвитку симптомів захворювання, але є важливим пусковим моментом лімфокінобумовлених механізмів, до яких належать фактори росту, що впливають на прогресування і результат захворювання. Вони регулюють співвідношення між проліферацією та апоптозом, і його зниження є одним із ключових чинників розвитку пухлини. У той же час вивільнення мембранних фосфоліпідів підсилює обмінні процеси в каскаді арахідонової кислоти і збільшує синтез медіаторів запалення, простагландинів і лейкотрієнів. Крім того, тканини, пошкоджені запальним процесом, вивільняють андрогензалежний фактор ангіогенезу — VEGE, що відіграє важливу роль у проліферації судин при раку простати.
Далі доповідач зробив акцент на гіперактивності сечового міхура, що входить до групи симптомів нижніх сечових шляхів і супроводжується частими позивами до сечовипускання, ніктурією та нетриманням сечі. У деяких пацієнтів із ДГПЗ-обумовленою інфравезикальною обструкцією при цистометрії виявляється гіперактивність детрузора. Той факт, що після трансуретральної простатектомії у 2/3 із них мимовільні скорочення детрузора більше не відзначаються, дозволяє припустити, що обструкція є щонайменше однією з причин гіперактивності. Проте дане питання є спірним, оскільки в 1/3 випадків хірургічні втручання виявляються неефективними (Thomas A.W. et al.), а в ряду пацієнтів протягом декількох років після операції має місце тенденція до збільшення активності детрузора (на 40–64 %), навіть без ознак обструкції.
Holm N.R. et al. у своєму дослідженні, проведеному в 1995 році, при порівнянні біоптатів, отриманих від літніх чоловіків з інфравезикальною обструкцією і без неї, встановили, що фіброзні зміни ззовні і в середині пучків м’язів детрузора абсолютно ідентичні, а «роз’єднання» м’язових клітин з утворенням аномальних контактів є нормальним наслідком старіння детрузора, а також одним з основних медіаторів його гіперактивності за відсутності інфравезикальної обструкції.
Отже, сучасні дані характеризують три основні компоненти формування клінічних симптомів ДГПЗ: збільшення передміхурової залози, запальний процес і гіперактивність сечового міхура. На закінчення Bob Djavan підкреслив, що доброякісна гіперплазія передміхурової залози — хронічне прогресуюче захворювання, що нерідко поєднується з іншими системними захворюваннями і значно знижує якість життя пацієнтів. При цьому важливим чинником, що впливає на прогресування і результат ДГПЗ, а також потенційною терапевтичною мішенню є запалення.
З доповіддю «Доброякісна гіперплазія передміхурової залози: медикаментозне лікування в міжнародних рекомендаціях» виступив президент Італійського товариства урологів Maurizio Brausi.
Він зазначив, що мета ведення пацієнтів із СНСШ/ДГПЗ змінювалася з часом. У минулому урологи концентрувалися в основному на уродинамічних параметрах (швидкість сечовипускання і кількість залишкової сечі), щоб визначити подальшу стратегію лікування. Сьогодні полегшення симптомів повинно бути основною метою терапії пацієнтів із СНСШ/ДГПЗ. Із цієї точки зору надзвичайно важливим стає швидке поліпшення симптомів та якості життя хворого.
Альфа-адреноблокатори чинять сприятливу дію на динамічний компонент інфравезикальної обструкції, полегшуючи СНСШ, однак не впливають на об’єм передміхурової залози, не зменшують ризику гострої затримки сечовипускання і оперативного втручання з приводу ДГПЗ. Питання про їх вплив на сексуальну сферу пацієнтів було вивчено в ряді досліджень. Згідно з даними Європейської Асоціації Урологів, застосування aльфа-адреноблокаторів призводить до порушення еякуляції зі зниженням продукції або відсутністю сім’яної рідини. При цьому молодий вік пацієнтів є очевидним чинником ризику. Серед усіх aльфа-адреноблокаторів найбільш високий рівень порушення еякуляції властивий силодозину.
Американською асоціацією урологів (ААУ) як aльфа-адреноблокатор рекомендуються альфузозин, доксазозин, тамсулозин і теразозин як ефективна альтернатива для лікування пацієнтів із СНСШ і ДГПЗ. Для них характерна однакова клінічна ефективність і лише невеликі відмінності у розвитку небажаних подій. У пацієнтів із СНСШ і вираженим збільшенням простати доцільно використання комбінації aльфа-адреноблокаторів та інгібіторів 5a-редуктази.
Далі Maurizio Brausi більш детально зупинився на інгібіторах 5a-редуктази, рекомендованих ЄАУ при помірних і тяжких СНСШ, збільшенні простати понад 40 мл, а також для запобігання прогресуванню захворювання, що нерідко призводить до гострої затримки сечі та хірургічного втручання. Їх призначення ефективне, однак загрожує виникненням побічних ефектів: зниженням лібідо, розвитком еректильної дисфункції, розладом еякуляції, зниженням об’єму еякуляту і гінекомастією. ААУ у своїх рекомендаціях також робить акцент на тому, що препарати цієї групи ефективні при СНСШ/ДГПЗ, але їх застосування повинно здійснюватися за суворими показаннями і тільки у випадках великих розмірів передміхурової залози.
Сучасним напрямком медикаментозної терапії хворих на ДГПЗ в поєднанні з СНСШ є лікування препаратами рослинного походження на основі Serenoa repens (Простамол® уно). Механізм дії препаратів Serenoa repens комплексний і включає антиандрогенний, антипроліферативний, протизапальний і протинабряковий ефекти. Антиандрогенний ефект ліпідо-стеролового екстракту Serenoa repens продемонстровано в дослідженні in vitro, в якому показано дозозалежне інгібування внутрішньоклітинного зв’язування дигідротестостерону з цитозольними і ядерними рецепторами в культурі клітин із крайньої плоті. У дослідженні в культурах фібробластів та епітеліальних клітин показано, що екстракт Serenoa repens значною мірою інгібує обидва ізомери I і II типу 5a-редуктази. Було описано також андрогеннезалежне пригнічення проліферації епітеліальних клітин простати шляхом інгібування епітеліального фактора росту. Протизапальний та протинабряковий ефекти екстракту Serenoa repens обумовлені його здатністю інгібувати ферменти арахідонового каскаду в клітинах простати: фосфоліпазу А2 (що активно бере участь у перетворенні фосфоліпідів мембран в арахідонову кислоту), циклооксигеназу і ліпоксигеназу (які відповідальні за утворення медіаторів запалення — простагландинів та лейкотрієнів). Ще один механізм дії екстракту Serenoa repens — це вплив на апоптоз за допомогою фактора росту. При цьому співвідношення між апоптозом і проліферацією в тканині доброякісно гіперплазованої передміхурової залози зміщується в бік апоптозу. До інших ефектів екстракту Serenoa repens відносять зв’язування з пролактиновими і альфа-адренергічними рецепторами.
Найбільш повний метааналіз ефективності екстрактів Serenoa repens наведено в Cochrane report. Було опрацьовано понад 30 рандомізованих порівняльних досліджень, що тривали від 4 до 60 тижнів і включали 5222 пацієнтів. Згідно з цим звітом не було виявлено переваг в ефективності екстракту Serenoa repens (за динамікою балів за IPSS), максимальній швидкості потоку сечі (Qмах) і об’ємі простати порівняно з плацебо, фінастеридом і тамсулозином. Єдиний показник, динаміка якого порівняно з плацебо виявилася позитивною, — це вираженість ніктурії. Таким чином, експерти дійшли висновку, що подібні рівні поліпшення за IPSS або Qмах у дослідженнях S. repens порівняно з фінастеридом або тамсулозином можуть бути інтерпретовані як їх терапевтична еквівалентність. У лікуванні ніктурії S. repens статистично значимо перевищує плацебо.
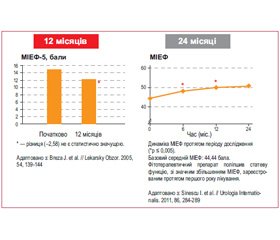
З огляду на те, що екстракти тих самих рослин різних виробників не мають однакових біологічних і клінічних ефектів, доповідачем проаналізовано дослідження Простамолу® уно. Особливий інтерес викликали дані дослідження B. Djavan (2005), що підтверджують прямий вплив S. repens на патогенез ДГПЗ і обумовлене ним значне зниження рівня клінічного прогресування захворювання у чоловіків із СНСШ через 24 місяці лікування. З метою вивчення впливу S. repens на клінічне прогресування ДГПЗ було обстежено 189 пацієнтів із різних європейських клінік із визначенням балів за IPSS, QoL, Qmax, простат-специфічного антигену (ПСА) і об’єму простати. Цікаво, що на тлі лікування в меншого числа пацієнтів (на 33 %) захворювання прогресувало з легкого до середнього/тяжкого ступеня. Таким чином, було показано, що S. repens за 2 роки може значно відстрочити прогресування ДГПЗ.
У дослідженні J. Breza et al. (2006), проведеному в 30 центрах урології в Словаччині за участю 600 пацієнтів із ДГПЗ, було показано, що призначення Простамолу® уно протягом 12 місяців є не тільки ефективним, але і безпечним. Результати дослідження продемонстрували позитивну динаміку бала за IPSS при тяжкому та середньому ступені тяжкості ДГПЗ; покращення якості життя (QoL) і максимальної швидкості сечовипускання; зниження залишкового об’єму сечі при тяжкому ступені захворювання; поліпшення симптоматики, а також показників уродинаміки; незначну зміну рівня ПСА і об’єму простати. При цьому Простамол® уно не змінював індекс еректильної функції навіть через 12 місяців щоденного прийому.
Отже, дослідження продемонстрували, що терапія Простамолом® уно є оптимальним варіантом для лікування чоловіків із СНСШ і ризиком прогресування ДГПЗ, а також високоефективною і безпечною.

/7_u/7_u.jpg)