Газета «Новости медицины и фармации» 7 (538) 2015
Вернуться к номеру
Гепатопротекторы: современные аспекты фармакологии
Авторы: Редькин Р.Г. — к.фарм.н., доцент кафедры общей практики — семейной медицины ХНУ им. В.Н. Каразина; Николенко Е.Я. — проф., д.м.н., зав. кафедрой общей практики — семейной медицины ХНУ им. В.Н. Каразина
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 8-11 (Укр.)
По данным Всемирной организации здравоохранения (ВОЗ), за последние 20 лет во всем мире наметилась отчетливая тенденция к росту числа заболеваний печени. Только в странах постсоветского пространства ежегодно регистрируется от 500 тысяч до 1 млн человек, страдающих той или иной печеночной патологией. В Украине на сегодняшний день вирусными гепатитами страдают 1080 человек на 100 тыс. населения, на диспансерном учете состоит более 280 тыс. больных хроническим гепатитом различной этиологии (652 на 100 тыс. населения) и более 40 тыс. больных циррозом печени (128 на 100 тыс. населения) [1]. По данным ВОЗ, в мире насчитывается более 2 млрд человек, страдающих заболеваниями печени, что в 100 раз превышает распространенность ВИЧ-инфекции.
Ежегодно отмечается существенное увеличение уровня заболеваемости вирусными гепатитами. Они причиняют значительный вред здоровью людей, уносят много жизней и ведут к большим экономическим потерям. Одни вирусы являются возбудителями инфекционных процессов, при которых может иметь место и поражение печени (вирусы герпеса, цитомегаловирус, вирус Эпштейна — Барр, вирус кори, красной волчанки, некоторые энтеровирусы из групп Коксаки А, В, ЕСНО и прочие). Другая часть вирусов поражает главным образом клетки печени. Это известные на сегодня вирусы гепатитов А и Е с фекально-оральным механизмом передачи и вирусы гепатитов B, C, D, G, TTV — с парентеральным. По результатам экспресс-тестирования на гепатит С в рамках кампании «Требуем лечения!» в Украине за 2013 год, самым большим количество инфицированных было в таких городах, как Чернигов (30 %), Днепропетровск (25,7 %), Черновцы (23,33 %), Киев (21,74 %), Каменец-Подольский (20 %), Сумы (16,67 %).
Все чаще встречаются заболевания печени у лиц с сопутствующей соматической, токсикологической и хирургической патологией, требующей применения гепатопротекторных средств. Увеличение в Украине числа больных, страдающих туберкулезом и получающих противотуберкулезную терапию, также требует применения «препаратов прикрытия» — гепатопротекторов.
Наблюдается существенный рост количества больных с ожирением и сахарным диабетом, которые являются основной причиной развития сравнительно новой нозологической формы — неалкогольной жировой болезни печени (НАЖБП). Она характеризуется накоплением жира в гепатоцитах, не связанным со злоупотреблением алкоголем, и объединяет такие клинико-морфологические изменения в печени, как стеатоз, неалкогольный стеатогепатит (НАСГ), фиброз и цирроз (Буеверов А.О., 2007, Ивашкин В.Т., 2010, Matteonini C.A., 1999). Так, в общей популяции распространенность НАЖБП на стадии стеатоза в среднем составляет 20 %, на стадии стеатогепатита — 3 %. В США жировую дистрофию печени имеют более 34 % взрослого населения страны, в Японии — 29 % взрослых жителей (Browning J.D., 2004, Musso G., 2010). В России, по данным клинико-эпидемиологического исследования 2007 года, распространенность НАЖБП составила 26,1 % (Лазебник Л.Б., 2009, Никитин И.Г., 2010, Драпкина О.М., 2010). Жировой гепатоз имеет благоприятное течение в отличие от неалкогольного стеатогепатита, который характеризуется повреждением гепатоцитов, воспалением и фиброзом, а также может приводить к развитию цирроза, печеночно-клеточной недостаточности и гепатоцеллюлярной карциномы (Harrison, 2003).
Клиническое течение НАЖБП изучено недостаточно. С одной стороны, НАЖБП — фактор риска сердечно-сосудистых заболеваний, сахарного диабета 2-го типа, дислипидемии, ожирения, а с другой — у большинства больных протекает бессимптомно или малосимптомно (Bugianesi E., 2005, Marchesini G., 2001). Биохимические показатели крови, отражающие состояние и функцию печени, могут быть в пределах нормальных значений, и единственным показателем, свидетельствующим о возможности развития стеатогепатита, является повышение уровня сывороточных трансаминаз (Мухин Н.А., 2009, Каганов Б.С., 2009). Нередко выявление заболевания происходит случайно при ультразвуковом исследовании (УЗИ) пациентов, которые в момент обращения не предъявляли никаких жалоб, связанных с патологией печени [3].
Еще в начале ХХ в. многие выдающиеся ученые увидели не только положительные, но и отрицательные стороны научно-технического прогресса в медицине. В первой половине прошлого века сформировалось понятие «побочное действие лекарственных средств». Большой вклад в изучение лекарственной болезни внес Е.М. Тареев. В 1954 г. он выступил с докладом «Лекарственная болезнь — аналог сывороточной болезни». На лекциях он также считал необходимым сказать студентам горькую правду: «Чтобы лечиться в наш век, нужно иметь хорошее здоровье». Печень наиболее часто подвергается нежелательному воздействию многих экзогенных факторов, в том числе лекарств. В настоящее время известно более тысячи лекарственных препаратов, обладающих гепатотоксическим действием [2]. Лекарственные поражения печени (ЛПП) являются причиной 2–5 % всех госпитализаций по поводу желтухи, 40 % гепатитов у лиц старше 40 лет и 25–50 % всех случаев печеночной недостаточности [1, 4]. Частота фатальных исходов у больных ЛПП и желтухой составляет 9–12 % [5]. Необходимо помнить, что почти все без исключения лекарственные препараты, метаболизирующиеся в печени, вызывают определенные изменения, которые могут не сопровождаться изменениями функции и развитием заболеваний печени.
Комплексная терапия заболеваний печени осуществляется по двум основным направлениям: 1) этиотропное лечение, полагающее целью эрадикацию возбудителя заболевания или повреждающего фактора; 2) патогенетическая терапия, сосредоточенная на повышении устойчивости гепатоцитов к патологическим воздействиям и усилении их обезвреживающей функции.
В клинической практике этиотропная терапия применяется при лечении вирусных гепатитов. Эффективность современной противовирусной терапии составляет в среднем 50 %, даже после окончания 12-месячного курса альфа-интерферона (10 МЕ 3 раза в неделю в течение 12 месяцев) почти у половины HВeAg-негативных пациентов наблюдается рецидив заболевания, а стойкий ответ может быть достигнут у 15–25 % больных, у которых в последующем в 15–30 % случаев происходит клиренс HBsAg [4]. Именно поэтому при лечении хронических вирусных гепатитов огромное значение имеет применение средств патогенетической терапии, а при заболеваниях печени иной этиологии использование таких препаратов составляет основу лечения.
Комбинирование препаратов осуществляется главным образом путем реализации четырех направлений фармакологической активности: 1) антиоксидантного; 2) мембраностабилизирующего; 3) противовоспалительного; 3) анаболического.
Современный арсенал гепатопротекторов весьма широк. Гепатопротекторами в отечественной медицинской литературе принято называть лекарства, повышающие устойчивость печени к патологическим воздействиям, способствующие восстановлению ее функций при различных повреждениях [5]. Очень часто практическому специалисту довольно сложно разобраться в особенностях фармакологии препаратов этой группы и рациональном выборе гепатопротекторов, которые являются основными компонентами патогенетической терапии острых и хронических заболеваний печени. Кроме того, гепатопротекторы весьма разнородны по своему химическому составу и оказывают разнонаправленное воздействие на метаболические процессы.
Несмотря на многолетний клинический опыт и многочисленные научные исследования (в большинстве случаев не отвечавшие принципам клинических исследований с высоким уровнем доказательности), не существует универсального «идеального» гепатопротектора, способного решить все проблемы.
Основные требования к «идеальному» гепатопротектору были сформулированы R. Preisig [6] в 1970 г.:
— достаточно полная абсорбция при приеме per os;
— наличие эффекта «первого прохождения» через печень;
— выраженная способность связывать высокоактивные повреждающие соединения или предотвращать их образование;
— возможность уменьшать чрезмерно выраженное воспаление;
— подавление фиброгенеза;
— стимуляция регенерации печени;
— естественный метаболизм при патологии печени;
— экстенсивная энтерогепатическая циркуляция;
— отсутствие токсичности.
Единой рациональной классификации гепатопротекторов не существует. Представленные в настоящее время на отечественном рынке препараты для гепатопротекции принято разделять на следующие подгруппы в зависимости от происхождения и химического состава [5]: 1) препараты, содержащие смесь естественных или полусинтетических флавоноидов расторопши, в первую очередь силимарин; 2) средства, содержащие естественные или полусинтетические флавоноиды других растений; 3) органопрепараты животного происхождения; 4) препараты, содержащие эссенциальные фосфолипиды (ЭФЛ); 5) препараты разных групп: аминокислоты и их производные (адеметионин), урсодезоксихолевая кислота (УДХК), нестероидные анаболики, витамины и витаминоподобные вещества (В, Е, С, липоевая кислота).
Показаниями к применению гепатопротекторов (в дополнение к этиотропной терапии) являются алкогольные и неалкогольные стеатогепатиты, лекарственные, токсические, холестатические и вирусные поражения печени. Основными факторы, влияющими на выбор гепатопротектора, являются:
— этиология заболевания печени;
— наличие холестаза (повышение уровня гамма-глутамилтранспептидазы (ГГТП) и щелочной фосфатазы);
— степень активности патологического процесса;
— необходимость проведения длительной антифибротической терапии;
— включение в патогенез некроза гепатоцитов аутоиммунных реакций.
Силимарин — это смесь флавоноидов расторопши пятнистой, среди которых основным действующим веществом является силибинин. Препараты, содержащие силимарин, оказывают мембраностабилизирующее действие. Фенольная структура флавоноидов обеспечивает связывание свободных радикалов и прерывание процессов перекисного окисления липидов (ПОЛ), механизм действия силимарина до конца не изучен.
По данным различных детализированных исследований «случай — контроль» применения силимарина при отравлении грибами Amanita phalloides (бледная поганка), смертность в группе, в которой применяли силимарин, колебалась от 9,8 до 8,3 %, а в случаях, когда силимарин не использовали, — в диапазоне от 12,8 до 18,3 % [7].
В 1989 году P. Ferenci et al. опубликована одна из самых известных работ об успешном использовании силимарина в дозе 140 мг 3 р/д у 170 больных циррозом печени различной этиологии: алкогольной — 91 пациент, неалкогольной — 79. Средний возраст в опытной и контрольной группах составлял 57–58 лет, мужчин было 123, женщин — 47. Период наблюдения — 41 месяц. В группе, принимавшей силимарин, выживаемость составила 58 ± 9 %, а в группе плацебо — 39 ± 9 % [8].
В рандомизированном двойном слепом плацебо-контролируемом исследовании G.C. Trinchet et al. (1989) терапевтические эффекты силимарина изучали у 116 пациентов с алкогольным гепатитом (и циррозом печени у 58 из них). Пациенты получали 420 мг/сут силимарина или плацебо на протяжении 3 месяцев. Улучшение было отмечено как в экспериментальной, так и в контрольной группе (p < 0,05), однако статистически значимых преимуществ по сравнению с плацебо не установлено. Во время исследования от печеночной недостаточности умерли 4 пациента: один — из группы активного лечения, 3 — из группы плацебо (различия недостоверны) [9].
В 2007 году Rambaldi et al. (Cochrane Hepato-Biliary Group) опубликовали систематический обзор 18 рандомизированных клинических испытаний эффективности экстракта расторопши пятнистой с участием 1088 пациентов с алкогольной болезнью печени (АБП) и/или вирусными гепатитами В или С. Методологическое качество исследований в целом было низким (необходимым критериям соответствовали лишь 28,6 % испытаний). Основной оценкой исходов была смертность. Экстракт расторопши не изменял частоту осложнений основного заболевания и смертельных случаев во всех группах, при этом в одном из отобранных исследований авторы наблюдали уменьшение смертности пациентов с АБП. При анализе смертельных исходов, обусловленных болезнью печени (liver-related mortality), выявлены похожие результаты [10]. Авторы систематического обзора R. Saller et al. (2008) в заключение отметили, что разумно использовать силимарин в качестве элемента поддерживающей терапии при отравлениях грибами Amanita phalloides, а также при циррозе печени алкогольной этиологии с индексом A по Child [7].
ЭФЛ в качестве лекарственного препарата зарегистрированы только в странах СНГ, тогда как практически во всем мире они представлены на рынке в качестве биологически активных добавок. Применение эссенциальных фосфолипидов не может устранить основные патогенетические причины оксидативного стресса, развивающегося в гепатоцитах. Гипотеза «встраивания» экзогенных фосфолипидов растительного происхождения не обладает достоверными доказательствами. В соответствии с выводами систематического обзора K.J. Gundermann et al. (2011) применение ЭФЛ улучшает или нормализует субъективные симптомы (например, общее самочувствие больного) при хронических вирусных гепатитах, жировой болезни печени и ее токсических поражениях [11]. Использование ЭФЛ при острых и хронических вирусных гепатитах может приводить к усилению холестатического синдрома и увеличению цитолиза; также при приеме внутрь ЭФЛ обладают низкой биодоступностью (Морозов С.В., Кучерявый Ю.А., 2012).
Адеметионин (S-аденозил-L-метионин) — эндогенный субстрат, синтезирующийся в организме из аденозинтрифосфата (АТФ) и метионина. Более сорока метаболических реакций требуют переноса метильной группы от S-аденозилметионина на такие субстраты, как нуклеиновые кислоты, белки и липиды. До 85 % всех реакций метилирования, так же как и 48 % — метаболизма метионина, происходит в печени [12]. Адеметионин принимает участие в синтезе цистеина, который является прекурсором глутатиона — главного клеточного антиоксиданта, ответственного за обезвреживание различных веществ-ксенобиотиков [13, 14]. Q.M. Anstee и C.P. Day в своем обзоре (2012) указывают, что, учитывая сильную связь этанолиндуцированных нарушений обмена метионина с дефицитом витаминов В6 и В12, в дальнейших клинических исследованиях следует изучить эффективность применения адеметионина в комбинации с этими витаминами [15, 16].
L-орнитин-L-аспартат (LOLA) состоит из двух аминокислот — орнитина и аспартата, каждая из которых включается как в общие, так и в специфичные для каждой аминокислоты метаболические пути, что и определяет терапевтические свойства препарата. Молекула орнитина представляет собой ключевой субстрат в цепи последовательных ферментативных реакций орнитинового цикла синтеза мочевины, протекающего в перипортальных гепатоцитах, в результате которого токсические азотсодержащие продукты распада, в первую очередь аммиак, преобразуются в нетоксическую водорастворимую мочевину — главный конечный продукт белкового обмена, который выделяется почками.
Орнитин участвует в биосинтезе глутамата, кетоглутарата и пролина, также играющих существенную роль в биосинтезе белка. Аспартат, в свою очередь, под действием трансаминаз способен метаболизироваться в оксалоацетат, который вовлекается в цикл трикарбоновых кислот Кребса и, кроме того, подвергается последовательной трансформации в глюкозу, которая в виде гликогена способна депонироваться в печени.
Как утверждают P.C. Soárez et al. (2009) в критическом анализе применения LOLA при печеночной энцефалопатии, «…достаточных доказательств значительного положительного влияния LOLA у пациентов с печеночной энцефалопатией не обнаружено. Несмотря на увеличение в последнее время числа систематических обзоров и метаанализов, проведенных в этой области, более половины таких работ имеют значительные недостатки в научном плане, что вызывает сомнения в их значимости для клинической практики. Поэтому следует направить усилия на улучшение методологического качества систематических обзоров применения LOLA» [17].
Урсодезоксихолевая кислота — физиологическая субстанция, составляющая примерно 1–5 % человеческой желчи. На фоне приема УДХК уменьшается энтерогепатическая циркуляция гидрофобных желчных кислот, предотвращается их токсическое влияние на мембраны гепатоцитов и эпителий желчных протоков. Наиболее изученные клинические эффекты: цитопротективный, холеретический, гипохолестеринемический, литолитический.
В мультицентровом двойном слепом рандомизированном плацебо-контролируемом клиническом исследовании (Sugerman H.J. et al., 1995) УДХК применяли для профилактики образования желчных камней, индуцированного быстрой потерей веса. При использовании УДХК в дозе 600 мг в течение 6 месяцев уменьшалась частота образования желчных камней: в группе плацебо она составляла 32 % в течение последующих 6 лет, в группе УДХК — 2 % [18].
Согласно рекомендациям Европейского общества по изучению печени и Американской гастроэнтерологической ассоциации УДХК в дозе 10–20 мкг/кг является препаратом первого выбора для терапии внутрипеченочного холестаза беременных. УДХК уменьшает также выраженность стеатоза, однако ее влияние на гистологические характеристики неалкогольного стеатогепатита требует дальнейшего изучения [19].
Согласно обзору Cochrane Hepato-Biliary Group (2007) назначение УДХК при вирусных гепатитах не влияет на вирусологический ответ, развитие гепатоцеллюлярного рака, печеночной недостаточности и смертность, связанную с поражением печени. Назначение УДХК оказывает положительное воздействие на биохимические показатели цитолиза и холестаза у больных с НАСГ [20].
По мнению J.S. Rudic et al. (Cochrane Hepato-Biliary Group, 2012), терапия УДХК возможна и замедляет гистологическое прогрессирование первичного билиарного цирроза (ПБЦ), но, наряду с несомненным улучшением симптомов холестаза, не влияет на степень фиброза и не улучшает исходы ПБЦ: не снижает смертность, потребность в трансплантации печени, частоту варикозных кровотечений. Однако все включенные в анализ испытания имели высокий риск предвзятости итогового смещения отчетности и риск случайных ошибок. Медицинское применение УДХК в лечении первичного билиарного цирроза печени должно быть строго ограничено показаниями и подтверждено научными двойными слепыми контролируемыми клиническими исследованиями. При этом необходимо обязательное включение определения уровня УДХК, гистологического исследования, а также оценка смертности и заболеваемости [21].
Метадоксин — гепатопротекторный детоксицирующий и антиалкогольный препарат для комплексного лечения заболеваний печени, в частности алкогольно-токсических поражений и сопутствующих им тяжелых осложнений (алкогольный стеатогепатит (АСГ), алкогольная жировая болезнь печени (АЖБП), острые отравления алкоголем и его суррогатами, абстинентный синдром, психоневрологические расстройства), который зарегистрирован в Украине под названием Ливерия® IC, таблетки по 500 мг. По структуре метадоксин — это соль пиридоксина с L-5-оксо-пиролидин-2-карбоксилатом (пироглутаматом), которая в тканях может диссоциировать на собственно пиридоксин (витамин B6) и пироглутамат.
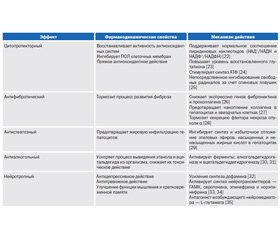
Примечательно, что метадоксин быстро абсорбируется в желудочно-кишечном тракте, имеет высокую биодоступность (60–80 %). Связывание с белками плазмы крови составляет приблизительно 50 %. Метаболизируется в печени с образованием активного метаболита — пиридоксаля и естественных метаболитов II фазы метаболизма — 4-пиридоксиловой кислоты, 5-фосфопиридоксиловой кислоты, лактон 4-пиридоксиловой кислоты и пироглутамата. Период полувыведения метадоксина при приеме внутрь или при парентеральном введении очень короткий и составляет 40–60 мин. Около 45–50 % метадоксина выводится с мочой в течение 24 часов, 35–50 % — с калом в течение 96 часов. Основные фармакологические свойства препарата приведены в табл. 1.
На клеточном уровне метадоксин [25]:
— повышает уровень восстановленного глутатиона;
— усиливает синтез НАД, улучшая энергообеспеченность клетки (поддерживает нормальное соотношение пиридиновых нуклеотидов, в том числе за счет реактивации ключевого энзима в синтезе пиридиновых нуклеотидов — триптофанпирролазы);
— стимулирует синтез АТФ в печени и головном мозге;
— нормализует уровень маркеров повреждения печени (аланинаминотрансфераза (АЛАТ), аспартатаминотрансфераза (АСАТ), ГГТП) — вследствие торможения ПОЛ клеточных мембран;
— нормализует процессы декарбоксилирования, переаминирования и дезаминирования аминокислот.
Пиридоксин как один из компонентов препарата выполняет ряд важных функций в организме, в частности, участвует в метаболизме аминокислот, углеводов, липидов и гемоглобина. В печени он играет важную роль в нейтрализации и детоксикации желчных кислот путем синтеза их конъюгат с таурином [24, 34]. Прежде всего пиридоксин является коферментом в биосинтезе цистеина из метионина и серина, а также коферментом цистеинсульфиновой декарбоксилазы (EC 4.1.1.29) при последующем превращении цистеина в гипотаурин при биосинтезе таурина [36].
При интоксикационных (реактивных и токсических) и вирусных гепатитах под влиянием пиридоксина увеличивается желчеотделение и элиминация желчных пигментов, улучшаются углеводная, белковосинтезирующая и дезинтоксикационная функции печени. Пиридоксин нормализует синтез липопротеинов очень низкой плотности в печени. Прием алкоголя приводит к уменьшению содержания пиридоксальфосфата в тканях [37].
В тканях ионная пара молекулы метадоксина распадается и образует молекулы типа N-оксидов, которые выполняют функции спиновых ловушек, таким образом, в состоянии захватить синглетный кислород, гидроксил, и супероксид-радикалы [37], т.е. обладает прямым антиоксидантным (антирадикальным) действием.
Хронические заболевания печени, развивающиеся вследствие метаболических нарушений при алкогольной и лекарственной интоксикации, нарушениях жирового или углеводного обмена, имеют подобные патофизиологические механизмы, при них также формируются схожие гистопатологические изменения в ткани печени. Как известно, алкогольная интоксикация состоит не только в прямом токсическом влиянии этанола на органы и системы, но и включает в себя сложную цепь превращений ацетальдегида и образования нейротоксичных азотсодержащих метаболитов (сальсолинол, карболины — гарман, норгарман и др.), значительно подкрепляющих тягу к алкоголю, т.е. формирующих химическую зависимость от алкоголя [39].
Метадоксин ускоряет процессы окисления и элиминирования алкоголя и его суррогатов, в частности этанола и ацетальдегида, переводя их в ацетат, который легко элиминируется почками, тем самым устраняется токсическое влияние алкоголя и нормализуется его патологическая токсикокинетика [39].
Ввиду доказанного положительного влияния на токсикокинетику алкоголя метадоксин одобрен в странах ЕС как средство для терапии острой алкогольной интоксикации, алкогольной зависимости и алкогольной жировой болезни печени [28, 40].
Метадоксин является поставщиком кофермента — пиридоксина и тем самым вызывает активацию систем, участвующих в окислении и детоксикации. Достоверное ускорение элиминации алкоголя под действием метадоксина было подтверждено рядом исследований [40, 41]. Причем препарат можно вводить как парентерально, так и перорально. Так, в двойном слепом плацебо-контролируемом исследовании было подтверждено ускорение выведения этанола более чем в 2 раза — с 2,34 (при приеме плацебо) до 0,95 часа (под действием метадоксина в дозе 900 мг/сут внутривенно) [31].
В клиническом исследовании Martínez и соавторов была показана эффективность и безопасность метадоксина в дозе 300 мг внутривенно однократно [42]. Метадоксин значительно улучшает детоксицирующую функцию печени и защищает ее не только от токсического поражения алкогольного генеза, но и от воздействия других токсинов. Так, препарат тормозит гибель гепатоцитов, предупреждает развитие стеатоза, снижает проявления воспаления и фиброза даже при действии таких высокотоксичных печеночных ядов, как четыреххлористый углерод. В экспериментах на культуре гепатоцитов было доказано, что метадоксин предотвращает повреждающее действие этанола и ацетальдегида на гепатоциты [27].
Было показано, что метадоксин, будучи поставщиком пиридоксина, стимулирует синтез глутатиона, активируя ряд ферментов (глутатионредуктаза, цистатионин-бета-синтаза и цистатионин-гамма-лиаза), участвующих в его синтезе [41]. Calabrese и соавторы установили, что метадоксин повышает уровень восстановленного глутатиона в тканях, что также согласуется с ростом активности глутатионредуктазы, что, в свою очередь, обеспечивает защиту тканей от оксидативного стресса, вызванного этанолом [24]. Именно оксидативный стресс является тем «вторым ударом» после жировой дистрофии клеток печени, который может привести к фатальной для гепатоцитов митохондриальной токсичности.
Одним из первых клинических испытаний, в которых была подтверждена эффективность метадоксина в терапии АСГ и АЖБП, стало двойное слепое рандомизированное плацебо-контролируемое мультицентровое клиническое исследование, опубликованное Caballería и соавторами [43]. В этой работе была показана эффективность метадоксина в дозе 1500 мг/сут у 136 пациентов, страдающих алкоголизмом, с биохимически и УЗИ-подтвержденными критериями АЖБП. В результате было отмечено достоверное улучшение функций печени (биохимические, УЗ-показатели), даже если употребление алкоголя прекращалось не полностью. Препарат метадоксин благодаря своему многофакторному гепатопротективному действию занимает уникальное место среди современных гепатопротекторов, что показано в классификации О.Н. Минушкина и соавт. [44].
В двойном слепом плацебо-контролируемом исследовании, представленном Mao и соавторами, метадоксин показал общую эффективность 82,8 % при пероральном применении в дозе 500 мг 3 раза в день (1500 мг в сутки) в течение 6 недель у 254 пациентов с АЖБП [45].
Группа американских исследователей (Leggio и соавт.) подтвердила детоксицирующие и гепатопротекторные свойства метадоксина в несколько большем диапазоне доз — 500–2000 мг/сут у пациентов с АЖБП в течение 40 дней терапии, регистрируя нормализацию или снижение повышенных маркеров алкогольного поражения печени (АСАТ, АЛАТ, ГГТП) и купирование абстинентного синдрома. Авторы считают, что наиболее оптимальной схемой приема метадоксина является его прием в дозе 500 мг 3 раза в сутки [34]. В то же время российские исследователи Сильвестрова и соавторы показали, что прием метадоксина даже в дозе 500 мг 1 раз в день в течение 28 дней нормализует метаболическую функцию печени, что было подтверждено при антипириновом тесте у 36 пациентов с АЖБП [46].
В реализации гепатопротекторного действия метадоксина имеет место не только повышение образования компонентов антиоксидантной системы, в частности восстановленного глутатиона, как было отмечено выше, но и торможение синтеза этиловых эфиров свободных жирных кислот (ЭЭСЖК), которые образуются под действием этанола в клетках печени и также накапливаются в головном мозге, почках, поджелудочной железе, сосудах и сердце [47]. Таким образом, метадоксин, ингибируя процесс образования и отложения ЭЭСЖК, оказывает гепато- и органопротекторное действие.
В ряде исследований была подтверждена эффективность метадоксина в терапии неалкогольных поражений печени, в частности для коррекции гепатотоксического действия при химиотерапии у онкологических больных [48], а также у пациентов с подагрой и жировой болезнью печени, ассоциированной с метаболическим синдромом [49]. У больных хроническим вирусным гепатитом С, в комплекс лечения которых к 4-й неделе был включен метадоксин, зафиксировано снижение до нормальных значений уровней общего, свободного и связанного билирубина, а также уменьшение активности аминотрансфераз [50].
Известно, что хроническое злоупотребление алкоголем характеризуется полиорганностью поражения, поэтому алкогольному циррозу печени часто сопутствуют и другие признаки «большой алкогольной болезни». Одной из мишеней является нервная система, причем как периферическая, так и центральная. Поражение центральной нервной системы приводит к ухудшению когнитивной и других ее функций, которое клинически выражается в увеличении времени выполнения цифрового теста, снижении фона настроения, в апатии, заторможенности, а в тяжелых случаях — коме или деменции. Поражение периферической нервной системы проявляется периферической моторно-сенсорной полинейропатией и встречается у 30–70 % больных, страдающих алкоголизмом [51]. На начальных стадиях преобладают симптомы нарушения чувствительности конечностей, однако позже присоединяется моторный дефицит, который в тяжелых случаях приводит к симметричным дистальным парезам и инвалидизации пациентов [52].
Поэтому чрезвычайно перспективными являются препараты, сочетающие в себе гепато- и нейропротективные свойства. Таким сочетанием обладает препарат метадоксин. При его приеме улучшение состояния периферической нервной системы выражалось в достоверном уменьшении оценки выраженности симптомов нейропатии в соответствии с нейропатическим симптоматическим счетом, предложенным D. Ziegler et al. Улучшение состояния центральной нервной системы проявляется в уменьшении времени выполнения цифрового теста и росте показателей психического здоровья и других шкал опросника SF-36 [36]. В настоящее время доказано, что параметры качества жизни обладают независимой прогностической значимостью оценки больного [53].
Метадоксин способен корректировать нервно-психическую симптоматику (тревога, депрессия, бессонница) уже после первой недели лечения, достоверно уменьшая потребность в назначении бензодиазепинов и/или нейролептиков по сравнению с контрольной группой. В группе больных, получавших метадоксин, наблюдалась достоверная редукция нервно-психической симптоматики, связанной с воздержанием от употребления алкоголя, по сравнению с контрольной группой [54]. Кроме того, в этом же исследовании Rizzo и соавторы отметили, что метадоксин способствует воздержанию от приема алкоголя, по крайней мере в краткосрочной перспективе. Поэтому в совокупности с другими методами коррекции алкоголизма метадоксин позволяет более эффективно добиться ремиссии у таких пациентов, подкрепляя сопутствующие методы терапии [55]. В 2006 г. Guerrini и соавторы представили исследование по изучению эффективности метадоксина при непрерывной терапии алкогольной зависимости у 160 пациентов в течение 3 месяцев, в котором подтверждена целесообразность включения препарата в схемы антиалкогольной терапии [52].
Позитивное влияние метадоксина на нервно-психические компоненты алкогольной болезни связывают с его способностью повышать уровни ГАМК и ацетилхолина в тканях головного мозга за счет присутствия в его молекуле аниона пироглутаминовой кислоты [56]. Пироглутаминовая кислота подавляет нарушения памяти, индуцированные у животных введением скополамина, т.е. имеет выраженные ноотропные свойства [35]. Метадоксин повышает уровень дофамина в головном мозге [32] и тем самым способствует купированию посталкогольного синдрома.
В обзоре литературы за более чем 20 лет постмаркетингового наблюдения выявлено только несколько случаев побочных реакций при применении метадоксина: 2 — диареи, 1 — сыпи [33].
Препарат Ливерия® IC обладает важными в клиническом отношении свойствами:
1. Восстанавливает активность антиоксидантных систем, предотвращает гибель гепатоцитов и нормализует метаболическую функцию печени.
2. Предотвращает жировую инфильтрацию печени: воздействует на ключевое звено патогенеза стеатогепатита — ингибирует синтез и избыточное отложение этиловых эфиров, насыщенных и ненасыщенных жирных кислот.
3. Обладает антифибротическим эффектом — препятствует образованию фибронектина и коллагена.
4. Ускоряет процессы окисления и элиминации этанола и ацетальдегида, переводя последний в нетоксичный ацетат, тем самым устраняя токсическое влияние алкоголя.
5. Нормализует когнитивные функции, оказывает неспецифическое антидепрессивное и анксиолитическое действие. Сокращает время купирования абстинентного синдрома, снижает влечение к алкоголю.
Список литературы находится в редакции

/11_u/11_u.jpg)