Журнал «Травма» Том 16, №3, 2015
Вернуться к номеру
Напружено-деформований стан проксимального відділу стегнової кістки з наявністю порожнистого дефекту (осередок фіброзної дисплазії) в умовах остеосинтезу різними типами фіксаторів
Авторы: Лазарев І.А., Гук Ю.М., Олійник Ю.В., Скибан М.В. - ДУ «Інститут травматології та ортопедії НАМН України», м. Київ
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Розвиток аномальної фіброзної тканини на окремих ділянках стегнової кістки при фіброзній дисплазії призводить до змін її біомеханічних властивостей і спричинює патологічні переломи та деформації. Проведено скінченно-елементний аналіз напружено-деформованого стану біомеханічної системи «стегнова кістка — фіксатор» із наявністю порожнистого дефекту в проксимальному відділі стегнової кістки (імітаційна модель осередкової форми фіброзної дисплазії) з метою обґрунтування ефективності методик остеосинтезу різними типами фіксаторів при даній патології. На підставі комп’ютерної томографії сканів біомеханічної моделі стегнової кістки Sawbones за допомогою програмних пакетів Mimics та SolidWorks створені імітаційні комп’ютерні 3D-моделі інтактної стегнової кістки, стегнової кістки з порожнистим дефектом та різними типами металофіксаторів: пластини LСP (locking compression plate), кутової пластини для проксимального відділу стегна АВР (angled blade plate) та стегнового блокуючого стрижня FN (femoral interlocking nail). Аналіз напружено-деформованого стану у програмному середовищі ANSYS проводився на основних елементах стегнової кістки та металофіксаторів за показниками напруження (σ) за Мізисом та деформацій (ε). Наявність порожнистого дефекту в проксимальному відділі стегнової кістки призводить до зростання показників напруження та деформацій на 67,8 % по верхній поверхні шийки та на 34,2 % по нижній поверхні шийки порівняно з інтактною стегновою кісткою, що вказує на значний ризик виникнення патологічного перелому. В умовах різних методик остеосинтезу з’ясовано об’єктивно незаперечливі переваги пластини для проксимального відділу стегна (LСP) та стегнового блокуючого стрижня (FN) над кутовою пластиною (АВР).
Развитие аномальной фиброзной ткани в отдельных участках бедренной кости при фиброзной дисплазии приводит к изменениям ее биомеханических свойств и является причиной патологических переломов и деформаций. Проведен конечно-элементный анализ напряженно-деформированного состояния биомеханической системы «бедренная кость — фиксатор» с наличием полостного дефекта в проксимальном отделе бедренной кости (имитационная модель очаговой формы фиброзной дисплазии) с целью обоснования эффективности методик остеосинтеза разными типами фиксаторов при данной патологии. На основании компьютерной томографии сканов биомеханической модели бедренной кости Sawbones, с помощью программных пакетов Mimics и SolidWorks созданы имитационные компьютерные 3D-модели интактной бедренной кости, бедренной кости с полостным дефектом на уровне проксимального отдела и модели бедренной кости с полостным дефектом с разными типами металлофиксаторов: пластины LСP (locking compression plate), угловой пластины для проксимального отдела бедра АВР (angled blade plate), бедренного блокируемого стержня FN (femoral interlocking nail). Анализ напряженно-деформированного состояния в среде ANSYS проводился на основных элементах модели бедренной кости и элементах металлофиксаторов по показателям напряжения (σ) по Мизису и деформациям (ε). Наличие полостного дефекта в проксимальном отделе бедренной кости определяет рост показателей напряжений и деформаций на 67,8 % по верхней поверхности шейки и на 34,2 % по нижней поверхности шейки по сравнению с интактной бедренной костью, что указывает на значительный риск возникновения перелома. В условиях разных методик остеосинтеза выявлены объективно неоспоримые преимущества пластины для проксимального отдела бедренной кости (LСP) и бедренного блокируемого стержня (FN) над угловой пластиной (ABP).
The development of abnormal fibrous tissue in certain areas of the femur with fibrous dysplasia leads to the changes in its biomechanical properties and is the cause of pathological fractures and deformities. Finite element analysis of stress-strain state of the biomechanical system «femur — fixation device» with the presence of cavity defect in the proximal femur (simulation model of focal fibrous dysplasia) has been carried out in order to prove the effectiveness of osteosynthesis with different types of fixation devices in this pathology. Based on computed tomography scans of Sawbones biomechanical model of the femur, using Mimics and SolidWorks software packages, there were created simulation computer 3D-models of the intact femur, femoral bone with cavity defect and various types of fixation devices: LCP (locking compression plate), ABP (angled blade plate) for proximal femur and FN (femoral interlocking nail). Analysis of stress-strain state in the ANSYS environment has been carried out on the main elements of the femur and fixation devices in terms of stress (σ) by von Mises and deformities (ε). The presence of the cavity defect in the proximal femur determines the growth in the parameters of stress and strain by 67.8 % at the superior surface of the neck and by 34.2 % at the inferior surface of the neck as compared to the intact femur, indicating a significant risk of pathological fracture. When using different techniques of osteosynthesis, there were identified objectively undeniable advantages of plates for proximal femur (LCP) and femoral locking nail (FN) over the angled plate (ABP).
напружено-деформований стан, фіброзна дисплазія, патологічний перелом, металоостеосинтез.
напряженно-деформированное состояние, фиброзная дисплазия, патологический перелом, металлоостеосинтез.
stress-strain state, fibrous dysplasia, pathological fracture, osteosynthesis.
Статья опубликована на с. 62-70
Вступ
Фіброзна дисплазія (ФД) — вроджене неспадкове захворювання кісток скелета, що характеризується розвитком аномальної фіброзної тканини на окремих ділянках кістки. За формою ураження ФД може бути як моноосальною, так і поліосальною, за обсягом ураження — осередковою чи дифузною [1, 4]. Локальні структурні порушення в кістковій тканині при ФД призводять до змін її фізичних характеристик та є причиною патологічних переломів і деформацій, що значно ускладнюють перебіг захворювання, призводять до інвалідизації та соціальної дезадаптації хворих [4, 9, 10].
Однією з ключових проблем у лікуванні хворих із фіброзною дисплазією є варусна деформація проксимального відділу стегнової кістки (ПВСК), відома в літературі як деформація «палиці пастуха», що зустрічається при різних формах захворювання та має тенденцію до прогресування [4, 6]. Формування варусної деформації стегна призводить до суттєвих біомеханічних порушень, значно обмежуючи функціональні можливості хворого, та потребує хірургічної корекції [5, 6, 10]. Згідно з літературними даними, при хірургічному лікуванні патологічних переломів та деформацій ПВСК при ФД застосовуються як накісткові, так і інтрамедулярні фіксатори промислового чи індивідуального виробництва [2–6, 9, 10]. Така різноманітність металоконструкцій вказує на відсутність біомеханічно обґрунтованого підходу щодо вибору методики остеосинтезу при даному захворюванні та спонукає нас до додаткових досліджень.
На сучасному етапі розвитку технологій математичне моделювання біомеханічних систем є одним з основних способів аналізу різних варіантів остеосинтезу. Біомеханічним дослідженням травматичних ушкоджень та ортопедичних захворювань із застосуванням моделей стегнової кістки в літературі приділено досить багато уваги. Проте математичної оцінки поведінки кістки й її напружено–деформованого стану при структурному порушенні кістки при фіброзній дисплазії та інших диспластичних захворюваннях кісток скелета в умовах металоостеосинтезу в доступній нам літературі не знайдено.
Мета дослідження: математичний аналіз поведінки біомеханічної системи «стегнова кістка — фіксатор» в умовах наявного порожнистого дефекту ПВСК при статичному навантаженні середньостатистичною масою тіла та обґрунтування ефективності методик остеосинтезу ПВСК із різними типами фіксаторів при фіброзній дисплазії.
Матеріали та методи
На основі комп’ютерної томографії (КТ) сканів біомеханічної моделі стегнової кістки Sawbones, проведеної на рентгенівському мультиспіральному комп’ютерному томографі Light Speed Pro 32 фірми General Electric за допомогою програмного пакета Mimics в автоматичному та напівавтоматичному режимі, відтворена геометрія стегнової кістки (рис. 1) та засобами SolidWorks створена імітаційна комп’ютерна 3D–модель інтактної стегнової кістки (рис. 2).
На наступному етапі у моделі сформовано порожнистий дефект ПВСК (рис. 3) та встановлені елементи остеосинтезу (рис. 4–6).
Розрахунки НДС методом скінченних елементів (МСЕ) проведено на 5 моделях стегнової кістки:
1) інтактна стегнова кістка (рис. 2);
2) стегнова кістка з «патологічним осередком» (порожнистим дефектом) на рівні проксимального відділу (рис. 3);
3) стегнова кістка з патологічним осередком і фіксатором 1–го типу — пластина для проксимального відділу стегна LСP (locking compression plate) (рис. 4);
4) стегнова кістка з патологічним осередком і фіксатором 2–го типу — стегновий блокуючий стрижень FN (femoral interlocking nail) (рис. 5);
5) стегнова кістка з патологічним осередком і фіксатором 3–го типу — пластина для проксимального відділу стегна ABP (angle blade plate) (рис. 6).
У табл. 1 подані фізико–механічні характеристики біологічних тканин, що використовувались у розрахунку напружено–деформованого стану, які були отримані з літературних джерел [7].
Для забезпечення міцності елементів фіксації відламків у ділянці перелому за граничні показники вважали значення напруження для гвинтів та пластини зі сталі 12Х18Н10Т, що не перевищують 568 МРа.
При розрахунках МКЕ розглянутої біомеханічної системи в програмному комплексі ANSYS були прийняті такі основні гіпотези та припущення:
— усі матеріали вважали однорідними та ізотропними з відомими фізико–механічними характеристиками (табл. 1);
— завдання статичного аналізу вирішувалися у фізично– і геометрично–лінійний постановці, при цьому розглядали малі деформації і переміщення, внаслідок чого підтверджувався закон Гука для опису поведінки матеріалу.
Модель закріплена в дистальному кінці стегнової кістки, на головку якої у напрямку міжвиросткового підвищення колінного суглоба прикладена сила 750 Н. Розрахункова модель подана на рис. 7.
Підготовлена засобами SolidWorks твердотільна модель експортована в програмне забезпечення ANSYS, де створена скінченно–елементна модель (рис. 8), що налічувала 1 047 894 вузлів та 639 498 елементів, середній розмір скінченного елемента не більше 1 мм.
/65/65.jpg)
При цьому переважали тетраедричні елементи з квадратичною апроксимацією функцій. З метою підвищення точності розрахунків у критичних зонах скінченно–елементна сітка була ущільнена. Аналіз НДС за показниками напруження (Q) за Мізисом та деформацій (E) проводили на основних елементах моделі — стегновій кістці та елементах металофіксаторів.
Результати розрахунків НДС біомеханічної моделі інтактної стегнової кістки без патологічного осередка
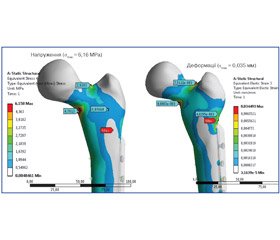
За розрахунком показників НДС моделі інтактної стегнової кістки виявлено напруження, що зосереджено на шийці стегнової кістки, максимальні значення яких становили: по нижній поверхні шийки — 6,12 МРа; по верхній поверхні шийки — 4,62 МPа. Показники деформацій на шийці були 0,0012 мм, показники переміщення моделі — 39,89 мм (рис. 9).
Отримані показники взято до уваги для порівняльного аналізу в подальших розрахунках.
Результати розрахунків біомеханічної моделі стегнової кістки з патологічним осередком
За розрахунком показників НДС моделі з патологічним осередком виявлено зростання показників напруження на шийці стегнової кістки по нижній поверхні на 43,13 % — до 8,21 МРа; по верхній поверхні на 67,75 % — до 7,75 МРа (рис. 10).
Результати розрахунків біомеханічної моделі стегнової кістки з патологічним осередком і фіксатором 1–го типу
За розрахунком показників НДС моделі з патологічним осередком та фіксатором 1–го типу виявлено зменшення показників напруження на шийці стегнової кістки по нижній поверхні на 65,84 % — до 2,09 МРа; по верхній поверхні на 74,89 % — до 1,16 МРа порівняно з показниками моделі без фіксатора (рис. 11).
Наявність фіксатора, що бере на себе основне навантаження, зміщує ділянки концентрації напруження у дистальному напрямку від патологічного осередку.
Результати розрахунків біомеханічної моделі стегнової кістки з патологічним осередком і фіксатором 2–го типу
За розрахунком показників НДС моделі з патологічним осередком та фіксатором 2–го типу виявлено зменшення показників напруження на шийці стегнової кістки по нижній поверхні на 66,18 % — до 2,07 МPа; по верхній поверхні на 25,54 % — до 5,8 МPа; показники максимальних деформацій на шийці не змінились, проте показники переміщення моделі зменшились на 53,25 % — до 18,65 мм порівняно з показниками моделі без фіксатора (рис. 12).
Результати розрахунків біомеханічної моделі стегнової кістки з патологічним осередком і фіксатором 3–го типу
За розрахунком показників НДС моделі з патологічним осередком та фіксатором 3–го типу виявлено зменшення показників напруження на шийці стегнової кістки по нижній поверхні на 21,73 % — до 4,79 МPа; по верхній поверхні на 15,58 % — до 3,9 МPа; показники максимальних деформацій на шийці зменшились на 25 % — до 0,009 мм; показники переміщення моделі зменшились на 25,6 % — до 29,68 мм порівняно з показниками моделі без фіксатора (рис. 13).
Порівняльний аналіз показників НДС на моделях стегнової кістки подано у табл. 2.
Показники напруження (МРа), деформацій (мм) на нижній та верхній поверхні шийки моделі стегнової кістки та переміщення моделі (мм) залежно від типу фіксатора подані на діаграмах (рис. 14).
Із наведених графіків (рис. 14) можна спостерігати, що при остеосинтезі фіксаторами 1–го та 2–го типу показники напруження на нижній поверхні шийки стегнової кістки знижуються майже рівномірно — до 2,09 МРа (65,84 %) та 2,07 МРа (66,18 %) відповідно. При остеосинтезі фіксатором 3–го типу показники напруження знижуються лише до 7,79 МРа (21,73 %).
Показники напруження на верхній частині шийки мінімальні при остеосинтезі фіксатором 1–го типу (1,16 МРа) та збільшуються на 25,54 % при остеосинтезі фіксатором 2–го типу (до 5,8 МРа) та на 15,58 % при остеосинтезі фіксатором 3–го типу (3,9 МРа). Збільшення показників напруження при застосуванні фіксатора 2–го типу до 5,8 МРа, що перевищують на 25,54 % нормальні показники (4,62 МРа), пояснюється самою методикою остеосинтезу, при якій імплантація інтрамедулярного стрижня проходить через медіальну частину великого вертлюга із захватом частково базальної частини шийки. Проте відсутність змін показників деформацій на шийці стегнової кістки вказує на стабільність остеосинтезу фіксатором 2–го типу.
Показники деформацій на шийці стегнової кістки при остеосинтезі фіксатором 2–го типу (0,012 мм) відповідають деформаціям стандартної моделі, що вважаються за норму (0,012 мм). Показники деформацій на шийці моделі з фіксатором 1–го та 3–го типу знижуються на 75 % (до 0,003 мм) та 25 % (до 0,009 мм) відповідно, що може свідчити про більшу жорсткість фіксації саме в ділянці шийки при використанні пластини LСP та кутової пластини ABP для проксимального відділу стегна.
В усіх випадках при статичному навантаженні показники НДС металоконструкцій не перевищували границі міцності та не призводили до руйнування фіксуючих елементів.
Висновки
1. Проведений аналіз показників НДС імітаційної моделі стегнової кістки при статичному навантаженні середньостатистичною масою тіла виявив ділянки напруження та деформацій, що зосереджені на верхній та нижній частинах шийки стегнової кістки (дуги Адамса), що відповідає загальноприйнятому факту та підтверджує валідність моделі.
2. При наявності порожнистого дефекту в проксимальному відділі імітаційної моделі стегнової кістки показники напруження збільшилися на 67,8 % (верхня поверхня шийки) та на 34,2 % (нижня поверхня шийки), що вказує на значний ризик виникнення патологічного перелому даної локалізації.
3. Остеосинтез усіма трьома типами фіксаторів при наявності порожнистого дефекту на рівні проксимального відділу стегнової кістки забезпечує надійність фіксації, беручи основне навантаження на себе та знижуючи показники напруження та деформацій на шийці стегнової кістки.
4. Пластина для проксимального відділу стегна LСP (фіксатор 1–го типу) та стегновий блокуючий стрижень FN (фіксатор 2–го типу) при остеосинтезі проксимального відділу стегна з наявністю порожнистого дефекту мають незаперечливу об’єктивну перевагу над кутовою пластиною ABP (фіксатор 3–го типу).
1. Волков М.В., Самойлова Л.И. Фиброзная остеодисплазия. — М.: Медицина, 1973. — 167 с.
2. Зубаиров Т.Ф. Хирургическое лечение полиоссальных форм фиброзной дисплазии длинных трубчатых костей нижних конечностей у детей // Травматология и ортопедия России. — 2008. — № 2(48). — С. 25–31.
3. Снетков А.И. Оперативное лечение полиоссальной формы фиброзной остеодисплазии у детей и подростков // Вестник хирургии им. И.И. Грекова. — 1988. — № 6. — С. 85–89.
4. Di Caprio M.R. Fibrous dysplasia. Pathophysiology, evaluation, and treatment / Di Caprio M.R., Enneking W.F. // J. Bone Joint Surg. Am. — 2005. — Vol. 87, № 8. — P. 848–864.
5. Freeman В.H. Multiple osteotomies with Zickel nail fixation for polyostotic fibrous dysplasia involving the proximal part of the femur / В.H. Freeman, E.W. Bray, L.C. Meyer // J. Bone and Joint Surg. — 1987. — Vol. 69–A, № 4. — P. 691–698.
6. Guille J.T. Fibrous dysplasia of the proximal part of the femur. Long–term results of curettage and bone–grafting and mechanical realignment / Guille J.T., Kumar S.J., Mac–Ewen G.D. // J. Bone Joint Surg. Am. — 1998. — Vol. 80, № 5. — P. 648–658.
7. Kubichek M. Stress strain analysis of knee joint / Kubichek M., Florian Z. // Engineering mechanics. — 2009. — Vol. 16, № 5. — P. 315–322.
8. Riminucci M. Fibrous Dysplasia as a Stem Cell Disease / Riminucci M., Saggio I., Robey P.G., Bianco P. // J. Bone Miner. Res. — 2006. — Vol. 21, № 2. — P. 125–131.
9. Stanton R.P. The surgical management of fibrous dysplasia of bone / Stanton R.P., Ippolito E., Springfield D., Lindaman L., Wientroub S., A. Leet // Orphanet J. Rare Dis. — 2012. — № 7.
10. Stephenson R.B. Fibrous dysplasia. An analysis of options for treatment / Stephenson R.B., London M.D., Hankin F.M., Kaufer H. // J. Bone Joint Surg. Am. — 1987. — № 69. — P. 400–409.

/63/63.jpg)
/64/64.jpg)
/64/64_2.jpg)
/65/65_2.jpg)
/66/66.jpg)
/67/67.jpg)
/67/67_2.jpg)
/68/68.jpg)