Статья опубликована на с. 41-46
Вступ
Підвищена увага до антибіотикорезистентності обумовлена колосальними соціальними та економічними втратами від інфекційних захворювань, викликаних стійкими до більшості доступних антибіотиків збудниками, особливо в умовах стаціонару і на тлі недостатнього прогресу в галузі розробки й впровадження нових антимікробних препаратів. Це дало підстави для впровадження концепції «паралельного збитку» (англ. collateral damage), що передбачає побічний екологічний ефект від використання антимікробних препаратів, суттю якого є селекція полірезистентних штамів мікроорганізмів і викликані ними колонізація або інфекційний процес [3].
Наприкінці XX століття широке застосування антибіотиків, активних щодо грамнегативних мікроорганізмів (цефалоспорини III генерації, фторхінолони II генерації, аміноглікозиди), у клінічній практиці призвело до селекції резистентних грампозитивних мікроорганізмів (метицилін-/оксацилінрезистентний S. aureus — MRSA, ванкоміцинрезистентний Enterococcus — VRE, пеніцилін- і полірезистентний S. pneumoniae). Разом із MRSA питома вага штамів VRE є індикатором глобального поширення мультирезистентних збудників нозокоміальних інфекцій (НКІ) в популяції адміністративного регіону [9, 17].
Наприклад, нещодавно було встановлено, що штами MSSA (метицилін-чутливий S. aureus) та MRSA вийшли за межі лікарень, перетворившись на головний патоген навколишнього середовища з підвищеною вірулентністю й трансмісивними характеристиками (СА-MRSA). Останній зберіг гени MRSA і набув ряд нових, наприклад ген, що кодує цитотоксичний лейкоцидин. У результаті акронім MRSA зараз розшифровується як multiantibiotic-resistant S. аureus [19].
На сучасному етапі клінічних досліджень встановлено основні критерії резистентності бактеріальних патогенів, асоційованих з епідемічними хворобами, які еволюціонували в MRSA-форми (мультирезистентні), серед них у першу чергу збудники нозокоміальних інфекцій (НКІ) (ESKAPE): Enterococcus faecium, Enterococcus faecalis (VRE-штами), S. aureus, S. еpidermidis (MRSA-штами), Klebsiella pneumoniae (штами, что продукують ESBL — β-лактамази розширеного спектра дії, штам із гіперпродукцією хромосомних β-лактамаз і β-лактамних інгібіторів — резистентних туморендотеліальних маркерів), Acinetobacter baumannii (карбапенемрезистентні штами), Pseudomonas aeruginosa (карбапенем- і хінолонрезистентні штами), Enterobacter spp. (хромосомні β-лактамази і ESBL, продукція яких була підтверджена диско-дифузійним методом із застосуванням цефтазидиму й цефтазидиму клавуланату, цефотаксиму й цефотаксиму клавуланату); а також штами Escherichia coli, Proteus mirabilis, Haemophilus influenzae, Campylobacter jejuni, Citrobacter freundii, Burkholderia cepacia, Clostridium difficile, Salmonella spp., Serratia spp., Stenotrophomonas maltophilia, Streptococcus pneumoniae та M. tuberculosis [12, 19, 22].
За даними Американського товариства інфекційних хвороб (Infectious Diseases Society of America — IDSA), VRE (усіх видів) були виділені в пацієнтів стаціонарних відділень приблизно в 30 % випадків, серед яких Enterococcus faecium становить 77 %, Enterococcus faecalis — 9 % [12]. За частотою внутрішньолікарняних інфекцій (майже 12 %) Enterococcus spp. посідають третє місце в лікарнях Німеччини [18]. Неферментуючі бактерії — полірезистентні P. aerugenosa і Acinetobacter baumannii — складають основний інфекційний спектр у відділеннях реанімації й інтенсивної терапії (ВРІТ) у Росії [5, 6].
Найбільш типовим для Enterococcus spp. є розвиток інфекції сечовивідних шляхів переважно в літніх пацієнтів, пов’язаний з частотою катетеризації сечового міхура й операцій на органах черевної порожнини. Причому встановлено, що в суперінфікуванні в умовах загальнохірургічного стаціонару велику роль відіграє кишкова флора, зокрема мікроорганізми роду Enterobacter становлять в середньому 53 % [1]. У травматологічних стаціонарах, за даними українських авторів, інфекційні ускладнення в пацієнтів із політравмою починають розвиватися в ранньому періоді травматичної хвороби (від 3 до 10 діб), причому в 73 % пацієнтів збудники виділяються більше ніж з однієї анатомічної ділянки. У структурі збудників госпітальної інфекції в постраждалих з політравмою частка грамнегативних бактерій становить 59 ± 2 %, причому найбільш часто зустрічаються: P. aeruginosa, K. pneumoniae і S. aureus [11].
Сьогодні ведуться дискусії про етіологічне значення внутрішньоклітинної локалізації бактерій і грамнегативної флори в розвитку бронхолегеневих ускладнень на тлі травматичного пошкодження органів грудної клітки. Мікрофлора нижніх дихальних шляхів у хворих із тяжкою політравмою, госпіталізованих у відділення загальної реанімації, представлена таким чином: значення показника контамінації S. аureus становить 58,1 %, Klebsiella spр. — 54,8 %, а асоціація з Enterobacter spр. — 37,5 % [3]. Але треба зауважити, що оцінка етіологічної ролі мікроорганізмів, виділених із нестерильних локусів (мокрота, ендотрахеальний аспірат та ін.), повинна проводитись з урахуванням інших факторів ризику нозокоміальної інфекції, а саме: ШВЛ понад 48 годин, оцінка за шкалою ком Глазго менше ніж 9 балів, факт аспірації шлункового умісту, оперативне втручання на органах черевної та грудної порожнини, інша соматична патологія в анамнезі [8, 22].
У 2010 році, за даними Американського товариства інфекційних хвороб, ранова інфекція, викликана асоціацією з Enterobacter spр., становить до 75 % усіх випадків у структурі причин післяопераційної летальності [23]. Британський інститут стандартів визначив причини смертності, захворюваності, число ліжко-днів та лікарняні економічні витрати, викликані MRSA і стійким до цефалоспоринів III покоління E. coli (G3CREC), у 31 країні, які брали участь у Європейській системі нагляду протимікробної резистентності. Установлено, що на 2015 рік інфекції кровотоку, пов’язані зі штамами G3CREC, можливо, будуть становити основний показник летальності з причин НКІ в лікарняній мережі та економічних витрат [14, 20]. Наприклад, за даними вітчизняного пілотного дослідження 2008–2010 рр., резистентність клінічних штамів E. coli до цефепіму в окремих регіонах України варіювала в межах від 5,0 до 100,0 %. У цілому до цефепіму резистентними були чверть досліджених штамів [7]. Причому використання карбапенемів та цефалоспоринів IV покоління часто економічно невиправдане, а крім того, є тимчасовим рішенням через розвиток стійкої й тривалої резистентності [14].
У зв’язку з цим доцільним видається проведення змін у комбінованій антибіотикотерапії з раціональним використанням наявних антибіотиків шляхом варіації їх доз, тривалості дії та часу введення [2]. Перехід із комбінованої терапії на широкий спектр превентивної емпіричної терапії з подальшим своєчасним застосуванням антибактеріальних препаратів у відповідь на мікробіологічні та клінічні результати потрібно розглядати як застосування принципу індивідуальної деескалаційної антибіотикотерапії (ІДТ). Дотепер є тільки окремі фундаментальні дослідження, які вказують на високу потенційну можливість цього підходу до інтенсивної терапії [6, 10, 13, 21].
Отже, у вузькоспеціалізованих ВРІТ з налагодженою системою контролю мікробіологічного пейзажу визначення мінімальної переважної концентрації дозволяє знизити зростання полірезистентної нозокоміальної мікрофлори (MRSA, VRE, ESBL, IMP-R, CRE) та патогенних збудникiв навколишнього середовища з підвищеною вірулентністю, що формують преморбідний фон (СА-MRSA, PVL-SA, MLSB-SA), поширеність якої залежить від характеру збудника, організації санітарно-епідеміологічного режиму в лікувально-профілактичних установах і становить від 2,1 до 66,5 %. Невід’ємною частиною ІДТ є використання адекватної респіраторної, інотропної та гемодинамічної підтримки, клініко-лабораторного моніторингу, методів активної та своєчасної замісної терапії [15, 16, 21].
Проте дані інших оглядів літератури не вказують на ризики розвитку нозокоміальної інфекції в постраждалих з поєднаною травмою та не дають повного уявлення про ефективність та економічну доцільність ІДТ при розвитку ускладнень різного генезу й тяжкому стані постраждалого.
Мета дослідження
Провести оцінку поширеності патології, пов’я–заної зі збудниками ESKAPE — нозокоміальної інфекції, у постраждалих із тяжкою поєднаною абдомінальною травмою. Установити вплив тяжкості поєднаної травми й строків лікування постраждалих у відділенні реанімації на ризик розвитку нозокоміальної інфекції.
Матеріали і методи дослідження
Проведено одночасне багатофакторне проспективне дослідження 41 постраждалого з тяжкою поєднаною абдомінальною травмою (ПАТ), які перебували на лікуванні в Київській міській клінічній лікарні швидкої медичної допомоги, відділенні політравми з ліжками інтенсивної терапії (м. Київ) у 2014 році. Рандомізація загального масиву постраждалих на підгрупи проводилась за клініко-нозологічною характеристикою, залежно від тяжкості поєднаної травми, а саме: краніоторакоабдоміноскелетну (КТАС) травму отримали 22 особи, що становить 53,7 % від загального масиву постраждалих, краніоторакоабдомінальну (КТА) — 6 (14,6 %), торакоабдомінальну (ТА) — 6 (14,6 %), торакоабдоміноскелетну (ТАС) — 3 (7,3 %), краніоабдоміноскелетну (КАС) — 2 (4,9 %), абдомінально-скелетну (АС) — 2 (4,9 %).
У нашому дослідженні застосовано протокол «Антимікробна профілактика (АМП) в хірургії пошкоджень», затверджений на V з’їзді Міжрегіональної асоціації громадських об’єднань анестезіологів і реаніматологів Північно-Західного регіону в 2010 році зі змінами, відповідно до принципу ІДТ, з додатковим визначенням чутливості до мультирезистентних ESKAPE форм збудників НКІ та штамів преморбідного фону і їх клінічних ізолятів.
Дискриптивний багатофакторний аналіз клініко-епідеміологічних даних визначали як середнє арифметичне значення (М) та стандартну похибку (m) у вигляді M ± m. Для характеристики підгруп досліджень для ознак з розподілом, що не відповідає закону Гаусса, визначали медіану (Ме), нижній (Q1) і верхній (Q3) квартилі (для 25-го та 75-го процентилю).
З метою оцінки поширеності патології, пов’язаної з НКІ, визначали показник відношення шансів та 95% довірчий інтервал (методом Клоппера — Пірсона) розвитку НКІ в підгрупах постраждалих залежно від верифікації штамів мікрофлори в сечі, мокротинні та ранової поверхні або вмісті дренажів.
Оцінку ступеня взаємозв’язку між клініко-статистичними показниками проводили шляхом обчислення коефіцієнта лінійної кореляції за Пірсоном (rp Pearson test). На основі цього за допомогою методу бінарної логістичної регресії оцінювали вплив цих факторів на ризик розвитку НКІ, який наведено у вигляді показника рInR та довірчого інтервалу (ДІ95%).
Для встановлення міцності зв’язку між трьома клініко-статистичними показниками проведена апроксимація значень лінії тренда кореляційного зв’язку з розрахунком коефіцієнта детермінації (r2). Статистично значимими формули парної регресії вважаються при p < 0,01 [4].
Для створення моделі прогнозування (зокрема, об’єктивної екстраполяції) нами було застосовано метод експоненційного згладжування варіацій значень кореляційної залежності між показниками. Значення постійної згладжування (α = 2/N + 1) слід приймати в межах від 0,01 до 0,3.
Отримані дані перевірено з застосуванням пакета прикладних програм Statistica 8.0 (StatSoft Inc., США, 2007 р.).
Результати дослідження і обговорення
За соціально-епідеміологічною характеристикою більшу частину постраждалих становить населення навчально-працездатного віку — 16 (39,0 %) та активно-працездатного віку — 17 (41,5 %). Передпенсійного та пенсійного віку було 8 (19,5 %) осіб. Серед загального масиву дослідження чоловіків було 34 (82,0 %) та жінок — 7 (17,0 %).
Середній показник індексу тяжкості травми за шкалою NISS становить 26 ± 3 бали. Середній строк перебування у ВРІТ складає 11 ± 2 доби, причому середній показник ліжко-діб стаціонарного лікування — 31 ± 4 доби.
Установлено, що в першу чергу поширеність патології, пов’язаної з НКІ, обумовлена P. aeruginoza, що складає 58,5 %, причому ймовірність розвитку НКІ — 1,41 (95% ДI 0,78–2,01) (табл. 1). 56,1 % випадків НКІ пов’язані з K. pneumoniae, що відповідає шансу розвитку НКІ 1,28 (95% ДI 0,65–1,91).
Треба зауважити, що резистентні штами Е. coli, Proteus mirabilis та гриби роду Candida зустрічаються майже в 50 % бактеріологічних досліджень, що відповідає шансу розвитку НКІ 0,95; 1,05 та 1,16 відповідно. Значною мірою НКІ обумовлена присутністю в постраждалих Enterobacter spp. — у 36,6 %, S. aureus (MR і MS) — у 39,1 % та Enterococcus faecium et faecalis (VRE) — у 43,9 %, що відповідає шансу розвитку НКІ за іх рахунок 0,63; 0,69 та 0,78 відповідно.
З метою встановлення ознаки-предиктора розвитку НКІ проведено кореляційний аналіз залежності показника кількості штамів НКІ від строків лікування постраждалих у ВРІТ. За отриманими даними, відповідно до формули лінійного тренду сильної (rP = 0,848) кореляційної залежності встановлено, що показник інтегрального ризику розвитку НКІ рInR може бути розрахований як:
/43.jpg)
(1)
де р — показник інтегрального ризику розвитку нозокоміальної інфекції; Х — строки лікування у ВРІТ (діб).
За формулою (1) методом бінарної логістичної регресії у підгрупах постраждалих залежно від тяжкості поєднаної травми та строків лікування у ВРІТ проведено розрахунки рInR (табл. 2).
Доведено, що в постраждалих з украй тяжкою КТАС-травмою середній показник строку лікування у ВРІТ становив 14 (7Q1–19Q3) діб, при загальному терміні лікування 33 (22Q3–48Q3) ліжко-доби. Це обумовлює визначений високий показник pInR, який становить 0,73 (95% ДI 0,40–0,88) або 73 % у групі постраждалих з украй тяжкою КТАС-травмою. Також високий показник pInR отримано в групі постраждалих із тяжкою травмою ТАС — 0,65 (95% ДI 0,45–0,80) та АС — 0,80 (95% ДI 0,50–0,90), з середнім показником строку лікування у ВРІТ 12 (8Q1–16Q3) та 16 (9Q1–20Q3) діб відповідно.
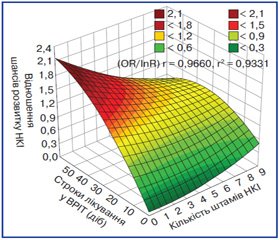
Ураховуючи етіологічну роль збудників ESKAPE в розвитку НКІ та інфекційних ускладнень у пацієнтів з політравмою вже в ранньому післяопераційному періоді, нами визначено кореляційну залежність високої сили (rP = 0,966) між показником інтегрального ризику розвитку НКІ та відношенням шансів розвитку НКІ (рис. 1).
У цілому це відображає багатофакторний взаємо–зв’язок між клініко-нозологічною та інфекційно-епідеміологічною характеристикою постраждалих із ПАТ. Тому методом бінарної логістичної регресії з метою прогнозування розвитку НКІ вже на госпітальному етапі та визначення лікувально-діагностичної тактики проведено оцінку впливу строків лікування постраждалих у ВРІТ, кількості штамів видового складу мікрофлори НКІ на відношення шансів розвитку НКІ у постраждалих із ПАТ (рис. 2).
Згідно з отриманими даними, спостерігається неухильне зростання відношення шансів розвитку НКІ (OR = 0,94; 95% ДI 0,31–1,56) у постраждалих із тяжкою ПАТ при лікуванні у ВРІТ понад 16 діб (9–16). Причому відмічається 50% ризик розвитку НКІ (рInR = 0,5) з 9–10-ї доби лікування у ВРІТ, що обумовлено наявністю 4–5 штамів збудників ESKAPE у постраждалого. Взагалі, з 25-ї доби (рInR → 1,0) практично всі постраждалі інфіковані збудниками ESKAPE, що не залежить від кількості штамів видового складу мікрофлори НКІ.
Отже, за даними проведеного клініко-епідеміологічного моніторингу та верифікації штамів мікрофлори в постраждалих із тяжкою ПАТ, які знаходились на лікуванні у ВРІТ відділення політравми, встановлено предиктори розвитку НКІ, а саме в першу чергу тяжкість поєднаної травми та строки лікуванні у ВРІТ.
Висновки
1. Установлено, що показник строку лікування у ВРІТ являє собою предиктор розвитку нозокоміальної інфекції. Причому межа 50% ризику розвитку НКІ відповідає 9-й та 10-й добі лікування у ВРІТ, що обумовлено наявністю 4–5 штамів збудників ESKAPE у постраждалого.
2. У групі постраждалих з украй тяжкою КТАС-травмою ризик розвитку НКІ становить 0,73 (73 %) та в постраждалих із тяжкою ТАС-травмою — 0,65 (65 %). Ці показники обумовлені в першу чергу лікуванням постраждалих із тяжкою КТАС-травмою у ВРІТ у середньому впродовж 7–19 діб, що становить 53,7 % від загального масиву дослідження.
3. Поширеність патології, пов’язаної з нозокоміальною інфекцією, в першу чергу обумовлена Pseudomonas aeruginoza (58,5 %) та Klebsielia pneumoniae (56,1 %), причому шанс розвитку НКІ становить 1,41 та 1,28 відповідно. Також майже в 50 % бактеріологічних досліджень зустрічалися ізоляти Е. coli, Proteus mirabilis та гриби роду Candida.
4. Визначення ризику розвитку нозокоміальної інфекції в постраждалих повинно застосовуватись у першу чергу при лікуванні у ВРІТ, що входить в структуру заходів інфекційного контролю та обумовлює ефективність та економічну доцільність індивідуальної деeскалаційної антибіотикотерапії.
Список литературы
1. Бесчастнов В.В., Измайлов С.Г., Рябков М.Г., Кудыкин М.Н. Хирургические способы профилактики нозокомиальной инфекции при лечении инфицированных ран мягких тканей // Раны и раневые инфекции: –Мат-лы I Международного конгресса. Москва, 11–13 октября 2012 г. — С. 42-43.
2. Галимзянов Ф.В. Лечение инфицированных ран и раневой инфекции: Учебное пособие. — Екатеринбург: УГМА, 2012. — 88 с.
3. Козлов Р.С. Селекция резистентных микроорганизмов при использовании антимикробных препаратов: концепция «параллельного ущерба» // Клиническая микробиология и антимикробная химиотерапия. — 2010. — 12 (4). — С. 284-294.
4. Медик В.А., Токмачев М.С. Математическая статистика в медицине: Учеб. пособие. — М.: Финансы и статистика, 2007. — 459 с.
5. Руднов В.А., Бельский Д.В., Дехнич А.В., исследовательская группа РИОРИТа. Инфекции в ОРИТ России: результаты национального многоцентрового исследования // Клиническая микробиология и антимикробная химиотерапия. — 2011. — 13 (4). — С. 294-303.
6. Савельев В.С., Гельфанд Б.Р., Яковлев С.В. и др. Российские национальные рекомендации «Стратегия и тактика применения антимикробных средств в лечебных учреждениях России». — М., 2012. — 92 с.
7. Салманов А.Г., Толстанов А.К., Мариевский В.Ф. Антибиотикорезистентность нозокомиальных штаммов Escherichia coli в хирургических стационарах Украины // Клин. инфектология и паразитология. — 2013. — №1 (04). — С. 35-50.
8. Сепсис: классификация, клинико-диагностическая концепция и лечение: Практ. руководство / Под ред. В.С. Савельева, Б.Р. Гельфанда. — 3-е изд., доп. и перераб. — М.: ООО «Изд-во «Медицинское информационное агентство», 2013. — 360 с.
9. Шляпников С.А., Сидоренко С.В. Резистентные штаммы Staphylococcus aureus — растущая проблема в лечении инфекций мягких тканей // Инфекции в хирургии. — 2010. — Т. 8, № 3. — С. 40-46.
10. Черний В.И., Колесников А.Н., Кузнецова И.В. Антибактериальная терапия в медицине критических состояний / Под ред. Р.И. Новиковой. — 2-е изд., исправл. и доп. — Донецк: Издатель Заславский А.Ю., 2010. — 392 c.
11. Хижняк А.А., Волкова Ю.В. Дифференцированный подход к антибиотикотерапии в комплексе интенсивной терапии больных с травматической болезнью // Укр. хіміотерапевтичний журнал. — 2010. — № 1–2 (23) — С. 102-106.
12. Аntibiotic resistance threats in the United States. U.S. Department of Health Human Services Centers for Disease Control and Prevention. — 2013. — P. 67.
13. De-escalation of antimicrobial treatment for adults with sepsis shock (Review) // Reprint of a Cochrane review, prepared and maintained by The Cochrane Collaboration and published in The Coch, 2010, Issue 12.
14. De Kraker M.E.A., Wolkewitz M., Davey P.G., Koller W., Berger J. et al. Burden of antimicrobial resistance in European hospitals: excess mortality and length of hospital stay associated with bloodstream infections due to Escherichia coli resistant to third-generation cephalosporins // J. Antimicrob. Chemother. — 2011. — 66. — Р. 398-407.
15. Díaz-Martín et al. Antibiotic prescription patterns in the empiric therapy of severe sepsis: combination of antimicrobials with different mechanisms of action reduces morta–lity // Critical Care. — 2012. — № 16. — R223.
16. Durmaz S., Kiraz A., Toka Ozer T., Percin D. Macrolide-Lincosamide-Streptogramin B Resistance Phenotypes in Staphylococcus Aureus // Eur. J. Gen. Med. — 2014. — 11 (4). — Р. 217-220. doi: 10.15197/sabad.1.11.75
17. Goff D.A., Dowzicky M.J. Prevalence and regional variation in meticillin-resistant Staphylococcus aureus (MRSA) in the USA and comparative in vitro activity of tigecycline, a gly–cylcycline antimicrobial // J. Med. Microbiol. — 2007. — 56 (9). — Р. 1189-1195. doi:10.1099/jmm.0.46710-0
18. Enterokokken mit Vancomycin-resistenz in deutschen Krankenhaeusern 2008–2009 // RKI. Epid. Bull. — 2010. — 44. — Р. 428-36.
19. Katayama Y., Matsuo M., Sasaki T., Morimoto Y., Sekiguchi A., Baba T. Multi-drug-resistant Staphylococcus aureus and future chemotherapy // J. of Infect. and Chemo–ther. — 2014. — Vol. 20. — P. 593-601. doi: http://dx.doi.org/10.1016/ j.jiac.2014.08.001
20. Marlieke E.A. de Kraker, Peter G. Davey, Hajo Grundmann, on behalf of the BURDEN study group. Mortality and Hospital Stay Associated with Resistant Staphylococcus aureus and Escherichia coli Bacteremia: Estimating the Burden of Antibiotic Resistance in Europe // Plos Med. — October 11, 2011. — e1001104.
21. Morel J., Casoetto J., Jospe R. et al. De-escalation as part of a global strategy of empiric antibiotherapy management. A retrospective study in a medico-surgical intensive care unit // Critical Care. — 2010. — № 14. — R225. doi:10.1186/ cc9373
22. Sandiumenge A., Lisboa T., Gomez F. et al. Effect of Antibiotic Diversity on Ventilator-Associated Pneumonia Caused by ESKAPE Organisms // Chest. — 2011. — 140 (3). — Р. 643-651.
23.
Solomkin J.S., Mazuski J.E., Bradley J.S. et al. Diagnosis and management of complicated intra-abdominal infection in adults and children: guidelines by the Surgical Infection Society and the Infectious Diseases Society of America // Clin. Infect. Dis. — 2010. — 50 (2). — Р. 133-164.
1. Beschastnov V.V., Izmaylov S.G., Ryabkov M.G., Kudykin M.N. (2012) Khirurgicheskie sposoby profilaktiki nozokomialnoy infektsii pri lechenii infitsirovannykh ran myagkikh tkaney [Surgical methods for the prevention of nosocomial infection in the treatment of infected wounds of soft tissues]. Proceedings of the Rany i ranevye infektsii. Materialy I Mezhdunarodnogo kongressa (Russia, Moscow, October 11-13, 2012) Moscow: Rany i ranevye infektsii, pp.42-43.
2. Galimzyanov F.V. (2012) Lechenie infitsirovannykh ran i ranevoy infektsii. Uchebnoe posobie [Treatment of infected wounds and wound infections. Textbook.]. Yekaterinburg: UGMA. (in Russian).
3. Kozlov R.S. (2010) Selektsiya rezistentnykh mikroorganizmov pri ispolzovanii antimikrobnykh preparatov: kontseptsiya «parallelnogo ushcherba» [Selection of resistant organisms using antimicrobials: the concept of "parallel damage"]. Clinical Microbiology and Antimicrobial Chemotherapy. Vol. 12, no. 4, pp.284-294.
4. Medik V.A., Tokmachev M.S. (2007) Matematicheskaya statistika v meditsine: ucheb. Posobie [Mathematical Statistics in Medicine: textbook]. Moscow. (in Russian).
5. Rudnov V.A., Belskiy D.V., Dekhnich A.V., issledovatelskaya gruppa RIORITa (2011) Infektsii v ORIT Rossii: rezultaty natsionalnogo mnogotsentrovogo issledovaniya [Infections in the ICU Russia: results of a national multicenter study]. Clinical Microbiology and Antimicrobial Chemotherapy, Vol. 13, no. 4, pp. 294-303.
6. Savelev V.S., Gelfand B.R., Yakovlev S.V. (2012) Rossiyskie Natsionalnye Rekomendatsii «Strategiya i taktika primeneniya antimikrobnykh sredstv v lechebnykh uchrezhdeniyakh Rossii» [Russian National Recommendations "Strategy and tactics of antimicrobial agents in hospitals of Russia."]. Moscow. (in Russian).
7. Salmanov A.G., Tolstanov A.K., Marievskiy V.F. (2013) Antibiotikorezistentnost nozokomialnykh shtammov Escherichia coli v khirurgicheskikh statsionarakh Ukrainy [Antibiotic resistance of nosocomial strains of Escherichia coli in surgical hospitals Ukraine]. Klin. infectology and parasitology, Vol.4, no.1, pp.35-50.
8. Savelev V.S., Gelfand B.R. (2013) Sepsis: klassifikatsiya, kliniko-diagnosticheskaya kontseptsiya i lechenie: prakticheskoe rukovodstvo [Sepsis: classification, clinical and diagnostic concept and treatment: a practical guide]. Moscow: OOO «Izdatelstvo - Meditsinskoe informatsionnoe agentstvo». (in Russian).
9. Shlyapnikov S.A., Sidorenko S.V. (2010) Rezistentnye shtammy Staphylococcus aureus – rastushchaya problema v lechenii infektsiy myagkikh tkaney [Resistant strains of Staphylococcus aureus – rastuschaya problem in the treatment of soft tissue infections]. Infections in Surgery, Vol.8, no.3, pp. 40-46.
10. Cherniy V.I., Kolesnikov A.N., Kuznetsova I.V., Novikova R.I. (2010) Antibakterialnaya terapiya v meditsine kriticheskikh sostoyaniy [Antibiotic therapy in critical care medicine]. Donetsk: Izdatel Zaslavskiy A. Yu. (in Ukrainian).
11. Khizhnyak A.A., Volkova Yu.V. Differentsirovannyy podkhod k antibiotikoterapii v komplekse intensivnoy terapii bolnykh s travmaticheskoy boleznyu (2010) [Differentiated approach to antibiotic therapy in complex intensive therapy in patients with traumatic disease] Ukrainian chemotherapeutic Journal, Vol. 23, no. 1-2, pp.102-106.
12. Аntibiotic resistance threats in the United States. U. S. Department of Health Human Services Centers for Disease Control and Prevention. – 2013, – P.67
13. De-escalation of antimicrobial treatment for adults with sepsis shock (Review) // This is a reprint of a Cochrane review, prepared and maintained by The Cochrane Collaboration and published in The Coch, 2010, Issue 12.
14. De Kraker MEA, Wolkewitz M, Davey PG, Koller W, Berger J, et al. Burden of antimicrobial resistance in European hospitals: excess mortality and length of hospital stay associated with bloodstream infections due to Escherichia coli resistant to third-generation cephalosporins. // J. Antimicrob Chemother 66: 2011, P. 398–407.PMID:21106563 doi: 10.1093/jac/dkq412
15. Díaz-Martín A., Martínez-González M. L., Ferrer R., Ortiz-Leyba C., Piacentini E., Lopez-Pueyo M. J., Martín-Loeches I. Antibiotic prescription patterns in the empiric therapy of severe sepsis: combination of antimicrobials with different mechanisms of action reduces mortality / Díaz-Martín et all. // Critical Care. – 2012. – N. 16:R223 doi:10.1186/cc11869
16. Durmaz S., Kiraz A., Toka Ozer T., Percin D. Macrolide-Lincosamide-Streptogramin B Resistance Phenotypes in Staphylococcus Aureus // Eur J Gen Med 2014; 11(4):217-220 doi: 10.15197/sabad.1.11.75
17. Goff D.A., Dowzicky M.J. Prevalence and regional variation in meticillin-resistant Staphylococcus aureus (MRSA) in the USA and comparative in vitro activity of tigecycline, a glycylcycline antimicrobial // J. Med. Microbiol. 2007; 56 (9): 1189-1195.doi:10.1099/jmm.0.46710-0
18. Enterokokken mit Vancomycin-resistenz in deutschen Krankenhaeusern 2008–2009 // Robert-Koch-Institut. Epid. Bull. – 2010. – Vol. 8, no. 44. – Р.428-36.
19. Katayama Y., Matsuo M., Sasaki T., Morimoto Y., Sekiguchi A., Baba T. Multi-drug-resistant Staphylococcus aureus and future chemotherapy // J. of Infect. and Chemother. V. 20, 2014, – P. 593-601. doi: http://dx.doi.org/10.1016/j.jiac.2014.08.001
20. Marlieke E. A. de Kraker, Peter G. Davey, Hajo Grundmann, on behalf of the BURDEN study group. Mortality and Hospital Stay Associated with Resistant Staphylococcus aureus and Escherichia coli Bacteremia: Estimating the Burden of Antibiotic Resistance in Europe // Journal. pmed. October 11, 2011. doi: 10.1371/journal.pmed.1001104PLoSMed8(10):e1001104.
21. Morel J., Casoetto J., Jospe R. et all. De-escalation as part of a global strategy of empiric antibiotherapy management. A retrospective study in a medico-surgical intensive care unit. / J. Morel, J. Casoetto, R. Jospe et all. // Critical Care. – 2010. N.-14:R225 doi:10.1186/ cc9373.
22. . Sandiumenge A., Lisboa T., Gomez F. et al. Effect of Antibiotic Diversity on Ventilator-Associated Pneumonia Caused by ESKAPE Organisms. 2011. CHEST; 140 (3): 643 -651 doi: 10.1378/chest.11-0462
23. Solomkin J. S., Mazuski J E, Bradley J S. et al. Diagnosis and management of complicated intra-abdominal infection in adults and children: guidelines by the Surgical Infection Society and the Infectious Diseases Society of America // Clin. Infect. Dis. 2010; 50(2):133–164. doi:10.1086/649554
/43.jpg) (1)
(1)
/44-2.jpg)
/44-1.jpg)
/45.jpg)