Газета «Новости медицины и фармации» Кардиология и ревматология (546) 2015 (тематический номер)
Вернуться к номеру
Легочная гипертензия
Авторы: Nazzareno Galiè, Alessandro Manes
Рубрики: Ревматология, Кардиология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 35-58
Легочная гипертензия (ЛГ) — гемодинамическое и патофизиологическое состояние, встречающееся при разнообразных заболеваниях, которые можно разделить на 6 клинических групп со специфическими гистологическими, клиническими чертами и подходами к лечению. Несмотря на сопоставимые цифры давления в легочной артерии (ЛА) у пациентов различных клинических групп, механизмы развития ЛГ, диагностический подход, прогноз и терапия значительно различаются между собой.
К I клинической группе ЛГ относится первичная легочная гипертензия (ПЛГ). Она включает в себя редкие состояния, которые имеют схожую клиническую и гемодинамическую картину и, более того, практически идентичные патологические изменения микроциркуляторного русла легких. К этой группе ЛГ относят идиопатическую и семейную формы, ПЛГ, ассоциированную с системными заболеваниями соединительной ткани, врожденными пороками сердца с системно-легочным шунтированием крови, портальной гипертензией, ВИЧ-инфекцией. Для выявления и характеристики различных групп ЛГ предложен последовательный диагностический алгоритм. В рекомендациях по ведению пациентов представлен алгоритм лечения, созданный на основе доказанной эффективности трех классов лекарственных средств (ЛС) (простаноиды, антагонисты эндотелиновых рецепторов, ингибиторы фосфодиэстеразы 5-го типа) у пациентов с ПЛГ. Также обсуждаются особенности диагностики и лечения каждого типа ПЛГ. При неэффективности медикаментозной терапии показана трансплантация легких.
Ко II группе относят ЛГ, вызванную поражением левых камер сердца. Тактика ведения таких пациентов направлена на лечение основного заболевания. Убедительные данные об эффективности специфической терапии ЛГ при этой патологии отсутствуют.
Клиническая группа III представлена пациентами с ЛГ на фоне патологии дыхательной системы. Применение специфической терапии ПЛГ не рекомендуется, учитывая минимальную клиническую эффективность, а также тот факт, что она может приводить к ухудшению легочного газообмена.
К IV группе отнесена хроническая тромбоэмболическая ЛГ, причиной которой служит хроническая тромбоэмболия легочной артерии (ТЭЛА). Основным методом лечения пациентов этой группы является энд-артерэктомия.
Смешанную патологию и редкие заболевания считают причиной ЛГ у пациентов V клинической группы.
Определение и классификация легочной гипертензии
ЛГ — гемодинамическое и патофизиологическое состояние, при котором среднее давление в ЛА, измеренное во время катетеризации правых камер сердца, > 25 мм рт.ст. в покое [1]. В настоящее время в литературе отсутствуют убедительные данные о возможности установления диагноза ЛГ на основании результатов пробы с физической нагрузкой. По этой причине пределы нормативных значений среднего давления в ЛА при физической нагрузке не приводятся.
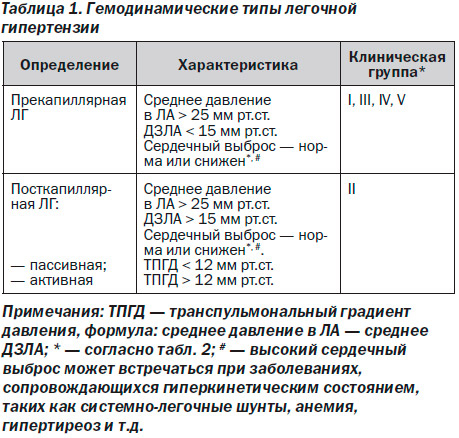
Гемодинамическая классификация ЛГ представлена в табл. 1. Даны различные гемодинамическне определения ЛГ в зависимости от значений давления заклинивания в ЛА (ДЗЛА), общего легочного сосудистого сопротивления (ОЛСС), сердечного выброса. Прекапиллярная ЛГ включает в себя клинические группы I, III, IV и V, в то время как посткапиллярная ЛГ — только клиническую группу II (табл. 2).
Последняя пересмотренная клиническая классификация ЛГ представлена в табл. 2 [2]. Клинические состояния, ассоциированные с ЛГ, разделены на шесть групп в соответствии со схожими патогенетическими, патофизиологическими характеристиками, а также терапевтическими подходами к лечению. Несмотря на схожие цифры давления в ЛА и ОЛСС у пациентов из различных клинических групп, механизмы развития ЛГ, лежащие в основе заболевания, подходы к диагностике и лечению, а также прогноз совершенно различны. Особенности каждой клинической группы рассмотрены в специальных разделах, где особое внимание уделяется клинической группе I (ПЛГ), где ЛГ представляется ведущим патофизиологическим механизмом.
Патофизиология и гистология легочной гипертензии
Различные патофизиологические особенности [3, 4] определяют разнообразие клинических групп ЛГ.
Клиническая группа I (и I′)
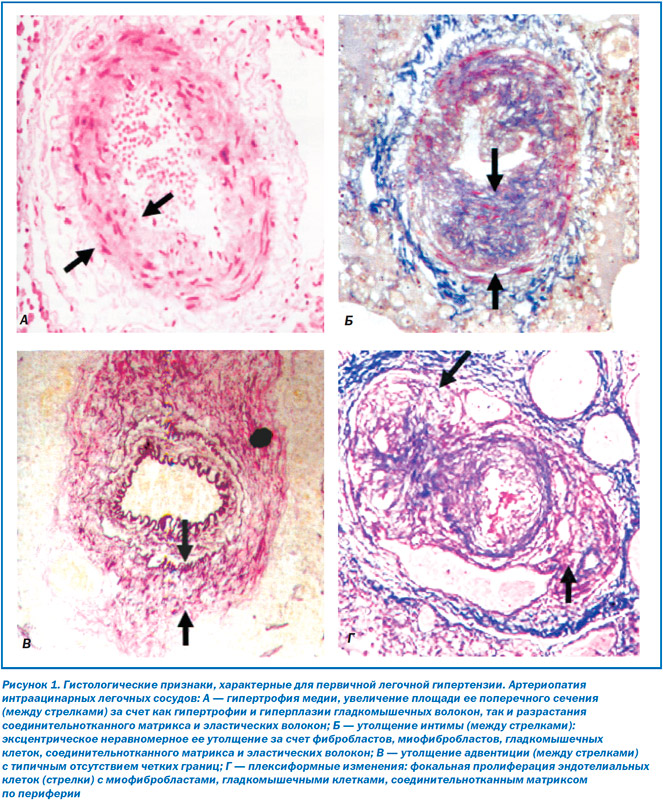
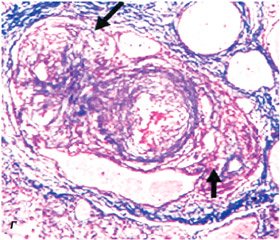
В основе патогенеза лежит поражение преимущественно дистальных мелких сосудов ЛА (< 500 нм) с развитием гипертрофии медиальной оболочки сосуда (рис. 1A), фиброза интимы (концентрического, эксцентрического) (рис. 1Б), утолщения адвентиции (рис. 1В). Образуются умеренные периваскулярные воспалительные инфильтраты, комплексные повреждения (плексиформные изменения (рис. 1Г), дилатация сосудов) и участки тромбозов. Легочные вены, как правило, остаются интактными.
Группа I′ включает главным образом веноокклюзионную болезнь легких с поражением септальных вен и пресептальных венул (постоянно вовлечены) с развитием окллюзионных фиброзных изменений, утолщением мышечной оболочки вен, неравномерной капиллярной пролиферацией, отеком легких, скрытыми альвеолярными геморрагиями, увеличением лимфатических узлов (за счет сосудистой трансформации синусов), а также воспалительными инфильтратами. В дистальных мелких артериях развиваются гипертрофия медии, фиброз интимы, а также редко встречающиеся комплексные повреждения. Точный механизм, запускающий патологические изменения при ПЛГ, пока неизвестен, несмотря на то, что уже есть доказательства многофакторности патофизиологического процесса, включающего вовлечение различных биохимических путей и активации различных типов клеток. Увеличение ОЛСС зависит от таких механизмов, как вазоконстрикция, пролиферативное и обструктивное ремоделирование стенки легочных сосудов, воспаление и тромбоз. Предполагают, что вазоконстрикция является наиболее ранним компонентом в развитии ЛГ.
Чрезмерный вазоспазм связан с нарушением функции или экспрессии калиевых каналов в гладкомышечных клетках, а также с эндотелиальной дисфункцией. У пациентов с ЛГ выявлено снижение в плазме крови уровня вазодилататоров и антипролиферативных субстанций, таких как вазоактивный интестинальный пептид. Эндотелиальная дисфункция приводит к нарушению продукции вазодилататоров и антипролиферативных веществ, таких как оксид азота и простациклин, а также к гиперэкспрессии вазоконстрикторов и пролиферативных веществ, таких как тромбоксан А2 и эндотелин-1. Эти нарушения усиливают сосудистый тонус и способствуют ремоделированию сосудов за счет пролиферативных изменений, в которые вовлекаются эндотелиоциты, гладкомышечные клетки и фибробласты. Кроме того, в адвентиции повышается выработка экстрацеллюлярного матрикса, включая коллаген, эластин, фибронектин, тенасцин. Увеличивается образование ангиопоэтина-1 (ангиогенный фактор), необходимого для развития сосудов легких. Его уровень повышается у пациентов с ЛГ и напрямую коррелирует с тяжестью заболевания.
Клетки воспаления и тромбоциты также играют важную роль в развитии ПЛГ. Фактически клетки воспаления участвуют во всех патологических изменениях при ПЛГ. У пациентов с ЛГ повышен уровень провоспалительных цитокинов в плазме крови. Обнаружено нарушение метаболизма серотонина, который содержится в тромбоцитах и является мощным вазоконстриктором. У пациентов с ЛГ увеличен тромбогенный потенциал крови. Тромбы могут образовываться как в мелких дистальных артериях, так и в проксимальных участках ЛА в сосудах эластического типа.
Клиническая группа II
Патологические изменения у пациентов с ЛГ, обу-словленной поражением левых отделов сердца, характеризуются расширением и утолщением легочных вен, дилатацией легочных капилляров, интерстициальным отеком, частыми альвеолярными геморрагиями, расширением лимфатических сосудов и увеличением лимфатических узлов. В мелких дистальных артериях могут обнаруживаться фиброз интимы, гипертрофия медии. Механизмы, ответственные за увеличение давления в ЛА, сложны и включают пассивную обратную передачу повышенного давления (посткапиллярная пассивная ЛГ; табл. 1). И в этом случае транспульмональный градиент давления (среднее давление в ЛА/среднее ДЗЛА) и ОЛСС имеют нормальные значения. В других условиях давление в ЛА выше ДЗЛА (транспульмональный градиент давления увеличен) и ОЛСС повышено (посткапиллярная активная ЛГ; табл. 1). Повышение ОЛСС происходит за счет увеличения вазомоторного тонуса ЛА и/или фиксированного структурного ремоделирования резистентных сосудов ЛА [5]. Если увеличение ОЛСС в большей степени обусловлено повышением вазомоторного тонуса артерий, то под действием фармакологической пробы ОЛСС и среднее давление в ЛА снижаются. При структурном ремоделировании сосудов с гипертрофией медии и пролиферацией интимы легочных артериол острый вазореактивный тест отрицательный [6]. Пока еще мало известно, какие факторы приводят к активной ЛГ у пациентов с патологией левых камер сердца и почему у одних пациентов развивается обратимая вазоконстрикция, у других — фиксированная обструкция ЛА или то и другое. Патофизиологические механизмы ЛГ могут включать рефлекторную вазоконстрикцию, которая возникает при воздействии на рецепторы растяжения в левом предсердии (ЛП) и легочных венах, нарушение функции эндотелия ЛА, которая сама по себе способствует развитию вазоконстрикции и пролиферации клеток сосудистой стенки.
Клиническая группа III
У пациентов с ЛГ на фоне патологии дыхательной системы гистологические изменения представлены гипертрофией медии и обструктивной артериопатией мелких дистальных легочных артерий. Патофизиологические механизмы разнообразны и включают гипо-ксическую вазоконстрикцию, механическое растяжение при эмфиземе легких, воспаление и токсичное действие сигаретного дыма. Существуют данные, свидетельствующие о наличии дисбаланса вазоконстрикторов, вазодилатации вследствие эндотелиальной дисфункции.
Клиническая группа IV
Для хронической тромбоэмболической ЛГ характерно наличие организованных тромбов в артериях легких эластического типа. Тромботические массы плотно прикреплены к медиальной оболочке артерий и замещают нормальную интиму. Они могут полностью закрывать просвет сосудов или образовывать стенозы различной степени в виде перетяжек и сетей [7]. Важно отметить, что в неокклюзированных участках поражение артерий может быть неотличимым от такового при ЛГ (включая плексиформные изменения) [8]. ТЭЛА или тромбоз in situ при хронической тромбоэмболической ЛГ могут быть инициированы или прогрессировать на фоне коагулопатий, дисфункции эндотелиальных клеток и тромбоцитов, которые также являются участниками тромбообразования [9]. У некоторых пациентов пусковым моментом в развитии заболевания служит патология тромбоцитов, а также особенности прокоагулянтного окружения сосудистой сети легких. Тем не менее в большинстве случаев остается неясным, являются тромбоз и дисфункция тромбоцитов причиной или следствием заболевания. Воспалительная инфильтрация — частая находка в образцах ткани, полученных при эндартерэктомии. Исследования, проведенные у пациентов с ЛГ и ТЭЛА, показали, что волчаночный антикоагулянт обнаруживается приблизительно в 10 % случаев. Имеют антитела к кардиолипину и волчаночному антикоагулянту 20 % пациентов. Недавно было выявлено, что в 39 % случаев у пациентов с хронической тромбоэмболической ЛГ в плазме крови повышено содержание VIII фактора, который accoциирован с первым эпизодом ТЭЛА и рецидивирующей ТЭЛА [10]. Никаких нарушений процесса фибринолиза обнаружено не было. Повреждения в неокклюзированных участках ЛА могут быть связаны со множеством факторов, таких как изменение напряжения сдвига, давление, воспаление, высвобождение цитокинов и сосудистых трофических медиаторов.
Клиническая группа V
Эта группа включает гетерогенные состояния с разнообразными патогенетическими механизмами, этиология которых неясна или носит мультифакториальный характер.
Генетика и эпидемиология
Клиническая группа I
ПЛГ может встречаться при различных клинических состояниях и ассоциированных заболеваниях [11]. Идиопатическая ЛГ (ИЛГ) относится к спорадическим заболеваниям без семейного анамнеза или известных триггерных факторов. Если заболевание носит наследственный характер, то примерно в 70 % случаев обнаруживается мутация гена рецептора типа 2 к протеину костного морфогенеза (BMPR2), которая сцеплена с половыми хромосомами [12]. Мутация гена BMPR2 определяется в 11–40 % спорадических случаев. Таким образом, мутация гена BMPR2 является главным предрасполагающим фактором развития ЛГ [12]. Ген BMPR2 кодирует второй тип рецептора к протеинам костного морфогенеза (BMPs), которые принадлежат к суперсемейству трансформирующих ростовых факторов β. Помимо многих других биологических функций, BMPs принимают участие в контроле пролиферации клеток сосудистой стенки. У пациентов с ЛГ и личным или семейным анамнезом наследственной геморрагической телеангиэктазии (синдром Ослера — Вебера — Рандю) были выявлены мутации генов рецепторов к трансформирующему ростовому фактору β, мутация гена активинподобной киназы-1, эндоглина [13].
Эпидемиология ЛГ была описана в недавно созданных регистрах [14, 15]. Распространенность ЛГ и идиопатической ЛГ составила 15 и 5,9 случая на 1 миллион взрослого населения соответственно. По самым низким предсказательным оценкам распространенность ЛГ составляет 2,4 случая на 1 миллион взрослого населения в год. Согласно данным Шотландского регистра, распространенность ЛГ колеблется в пределах 15–50 человек на 1 миллион населения в странах Европы [14]. Во Французском регистре легочной гипертензии идиопатическая легочная гипертензия встречалась у 39,2 % пациентов, а наследственная ЛГ — в 3,9 % случаев. В подгруппе ПЛГ, ассоциированной с заболеваниями/состояниями, 15,3 % пациентов страдали системными заболеваниями соединительной ткани (преимущественно склеродермией), 11,3 % — врожденными пороками сердца, 10,4 % — портальной гипертензией, у 9,5 % больных ЛГ была связана с приемом анорексигенных препаратов, и у 6,2 % пациентов ЛГ была ассоциирована с ВИЧ-инфекцией.
Клиническая группа II
Даже если бы конституциональные факторы могли играть роль в развитии ЛГ, никакие специфические генетические взаимосвязи обнаружены не были. Распространенность ЛГ среди пациентов с хронической сердечной недостаточностью (ХСН) возрастает с увеличением функционального класса ХСН. ЛГ может встречаться у 60 % пациентов с тяжелой систолической дисфункцией ЛЖ и у 70 % пациентов с изолированной диастолической дисфункцией ЛЖ [16].
Клиническая группа III
В этой группе не было обнаружено генетических детерминант развития ЛГ. Опираясь на данные литературы, частота выявления тяжелой ЛГ у пациентов с ХОБЛ и хотя бы одной госпитализацией по поводу декомпенсации дыхательной недостаточности в анамнезе составила около 20 %. ЛГ считают частым осложнением тяжелой ХОБЛ (> 50 % случаев) [17], однако в большинстве случаев обнаруживается ЛГ легкой степени. При интерстициальном легочном фиброзе заболеваемость ЛГ варьирует в пределах 32–39 % [18].
Клиническая группа IV
Связи между хронической тромбоэмболической ЛГ и специфическими генетическими мутациями не выявлено. В последних исследованиях обнаружено, что у 5 % пациентов, выживших после острой ТЭЛА, в дальнейшем развивается хроническая тромбоэмболическая ЛГ [19]. Тем не менее большинство экспертов полагают, что истинная распространенность хронической тромбоэмболической ЛГ после острого эпизода ТЭЛА составляет 0,5–2 %. Более того, хроническая тромбоэмболическая ЛГ может встречаться у пациентов без предшествующего острого эпизода ТЭЛА или тромбоза глубоких вен (до 50 %, по различным данным).
Первичная легочная гипертензия (группа I)
Клиническая группа I включает в себя гетерогенные патологические состояния, которые имеют сходные клинические и гемодинамические черты и практически идентичные патоморфологические изменения микроциркуляторного русла легких [3]. К группе I относят идиопатическую ЛГ (ранее называвшуюся первичной ЛГ), наследственную ЛГ [20] и ПЛГ, ассоциированную с различными состояниями, такими как системные заболевания соединительной ткани, врожденные пороки сердца с системно-легочными шунтами, портальной гипертензией, ВИЧ-инфекцией, приемом лекарств и токсинов. Несмотря на открытие многочисленных патофизиологических механизмов на тканевом и клеточном уровнях у пациентов с ПЛГ, точные взаимоотношения начала и прогрессирования патологического процесса до конца не определены. Длительное увеличение ОЛСС ведет к перегрузке правого желудочка (ПЖ), его гипертрофии и дилатации и, в конечном счете, к недостаточности ПЖ и смерти. Прогрессирование недостаточности ПЖ определяет течение и исход ИЛГ, о чем свидетельствует прогностическое значение трех наиболее важных показателей насосной функции ПЖ, таких как давление в правом предсердии (ПП), сердечный индекс и среднее давление в ЛА [21]. Снижение сократительной способности, вероятно, является одним из первичных событий в прогрессировании ХСН при хронической перегрузке ПЖ. У пациентов с ИЛГ было обнаружено изменение адренергического ответа миоцитов ПЖ, что вело к снижению сократительной способности [22]. Тем не менее чрезмерная постнагрузка остается основной причиной ХСН у больных с ИЛГ и хронической тромбоэмболической ЛГ, поскольку успешное удаление препятствия при тромбэндартерэктомии или трансплантации легких [23] неизменно приводит к устойчивому восстановлению функции ПЖ. Таким образом, гемодинамические изменения и прогноз у пациентов с ЛГ обусловлены комплексом патофизиологических взаимодействий скорости прогрессирования (или регрессирования) обструктивных изменений артерий малого круга кровообращения с реакцией перегруженного ПЖ, которая, в свою очередь, может быть генетически детерминирована [24].
Диагностический алгоритм
Диагностический алгоритм ЛГ включает в себя серию исследований, направленных на подтверждение диагноза, определение клинической группы ЛГ, оценку функционального состояния и гемодинамических нарушений. После отдельного описания каждого из исследований будет представлен интегрированный диагностический алгоритм.
Клиническая картина
Пациентов с ЛГ беспокоят одышка, слабость, усталость, боли в грудной клетке, обмороки, увеличение объема живота за счет задержки жидкости [25]. Появление симптомов в покое отмечается только у тяжелых больных. При физикальном обследовании пациента с ЛГ можно обнаружить подъем левой парастернальной границы, акцент II тона за счет пульмонального компонента, пансистолический шум трикуспидальной регургитации, диастолический шум недостаточности пульмонального клапана и III тон ПЖ [25]. Набухание яремных вен, гепатомегалия, периферические отеки, асцит, холодные конечности можно обнаружить у пациента с крайне запущенной ПЛГ. Аускультативная картина в легких обычно не изменена.
Электрокардиография (ЭКГ)
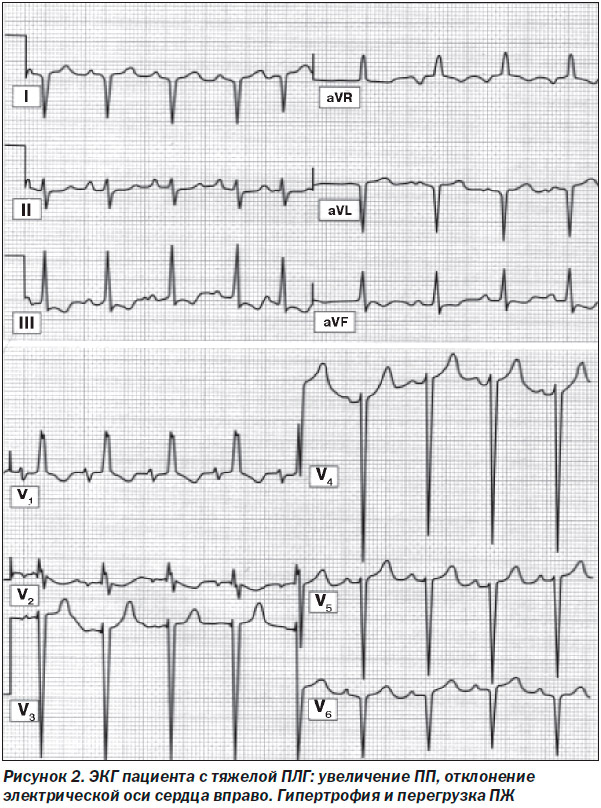
Наличие ЭКГ-признаков гипертрофии и перегрузки ПЖ, дилатации ПП могут навести на предположение о ЛГ или стать дополнительными признаками, подтверждающими диагноз (рис. 2). ЭКГ-признаки гипертрофии ПЖ присутствуют у 87 % пациентов, а отклонение электрической оси сердца (ЭОС) вправо — у 79 % больных с ИЛГ [25]. Однако ЭКГ-метод не обладает высокой чувствительностью (55 %) и специфичностью (70 %) и поэтому не может быть использован в качестве скринингового метода в диагностике ЛГ. В далеко зашедших стадиях ЛГ появляются наджелудочковые нарушения ритма. Так, например, возникновение трепетания предсердий ассоциировано с последующим ухудшением состояния больного.
Рентгенография грудной клетки
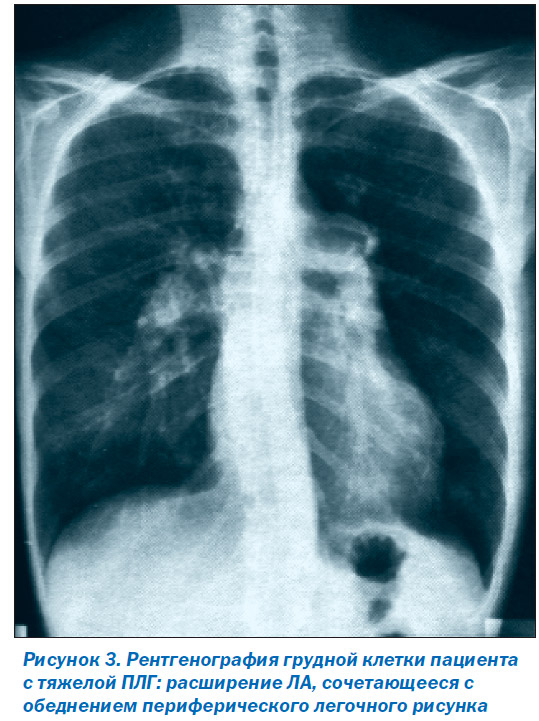
У 90 % пациентов с ИЛГ на момент установления диагноза на рентгенограмме грудной клетки отмечается расширение ЛА, сочетающееся с обеднением периферического легочного рисунка [25] (рис. 3). Увеличение ПП и ПЖ выявляют в случаях тяжелой ЛГ. Кроме того, с помощью рентгенологического исследования можно исключить тяжелые заболевания легких или легочную венозную гипертензию, обусловленную патологией левых камер сердца.
Спирография и определение газового состава артериальной крови
Исследование функции легких и определение газового состава артериальной крови позволяют диагностировать патологию паренхимы легких или воздухоносных путей.
Для пациентов с ЛГ характерно снижение диффузионной способности легких для монооксида углерода (DLCO; обычно в пределах 40–80 % от должного) и легкое или умеренное уменьшение объемных показателей. РаО2 находится в пределах нормы или слегка ниже нормальных значений, а РаСО2 уменьшено в результате альвеолярной гипервентиляции. Хроническая обструктивная болезнь легких как причина гипоксической ЛГ диагностируется на основании наличия необратимой обструкции в сочетании с увеличенными остаточными объемами легких, снижением DLСО и нормальным или повышенным значением РаСО2. Снижение объема легких в сочетании с уменьшением DLСО может быть признаком интерстициального заболевания легких. Тяжесть эмфиземы легких и интерстициального поражения легких можно определить с помощью компьютерной томографии (КТ) высокого разрешения. При наличии клинических симптомов, подозрительных на обструктнвное апноэ/гипопноэ, следует провести полисомнографическое исследование с ночной оксиметрией.
Эхокардиография
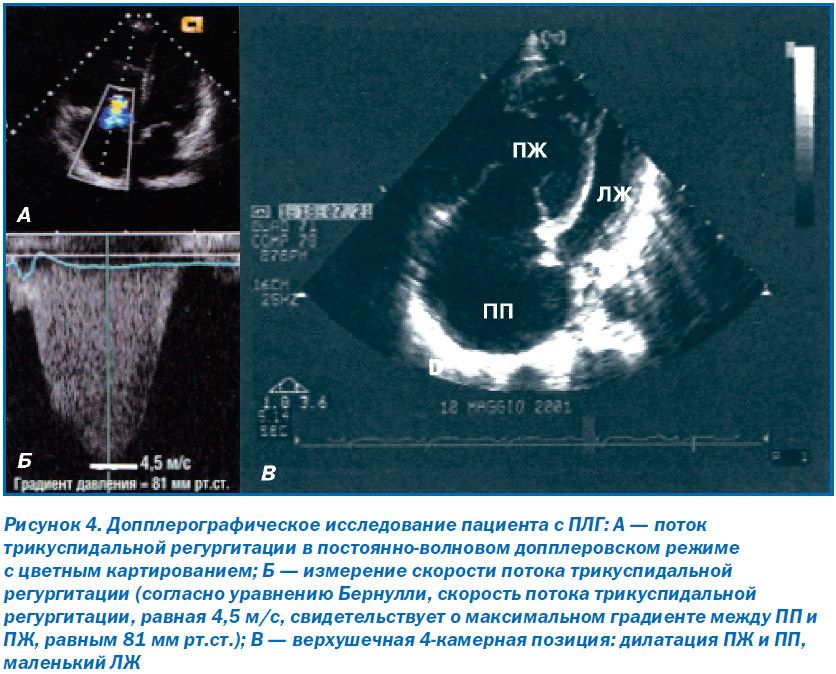
Трансторакальную эхокардиографию (ЭхоКГ) считают отличным скрининговым методом диагностики ЛГ. С ее помощью можно определить систолическое давление в ЛА, а также обнаружить причины, вызвавшие ЛГ. Систолическое давление в ЛА эквивалентно систолическому давлению в ПЖ при отсутствии обструкции ЛА. Систолическое давление в ПЖ вычисляется путем сложения скорости трикуспидальной регургитации в систолу и предполагаемого давления в ПП (рис. 4). Трикуспидальную регургитацию можно определить у 74 % пациентов с ЛГ [26]. Принимая во внимания данные, полученные при обследовании здоровых людей [27], ЛГ возможно предполагать при систолическом давлении в ЛА, равном 37–50 мм рт.ст., или скорости трикуспидальной регургитации в покое 2,8–3,4 м/с (подразумевая, что давление в правом предсердии в пределах нормы — 5 мм рт.ст.).
Следует отметить, что при таком определении ЛГ можно ожидать довольно большого числа ложноположительных диагнозов ЛГ, особенно у пациентов старшего возраста или с ожирением. ЛГ вероятна, если скорость трикуспидальной регургитации более 3,4 м/с. Однако для подтверждения наличия ЛГ и ее типа необходимо проведение катетеризации правых камер сердца и манометрии, особенно у больных с клиническими проявлениями ХСН II–IV функционального класса (ФК) по классификации Всемирной организации здравоохранения/Нью-Йоркской ассоциации кардиологов (ВОЗ/NYHA), и перед назначением специфической терапии ПЛГ. При отсутствии симптомов у пациента с –ограничением физических нагрузок на уровне I ФК по ВОЗ/NYHA и возможной ЛГ согласно данным ЭхоКГ прежде всего необходимо исключить системное заболевание соединительной ткани и через 6 мес. повторить ЭхоКГ. У пациентов с высокой вероятностью ЛГ необходимо помнить о возможных ложноотрицательных результатах ЭхоКГ [28].
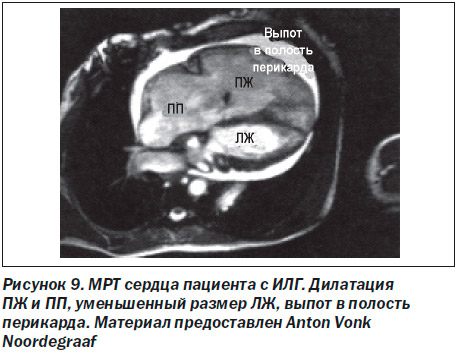
Методика ЭхоКГ с физической нагрузкой для выявления скрытой ЛГ используется сугубо в научно-исследовательских целях и поэтому не должна применяться в рутинной практике. Для подтверждения диагноза ЛГ и оценки степени ее тяжести необходимо учитывать такие дополнительные ЭхоКГ-параметры, как размеры и функция ПЖ, размеры ЛЖ (часто уменьшены) (рис. 4В), наличие или отсутствие клапанной патологии сердца, фракция выброса (ФВ) ПЖ, характеристики наполнения ЛЖ, размеры нижней полой вены, объем выпота в полость перикарда [29, 30] и систолическая скорость движения кольца трикуспидального клапана [31]. Кроме того, трансторакальная ЭхоКГ позволяет провести дифференциальную диагностику причин, вызвавших ЛГ. С помощью ЭхоКГ можно выявить патологию клапанного аппарата и миокарда левых камер сердца, которые чаще всего являются причиной легочной венозной гипертензии (клиническая группа II). Врожденные пороки сердца с системно-легочным шунтированием крови также могут быть легко обнаружены (клиническая группа 1.4.4). Введение физиологического раствора хлорида натрия внутривенно (в/в) в качестве контрастного средства позволяет обнаружить открытое овальное окно или венозный синус — вариант дефекта межпредсердной перегородки (ДМПП), который можно легко не заметить при проведении стандартной ЭхоКГ. Чреспищеводная ЭхоКГ требуется крайне редко и в основном с целью подтверждения наличия ДМПП и оценки его размера.
Вентиляционно-перфузионная сцинтиграфия легких
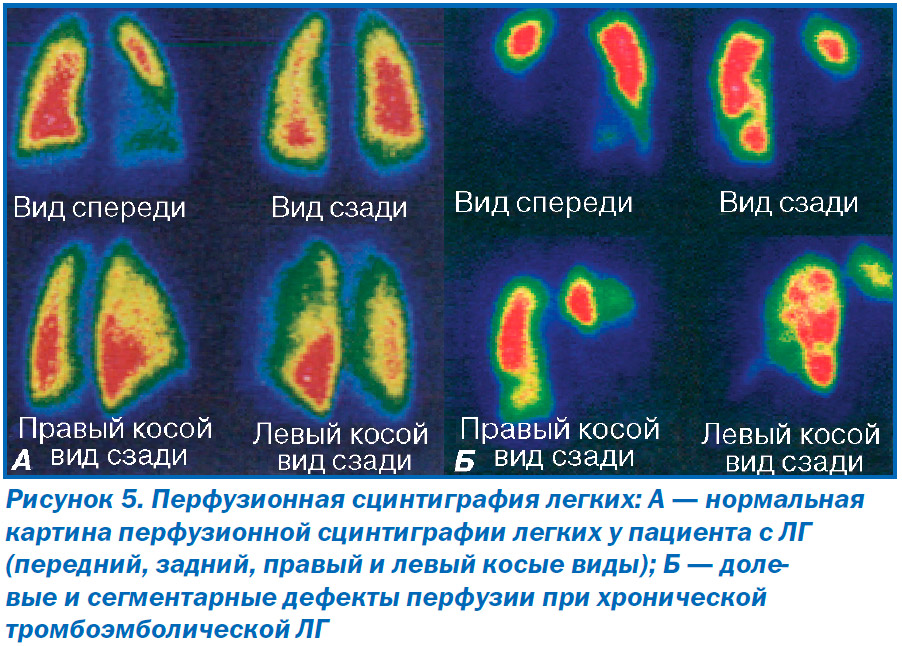
Вентиляционно-перфузионная сцинтиграмма легких у пациентов с ЛГ чаще всего не изменена (рис. 5А). Однако у части пациентов с ЛГ можно обнаружить мелкие периферические субсегментарные дефекты перфузии, которые при этом нормально вентилируются. Таким образом, эти дефекты представляют собой участки несоответствия перфузии и вентиляции. Такие же дефекты определяются и у пациентов с веноокклюзионной болезнью легких. Вентиляционно-перфузионная сцинтиграфия легких является методом диагностики хронической тромбоэмболической ЛГ (клиническая группа IV), для которой характерны долевые или сегментарные дефекты перфузии (рис. 5Б). Для пациентов с паренхиматозными заболеваниями легких характерно соответствие перфузионных дефектов вентиляционным.
Компьютерная томография (высокого разрешения и спиральная с контрастированием), ангиопульмоно-графия
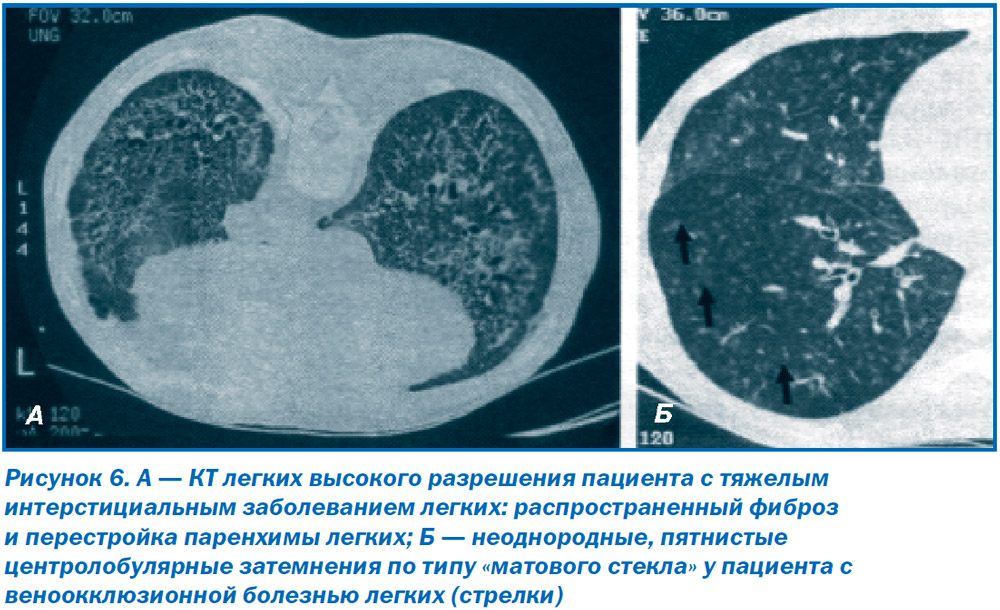
КТ высокого разрешения позволяет получить изображение паренхимы легких высокого качества и, соответственно, диагностировать интерстициальный легочный фиброз (рис. 6А) и эмфизему легких. КТ высокого разрешения можно рекомендовать в случае усиленного интерстициального компонента на рентгенограмме легких при отсутствии недостаточности ЛЖ. В этом случае выявление диффузных затемнений по типу «матового стекла» в прикорневых участках легких, утолщение междолевых перегородок позволяет заподозрить веноокклюзионную болезнь легких (рис. 6Б). Дополнительными находками могут быть лимфаденопатия, плевральные наслоения и выпоты [32].
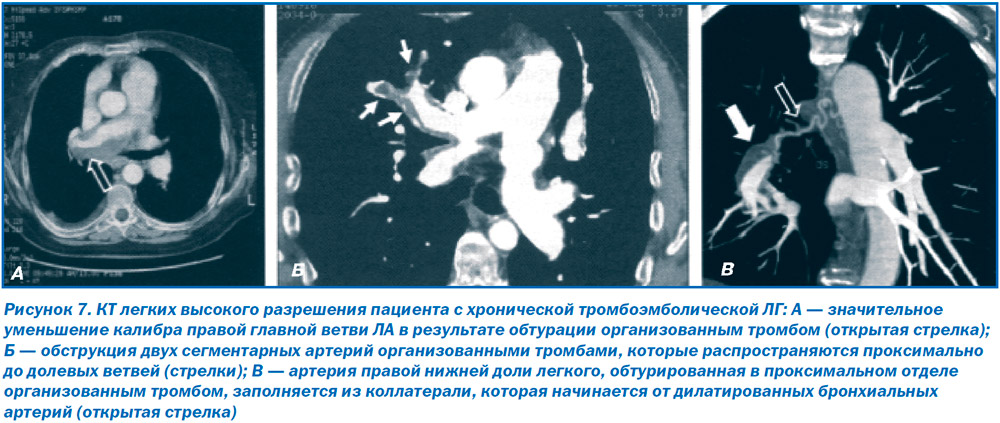
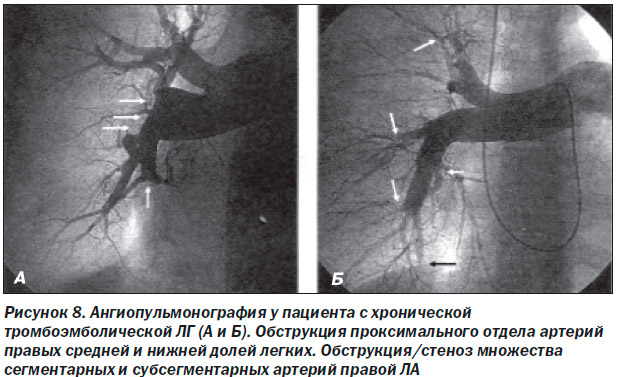
В случае наличия дефектов перфузии, выявляемых при вентиляционно-перфузионной сцинитиграфии легких, и нормальном вентиляционном компоненте у пациентов с ЛГ показано проведение спиральной КТ легких с контрастным усилением, с помощью которого можно обнаружить признаки хронической тромбоэмболии проксимальных участков ЛА. КТ-признаки xpoнической тромбоэмболической ЛГ включают в себя полную обструкцию ЛА, эксцентрические дефекты наполнения с организованными тромбами, реканализацией, сужением и сетчатыми структурами [33] (рис. 7). Кроме того, спиральная КТ легких с контрастным усилением позволяет визуализировать коллатерали между бронхиальными артериями и артериями системного кровотока (рис. 7В). Ангиопульмонография по-прежнему остается незаменимым методом для выявления наиболее перспективных для проведения тромбэндартерэктомии пациентов с хронической тромбоэмболической ЛГ (рис. 8А). С помощью ангиопульмонографии можно с большей точностью оценить изменения в дистальном русле ЛА (рис. 8Б). Ангиопульмонография показана в случае сомнительных результатов спиральной КТ легких с контрастным усилением, перфузионной сцинтиграфии легких у пациентов с подозрением на хроническую тромбоэмболическую ЛГ.
Магнитно-резонансная томография
Магнитно-резонансная томография (МРТ) сердца (рис. 9) позволяет существенно оценить размеры, морфологию, массу миокарда и функцию ПЖ, а также неинвазивным способом кровоток, включая ударный объем (УО), сердечный выброс, растяжимость ЛА [34]. Данные, полученные с помощью МРТ, имеют высокую корреляцию с результатами катетеризации правых камер сердца, что позволяет использовать МРТ в качестве суррогатного метода, оценивающего гемодинамику малого круга кровообращения. Сниженный УО, увеличенный конечно-диастолический объем (КДО) ПЖ и уменьшенный КДО ЛЖ при первичной оценке пациента ассоциированы с неблагоприятным прогнозом. Среди многочисленных предикторов прогрессирования недостаточности ПЖ увеличение КДО ПЖ, вероятно, является наиболее простым и адекватным маркером [35].
Исследования крови и иммунология
Стандартный биохимический анализ крови, клинический анализ крови, определение функции щитовидной железы следует проводить у всех пациентов с ЛГ. Системные заболевания соединительной ткани диагностируются на основании клинических и лабораторных критериев. В качестве скрининговых исследований рекомендуется определение антинуклеарных антител, включая антицентромерные антитела, анти-SCL70 и анти-РНК. Антинуклеарные антитела в низком титре (< 1 : 80) обнаруживаются приблизительно у трети пациентов с ИЛГ. Пациенты с пограничным повышением титра антинуклеарных антител и/или клиническими симптомами, подозрительными на системное заболевание соединительной ткани, нуждаются в дальнейшем серологическом обследовании и консультации ревматолога. Наконец, необходимо получить согласие у всех пациентов на серологическое исследование крови на ВИЧ-инфекцию.
Ультразвуковое исследование органов брюшной полости
Ультразвуковое исследование (УЗИ) органов брюшной полости позволяет исключить цирроз печени и/или портальную гипертензию. Применение контрастных средств расширяет диагностические возможности метода. Кроме того, диагноз портальной гипертензии может быть подтвержден во время проведения катетеризации правых камер сердца путем определения повышенного градиента между свободным давлением и давлением заклинивания печеночной вены [36].
Толерантность к физической нагрузке
Объективное исследование толерантности к физической нагрузке является важным инструментом в оценке тяжести заболевания и эффективности терапии. Наиболее распространен тест 6-минутной ходьбы (в норме здоровый человек среднего возраста проходит дистанцию свыше 500 м за 6 мин), а также кардиопульмональный тест с определением газообмена [37].
Катетеризация правых камер сердца и вазореактивный тест
Катетеризация правых камер сердца необходима для подтверждения диагноза ПЛГ, оценки тяжести гемодинамических нарушений и вазореактивности артериального русла малого круга кровообращения. О ЛГ можно говорить при определении среднего давления в ЛА > 25 мм рт.ст. в покое, ДЗЛА < 15 мм рт.ст. (прекапиллярная ЛГ) (табл. 1). В редких случаях требуется катетеризация левых камер сердца при невозможности определения ДЗЛА или получении достоверного ДЗЛА. Определение ДЗЛА позволяет различить артериальную и венозную ЛГ у пациентов с сопутствующей патологией левых камер cepдца. Катетеризация правых камер сердца особенно важна для разграничения пациентов со средней и тяжелой степенью тяжести ЛГ, поскольку гемодинамические характеристики имеют прогностическое значение [21]. Повышение среднего давления в ПП и в ЛА в сочетании со снижением сердечного выброса и насыщением центральной венозной крови кислородом наблюдается у пациентов с наихудшим прогнозом. Острый вазореактивный тест проводится во время катетеризации правых камер cepдца [38]. Он позволяет выявить пациентов, у которых может быть эффективна долго-срочная терапия блокаторами медленных кальциевых каналов. Острый вазореактивный тест должен проводиться при первичном обследовании пациента только в центрах, имеющих опыт его проведения, и с короткодействующими вазодилататорами сосудов ЛА с целью минимизации риска осложнений процедуры. В настоящее время наиболее используемым пpeпаратом является оксид азота [38]. Основываясь на предшествующем опыте [39–41], можно применять в/в эпопростенол, а также аденозин в/в. Вазореактивный тест считают положительным (пациент — респондер) при снижении среднего давления в ЛА > 10 мм рт.ст. с достижением абсолютного значения среднего давления в ЛА < 40 мм рт.ст. и увеличения сердечного выброса или отсутствия изменений сердечного выброса. В целом только у 10 % пациентов с ИЛГ вазореактивный тест соответствует этим критериям [39, 42].
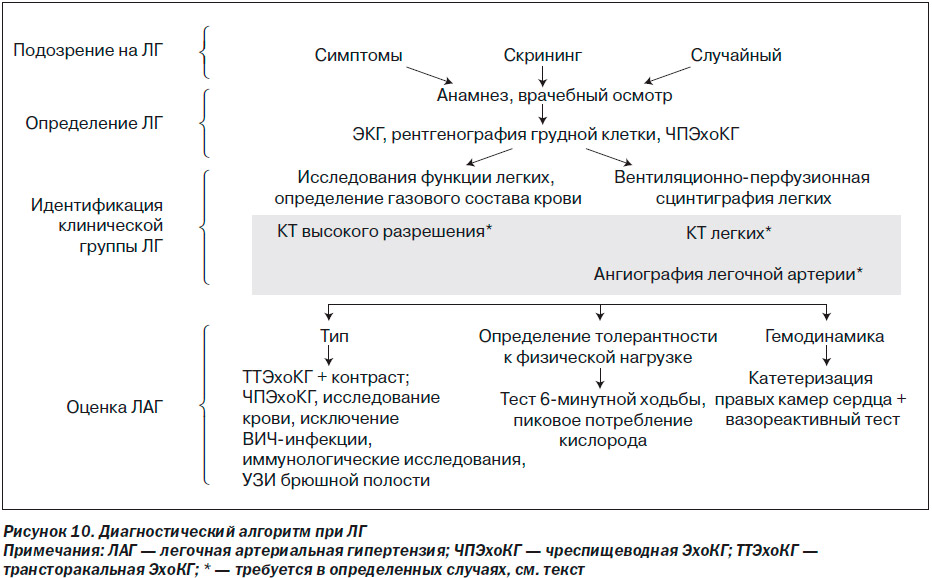
Диагностический алгоритм
Диагностический алгоритм ЛГ включает в себя самые разнообразные исследования (рис. 10). Алгоритм для удобства можно разделить на 4 фазы.
— Подозрение: ЛГ можно предполагать при наличии одышки у пациента при отсутствии очевидных признаков, специфичных для заболевания сердца или легких, а также при обследовании больных с состояниями, которые обычно ассоциируются с ЛГ, или при случайных находках в обследовании, которые характерны для ЛГ.
— Определение: обнаружение ЛГ требует использования исследований, которые способны подтвердить этот диагноз, то есть физикальный осмотр, ЭКГ, рентгенография грудной клетки, трансторакальная ЭхоКГ.
— Групповая идентификация: следующим шагом является определение клинической группы (табл. 1) [2]. Для этого требуются более специфические тесты, такие как определение функции легких, газовый состав артериальной крови, вентиляционно-перфузионная сцинтиграфия легких. В определенных случаях необходимо проведение КТ грудной клетки высокого разрешения, спиральной КТ легких с контрастным усилением и ангиопульмонографии.
— Оценка: после установления диагноза ЛГ (клиническая группа I) требуются дополнительные исследования с целью более точной идентификации типа ПЛГ, толерантности к физической нагрузке и гемодинамики.
Оценка тяжести легочной гипертензии
В табл. 3 представлены параметры, которые имеют прогностическое значение у пациентов с ИЛГ и оцениваются при первоначальном обследовании пациента и в последующем на фоне терапии. Крайне мало информации относительно прогностических факторов при ЛГ на фоне ассоциированных состояний (системных заболеваний соединительной ткани, врожденных пороков сердца с системно-легочным шунтированием, ВИЧ-инфекции и портальной гипертензии). В этих случаях какие-либо другие дополнительные факторы могут влиять на прогноз. В действительности пациенты с ЛГ на фоне системного заболевания соединительной ткани имеют худший прогноз по сравнению с больными с ИЛГ, тогда как скоростъ прогрессирования ЛГ при врожденных пороках сердца с системно-легочным шунтированием значительно медленнее, нежели у пациентов с ИЛГ. В клинической практике прогностическое значение одного параметра у конкретного пациента может быть менее значимым, нежели значение совокупности других показателей.
Сравнительная оценка прогноза
При регулярном обследовании пациента с ЛГ необходимо особенно тщательно оценивать показатели, имеющие прогностическую значимость (табл. 3). Решение о терапии или ее изменении должно основываться на симптомах, переносимости физической загрузки, а также на прогностических показателях. Однако далеко не все показатели, регулярно исследуемые у пациента с ПЛГ, в равной степени позволяют оценить тяжесть заболевания. Например, такой показатель, как давление в ЛА, которое неоднократно определяется с помощью манометрии во время катетеризации правых камер сердца или ЭхоКГ. Величина давления в ЛА плохо коррелирует с симптомами и исходом заболевания, поскольку имеет значение не только степень облитерации артерий легких, но и сократительная способность ПЖ. Далеко не все параметры, представленные в табл. 3, следует определять во время каждого визита пациента, но для того чтобы иметь ясную картину, важно оценивать спектр данных, полученных при физикальном, лабораторном исследованиях, во время проведения нагрузочных тестов, исследования гемодинамики. В принятии решения в отношении тактики ведения больного не следует полагаться на какой-либо один параметр, поскольку при повторных исследованиях результат может быть противоположным.
Определение клинического статуса
На основании данных физикального обследования, неинвазивных и инвазивных методов исследования оценивают состояние пациента [51].
— Стабильное и удовлетворительное:
— отсутствие клинических признаков недостаточности ПЖ;
— стабильный I или II ФК по ВОЗ/NYHA без обмороков;
— дистанция прохождения в тесте 6-минутной ходьбы > 500 м [3, 4], индивидуально для пациента;
— пиковое потребление кислорода > 15 мл/мин/кг [92];
— уровень BNP/NT-proBNP (мозговой натрийуретический пептид/N-терминальный конец мозгового натрийуретического пропептида) в плазме крови в пределах нормы или близок к нормальному значению [6, 7];
— отсутствие выпота в полости перикарда; систолическая экскурсия кольца трикуспидального клапана > 2,0 см;
— давление в ПП < 8 мм рт.ст.;
— сердечный индекс > 2,5 л/мин/м2.
— Стабильное и неудовлетворительное. Пациент находится в стабильном состоянии, однако он не достиг желаемого или целевого состояния. Некоторые параметры, описанные ранее в разделе «удовлетворительное состояние», не достигнуты. В этом случае следует повторно обследовать больного и решить вопрос об усилении терапии или изменении лечения с последующим развернутым обследованием в референтном по ЛГ центре.
— Нестабильное и ухудшающееся. У пациента признаки недостаточности ПЖ: жалобы и симптомы нарастают; увеличение функционального класса по ВОЗ/NYHA, то есть с II до III или с III до IV; дистанция прохождения в тесте 6-минутной ходьбы < 300 м; увеличение уровня BNP/NT-proBNP в плазме крови; наличие выпота в полости перикарда; систолическая экскурсия кольца трикуспидального клапана > 2,0 см, систолическая экскурсия кольца трикуспидального клапана < 1,5 см; давление в ПП > 15 мм рт.ст.; сердечный индекс < 2 л/мин/м2; нарастание отеков и/или необходимость усиления диуретической терапии: появление ангинозного синдрома или увеличение частоты/тяжести болевых эпизодов, которые могут быть признаком ухудшения функции ПЖ; появление или увеличение частоты обмороков — проявлений низкого сердечного выброса и предвестников неблагоприятного исхода, поэтому требующих скорейшей интенсификации терапии.
Цели терапии и стратегия наблюдения
Цели терапии у пациентов с ЛГ могут быть определены, как они перечислены в определении «стабильное и удовлетворительное». Однако достижение целевого уровня параметров и целей терапии должно быть подобрано индивидуально, сообразно возрасту и сопутствующей патологии. Например, достижение дистанции прохождения в тесте 6-минутной ходьбы > 400 м обычно можно считать приемлемым у пациентов среднего возраста.
После полноценного первичного обследования пациента с ЛГ рекомендуется повторное обследование каждые 3 мес., включая общеклиническое обследование с использованием неинвазнвных методов исследования.
Не существует единого мнения и рекомендаций о том, когда и как часто проводить катетеризацию правых камер сердца. Тем не менее эта процедура показана для подтверждения диагноза ПЛГ, при назначении специфической терапии ПЛГ, в случае ухудшения состояния больного, а также для оценки эффекта начала специфической ПЛГ-терапии, при усилении специфической терапии и/или комбинированного медикаментозного лечения.
Лечение
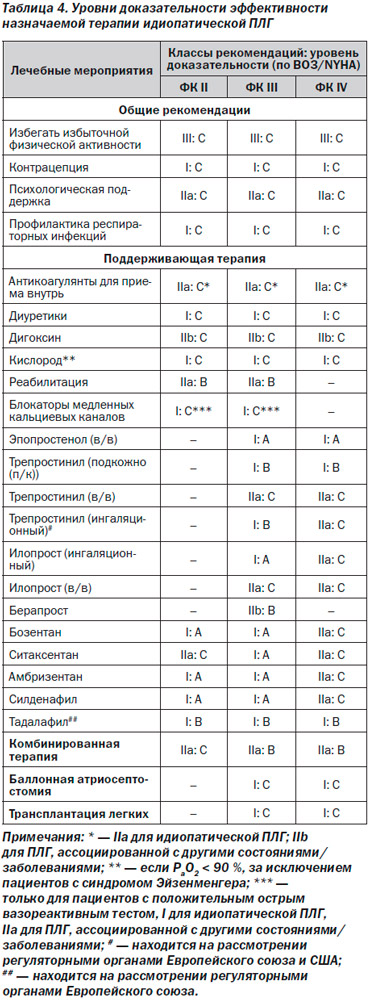
Медикаментозное лечение ЛГ будет подробно освещено в дальнейшем, и уровни доказательности и рекомендаций [52] будут приведены отдельно для каждого препарата и вида лечения (табл. 4): алгоритм лечения представлен на рис. 11 [51].
Общие рекомендации
— Физическая активность. Следует избегать избыточной физической активности, которая ведет к перегрузке и стрессу. Тем не менее нетренированные пациенты должны заниматься физическими нагрузками индивидуально под наблюдением специалиста по лечебной физкультуре.
— Беременность и контрацепция. Беременность ассоциирована с 30–50% летальностью у больных с ПЛГ, соответственно, диагноз ЛГ служит противопоказанием к беременности. Барьерные контрацептивные методы имеют надежный, но непредсказуемый эффект. Оральные контрацептивы, содержащие прогестерон, такие как медроксипрогестерона ацетат и этоногестрел, эффективны и не обладают неблагоприятными свойствами эстрогенов. В случае наступившей беременности пациентка должна быть предупреждена о высоком риске неблагоприятного исхода, следует обсудить вопрос о прерывании беременности. Пациентки, согласившиеся на прерывание беременности, должны быть направлены в специализированный центр с возможностью оказания всесторонней помощи.
— Авиаперелеты. Пациенты III и IV ФК по ВОЗ/NYHA с РаО2 менее 92 % должны быть обеспечены кислородной поддержкой во время авиаперелета.
— Психологическая и социальная поддержка. У многих пациентов с ЛГ развиваются тревога и депрессия, что ухудшает качество жизни. Следует своевременно направлять пациента на консультацию психолога или психиатра.
— Профилактика инфекционных заболеваний. Пациенты с ЛГ предрасположены к развитию пневмонии, которая служит причиной смерти в 7 % случаев. Поскольку до сих пор клинические исследования не проводились, то разумно рекомендовать вакцинирование против вируса гриппа и Streptococcus pneumoniae.
— Плановые хирургические вмешательства. Достаточно рискованны у пациентов с ПЛГ. До конца не-ясно, какой вид анестезиологического пособия наиболее предпочтителен у пациентов с ПЛГ. Тем не менее эпидуральная анестезия переносится пациентами лучше по сравнению с общей.
— Сопутствующая терапия. Существует вероятность возникновения клинически значимых лекарственных взаимодействий у пациентов с ПЛГ. Так, например, кетоконазол и циклоспорин увеличивают концентрацию бозентана и сетаксентана, поэтому совместный прием этих препаратов противопоказан. Одновременный прием бозентана и глибурида также противопоказан. Назначение ситаксентана пациенту, принимающему варфарин, требует снижения дозы последнего на 80 %. Совместное применение силденафила и эритромицина, кетоконазола, циметидина, ингибиторов протеазы ВИЧ (ритоновир, саквиновир) ведет к повышению концентрации силденафила. Нитраты противопоказаны пациентам, получающим ингибиторы фосфоди-эстеразы 5-го типа. Особое внимание следует уделять в случае необходимости совместного назначения ПЛГ-специфической терапии и антигипертензивных препаратов, таких как β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента (иАПФ), поскольку их совместный прием может вызвать выраженную гипотензивную реакцию.
Поддерживающая терапия
— Антикоагулянты для приема внутрь. Доказательства целесообразности приема антикоагулянтов у пациентов с ИЛГ, ПЛГ, ассоциированной с приемом анорексигенных препаратов, основаны на ретроспективном анализе исследований, проведенных в отдельных центрах [41, 53]. Целевое значение международного нормализованного отношения (МНО) у пациентов с ИЛГ варьирует от 1,5–2,5 в большинстве центров Северной Америки и 2,0–3,0 в европейских центрах. Доказательства в пользу антикоагулянтной терапии у пациентов с ИЛГ могут быть экстраполированы и на других пациентов с ЛГ сообразно соотношению риска осложнений терапии антикоагулянтами для приема внутрь к возможной пользе. Следует особенно аккуратно принимать решение о терапии антикоагулянтами для приема внутрь у пациентов с портопульмональной ЛГ и системным заболеванием соединительной ткани, принимая во внимание риск развития кровотечений.
— Диуретики. У пациентов с декомпенсированной правожелудочковой ХСН задерживается жидкость, что ведет к повышению центрального венозного давления, застойным явлениям в органах брюшной полости, периферическим отекам и, в запущенных случаях, к асциту. Адекватная диуретическая терапия позволяет достичь клинического улучшения. В случаях сниженного всасывания в тонком кишечнике могут потребоваться более высокие дозы диуретиков.
— Кислород. В настоящее время отсутствуют убедительные данные об эффекте долгосрочного применения кислорода у пациентов с ПЛГ. У некоторых больных использование кислорода с небольшим объемом потока может иметь положительный эффект, однако это не было подтверждено ни одним клиническим исследованием. Тем не менее считается важным поддерживать РаО2 > 92 %.
— Препараты наперстянки или добутамин. Краткосрочное в/в назначение дигоксина пациентам с ИЛГ ведет к незначительному увеличению сердечного выброса и значительному снижению уровня циркулирующего в крови норадреналина [54], однако данных об эффекте длительного применения дигоксина нет. Пациенты, находящиеся в терминальной стадии ПЛГ, получают терапию добутамином (в/в) в центрах, имеющих опыт ведения таких больных [55].
— Реабилитация. Появляется все больше свидетельств о том, что у пациентов с поздней фазой заболевания уменьшается периферическая мышечная масса. Эту проблему можно решить, вовлекая пациента в реабилитационные программы [56].
Блокаторы медленных кальциевых каналов
Благоприятный клинический и прогностический эффект применения высоких доз блокаторов медленных кальциевых каналов у пациентов с ИЛГ и положительным вазореактивным тестом (респондеров) был продемонстрирован в нерандомизированных и неконтролируемых исследованиях, проведенных в отдельных центрах [38, 41]. Однако было бы неэтично проводить плацебо-контролируемое исследование применения блокаторов медленных кальциевых каналов у пациентов с положительным вазореактивным тестом [57]. Эмпирическое назначение блокаторов кальциевых каналов при отсутствии данных вазореактивного теста строго противопоказано ввиду возможных опасных побочных эффектов. Из группы блокаторов кальциевых каналов чаще всего используются нифедипин, дилтиазем, а также амлодипин. Дозировки блокаторов медленных кальциевых каналов, показавших свою эффективность у пациентов с ИЛГ, достаточно высокие, например, для нифедипина суточная доза может составлять 120–240 мг, 240–720 мг — для дилтиазема [41] и до 20 мг — для амлодипина. Рекомендуется начинать лечение с небольших доз (например, 30 мг 2 раза в день для нифедипина, медленно высвобождающегося, или 60 мг 3 раза в день для дилтиазема, 5 мг в сутки для амлодипина), затем увеличивать дозу препарата с осторожностью, но неуклонно, в течение нескольких недель до максимально переносимой дозы. Среди пациентов с ИЛГ около 10 % имеют положительный острый вазореактивный тест, и только у половины из них будет долговременный клинический и гемодинамический ответ на терапию блокаторами кальциевых каналов. Монотерапия ими возможна только у пациентов с клиническим и гемодинамическим эффектом. Cам по себе положительный вазореактивный тест не является предиктором хорошего долговременного ответа на лечение блокаторами медленных кальциевых каналов, особенно это касается пациентов с ПЛГ, ассоциированной с системными заболеваниями соединительной ткани, которые крайне редко хорошо переносят терапию высокими дозами блокаторов медленных кальциевых каналов.
Синтетический простациклин и его аналоги (простаноиды)
Простациклин вызывает сильную вазодилатирующую реакцию во всех сосудистых бассейнах и вырабатывается преимущественно клетками эндотелия. Он является самым мощным эндогенным ингибитором агрегации тромбоцитов, а также обладает цитопротективной и антипролиферативной активностью [58]. У пациентов с ЛГ нарушен метаболизм простациклина: было обнаружено снижение экспрессии простациклинсинтазы в сосудах ЛА и уменьшение выделения метаболитов простациклина с мочой [59].
Эпопростенол (синтетический простациклин) в стабильном состоянии представляет сухую замороженную субстанцию, которую необходимо растворить непосредственно перед в/в введением. Эпопростенол имеет короткий период полураспада (3–5 мин) и остается стабильным при комнатной температуре только в течение 8 ч; это объясняет необходимость постановки постоянного катетера «туннельного» типа и обеспечения непрерывного введения лекарства с помощью специальной помпы. Эффективность постоянного в/в введения эпопростенола была проверена в трех открытых рандомизированных контролируемых исследованиях у пациентов с ИЛГ [60, 61] и ПЛГ, ассоциированной со склеродермией [62]. Терапия эпопростенолом уменьшает проявления заболевания, увеличивает толерантность к физической нагрузке и показатели гемодинамики у обеих групп пациентов с ПЛГ. Эпопростенол является единственным препаратом, увеличивающим выживаемость пациентов с ИЛГ, что было доказано рандомизированными исследованиями. Терапия эпопростенолом начинается с небольших доз — 2–4 нг/кг/мин, с последующим постепенным увеличением до дозы, которая лимитируется появлением побочных эффектов (приливы, головная боль, диарея, боль в нижних конечностях). Оптимальная дозировка подбирается индивидуально и в большинстве случаев варьирует от 20 до 40 нг/кг/мин [45, 46]. К серьезным побочным эффектам терапии эпопростенолом относят поломку системы доставки лекарства — помпы, местные инфекционные осложнения, обструкцию катетера и сепсис. Следует избегать внезапного прекращения введения эпопростенола, поскольку у некоторых пациентов это может привести к синдрому отмены, сопровождающемуся значительным ухудшением течения ЛГ и даже смертью.
Трепростинил — трициклический бензидиновый аналог эпопростенола, который обладает достаточной химической стабильностью и может применяться при комнатной температуре. Эти характеристики трепростинила позволяют использовать как в/в, так и п/к путь введения. Более того, при п/к введении препарата можно использовать микроинфузионные помпы и маленькие подкожные катетеры. Эффективность трепростинила у пациентов с ЛГ была изучена в крупнейшем всемирном рандомизированном контролируемом исследовании. В нем было продемонстрировано уменьшение симптомов заболевания, увеличение толерантности к физической нагрузке, улучшение гемодинамических показателей [63]. Наибольшее влияние препарата на переносимость физической нагрузки было достигнуто среди исходно более тяжелых пациентов и тех больных, которые могли переносить нагрузки > 13,8 нг/кг/мин. Самый частый побочный эффект трепростинила — боль в месте введения препарата, появление которой приводит к отказу от лечения в 8 % случаев и ограничению наращивания дозы у других больных. Отмечено увеличение выживаемости среди 15 % пациентов, которые продолжали монотерапию трепростинилом [64]. В другом долгосрочном открытом исследовании эффективности п/к введения трепростинила у пациентов с ИЛГ или хронической тромбоэмболической ЛГ было продемонстрировано устойчивое улучшение переносимости физической нагрузки, уменьшение интенсивности симптомов в течение 26 мес. наблюдения [65]. В США трепростинил был одобрен также для в/в применения у пациентов с ПЛГ. Однако для достижения эффекта, сопоставимого с эпопростенолом, доза трепростинила была в 2–3 раза выше. Тем не менее трепростинил более удобен в использовании, так как кассету с препаратом можно менять 1 раз в 48 ч, тогда как с эпопростенолом — каждые 12 ч. Недавно завершилась III фаза рандомизированного контролируемого исследования с ингаляционным трепростинилом. В предварительных результатах отмечено увеличение толерантности к физической нагрузке. В настоящее время пероральная форма трепростинила проходит изучение в рандомизированных контролируемых клинических исследованиях у пациентов с ПЛГ.
Берапрост — первый химически стабильный пер-оральный аналог простациклина. Было проведено 2 рандомизированных контролируемых исследования [66, 67], которые показали, что увеличение толерантности к физической нагрузке на фоне приема берапроста сохраняется только в течение 3–6 мес.
Илопрост — химически стабильный аналог простациклина, который можно применять, используя различные пути введения (в/в, пероральный, ингаляционный). Применение ингаляционных препаратов у пациентов с ЛГ является очень привлекательной идеей, в пользу которой есть теоретическое обоснование более высокой селективности для легочного кровотока при таком пути введения лекарства. Эффективность применения аэрозольной формы илопроста была изучена в одном рандомизированном контролируемом исследовании. В нем сравнивался эффект ингаляций илопроста (6–9 раз в день, 2,5–5 мкг на ингаляцию, в среднем 30 мкг/сут) с плацебо-ингаляцией у пациентов с ЛГ (в том числе и хронической тромбоэмболической ЛГ) [68]. Было отмечено увеличение толерантности к физической нагрузке, уменьшение симптомов ПЛГ, ОЛСС и клинических событий у включенных больных. В рандомизированном контролируемом исследовании применения аэрозольной формы илопроста у пациентов, уже получающих бозентан, было продемонстрировано увеличение толерантности к физической нагрузке по сравнению с пациентами, получающими бозентан и плацебо. В целом аэрозольная форма илопроста хорошо переносится. Длительное в/в введение илопроста сопоставимо по эффективности с эпопростенолом, что было показано на примере небольшой группы пациентов с хронической тромбоэмболической ЛГ [69].
Антагонисты эндотелиновых рецепторов I типа
Доказано, что у пациентов с ЛГ происходит активация системы эндотелина-1 как в плазме крови, так и в тканях легких [70]. Остается до конца не ясным, является ли повышение уровня эндотелина-1 в плазме причиной ЛГ или ее следствием [71]. Тем не менее исследования тканевой системы эндотелина-1 подтверждают важную роль эндотелина-1 в патогенезе ЛГ [50].
Бозентан — самый первый пероральный неселективный препарат класса блокаторов рецепторов эндотелина А и В. Терапия бозентаном была изучена у пациентов с ЛГ в 5 рандомизированных контролируемых исследованиях, которые продемонстрировали увеличение толерантности к физической нагрузке, уменьшение функционального класса ПЛГ, улучшение параметров гемодинамики, ЭхоКГ и допплерографических показателей, а также увеличение времени до клинического ухудшения [72–76]. В два рандомизированных контролируемых исследования были включены исключительно пациенты II ФК по BОЗ/NYHA [75] или больные с синдромом Эйзенменгера [76]. Длительные обсервационные исследования подтвердили долгосрочный эффект терапии бозентаном [9]. У 10 % пациентов развивается дозозависимое повышение печеночных трансаминаз, которое полностью обратимо при снижении дозы бозентана или его отмены. Поэтому пациенты, получающие терапию бозентаном, должны не реже 1 раза в месяц сдавать анализ крови, определяющий функцию печени.
Ситаксентан — селективный пероральный блокатор рецепторов эндотелина А. Его эффективность была изучена в двух рандомизированных контролируемых исследованиях у пациентов с ЛГ II/III ФК по BОЗ/NYHA [77, 78]. В зависимости от этиологии ЛГ в группу вошли пациенты с ИЛГ, ПЛГ, ассоциированной с системными заболеваниями соединительной ткани или врожденными пороками сердца. Эти исследования продемонстрировали увеличение толерантности к физической нагрузке и улучшение показателей гемодинамики на фоне лечения ситаксентаном. В открытом обсервационном исследовании была отмечена стабильность эффекта лечения ситаксентаном в течение года [79]. Частота развития изменения функциональных печеночных тестов составила 3–5 % для одобренной дозировки ситаксентана в 100 мг/сут, она носила полностью обратимый характер. Однако этот побочный эффект ситаксентана требует ежемесячного контроля печеночных проб. Взаимодействие с варфарином диктует снижение дозы последнего на 80 % во избежание увеличения МНО.
Амбризентан — несульфонамидный селективный антагонист рецепторов эндотелина А, относится к препаратам пропаноидной кислоты. Терапия амбризентаном была изучена в одном пилотном [80] и двух крупных рандомизированных контролируемых исследованиях, которые продемонстрировали уменьшение клинических симптомов ПЛГ, повышение толерант-ности к физической нагрузке, улучшение показателей гемодинамики и увеличение времени до клинического ухудшения [81]. В открытом обсервационном исследовании была отмечена стабильность эффекта лечения амбризентаном в течение года [81]. Амбризентан также одобрен для лечения пациентов II ФК по ВОЗ/NYHA. Доза 5 мг/сут может быть увеличена до 10 мг/сут при исходной хорошей переносимости препарата.
Частота изменения функциональных печеночных тестов составляет 0,8–3 % случаев. Тем не менее все пациенты, принимающие амбризентан, должны ежемесячно контролировать печеночные тесты. Следует с осторожностью назначать амбризентан вместе с кетоконазолом и циклоспорином.
Ингибиторы фосфодиэстеразы 5-го типа
Силденафил — пероральный мощный селективный ингибитор фосфодиэстеразы-5, который реализует свой фармакологический эффект путем увеличения концентрации циклического гуанозинмонофосфата в клетке. В ряде неконтролируемых исследований был описан благоприятный эффект терапии силденафилом у пациентов с ИЛГ, ПЛГ, ассоциированной с системными заболеваниями соединительной ткани, врожденными пороками сердца, а также хронической тромбоэмболической ЛГ [82–84]. Наиболее значимым стало рандомизированное контролируемое исследование с 278 пациентами с ПЛГ, которые получали терапию силденафилом в дозировках 20, 40 и 80 мг 3 раза в день. В нем было получено подтверждение положительного влияния силденафила на толерантность к физической нагрузке, выраженность симптомов и гемодинамику [85]. Несмотря на одобренную дозу силденафила 20 мг 3 раза в день, длительное сохранение эффекта терапии в течение 1 года наблюдалось только при использовании силденафила в дозе 80 мг 3 раза в день. Обычно в клинической практике необходима титрация дозировки силденафила свыше 20 мг 3 раза в день (обычно 40–80 мг 3 раза в день). Большинство нежелательных эффектов силденафила легкой или средней степени тяжести и чаще всего обусловлены вазодилатацией.
Тадалафил — пероральный препарат однократного приема, селективный ингибитор фосфодиэстеразы-5, одобренный в настоящее время для лечения эректильной дисфункции. Наиболее важное рандомизированное контролируемое клиническое исследование включало 406 пациентов с ПЛГ, которые получали 5, 10, 20 или 40 мл тадалафила в день [86]. В нем был продемонстрирован благоприятный эффект на толерантность к физической нагрузке, выраженность симптомов, гемодинамику, а также время до ухудшения течения ЛГ при использовании наибольшей дозировки [86]. Побочные эффекты, возникающие на фоне терапии силденафилом и тадалафилом, имеют сходный профиль.
Многокомпонентная терапия
Комбинированная терапия — одновременное применение более одного класса ПЛГ-специфической медикаментозной терапии, то есть антагонистов рецепторов эндотелина, блокаторов фосфодиэстеразы-5, простаноидов или новых исследуемых препаратов. Несмотря на отсутствие долгосрочных исследований, оценивающих эффективность и безопасность такого лечения, большое количество отдельных случаев показало, что различные комбинации ЛС могут быть и эффективными, и безопасными. Рандомизированные контролируемые исследования продемонстрировали эффективность комбинации бозентана и эпопростенола [74], добавления илопроста в аэрозольной форме к базовой терапии бозентаном [87], комбинации бозентана с исходной терапией силденафилом [75], назначение силденафила к базовой терапии эпопростенолом [88], присоединение ингаляций трепростинила к исходному лечению бозентаном или силденафилом или добавление тадалафила к исходной терапии бозентаном. Кроме того, продолжаются клинические исследования новых лекарств. Остается много нерешенных вопросов относительно комбинированной терапии, включая выбор комбинаций и оптимального времени для их применения. Кандидатами для комбинированной терапии являются пациенты, чье клиническое состояние можно охарактеризовать как стабильное, но неудовлетворительное или нестабильное и ухудшающееся. Определение показаний и начало комбинированной терапии должно осуществляться только специализированными центрами по лечению ПЛГ.
Баллонная атриосептостомия
Значение баллонной атриосептостомии в лечении пациентов с ЛГ остается неясным, поскольку ее эффективность была описана только в небольших исследованиях и в отдельных клинических случаях [23]. При ретроспективном сравнении контрольной группы и группы пациентов с атриосептостомией в последней отмечалось уменьшение выраженности симптомов, улучшение гемодинамических показателей, а также увеличение выживаемости. В большинстве случаев атриосептостомия проводилась у пациентов, находящихся в крайне тяжелом состоянии, в качестве паллиативной операции перед трансплантацией легких, что может объяснить высокую летальность во время процедуры — 5–15 %. В настоящее время эта процедура проводится только в специализированных центрах при неэффективности доступной медикаментозной терапии.
Трансплантация легких
Результаты трансплантации легких и комплекса «сердце — легкие» у пациентов с ЛГ оценены только в проспективных неконтролируемых исследованиях, поскольку проведение рандомизированных контролируемых исследований признано неэтичным при отсутствии возможностей выбора альтернативного лечения [23]. Выживаемость пациентов после трансплантации легких или комплекса «сердце — легкие» через 3 года составляет 55 и 45 % через 5 лет [89]. У пациентов с ЛГ проводились билатеральная и унилатеральная трансплантация легких, кроме того, эти операции сочетались с выполнением коррекции врожденных пороков сердца у пациентов с синдромом Эйзенменгера. Выживаемость реципиентов была сопоставима после уни- и билатеральной трансплантации легких, а также после трансплантации комплекса «сердце — легкие» у пациентов с ПЛГ. Однако в настоящее время большинство трансплантационных центров предпочитают выполнять билатеральную трансплантацию легких. Трансплантация легких и комплекса «сердце — легкие» показана пациентам с ЛГ III–IV ФК по BОЗ/NYHA, с симптомами, рефрактерными к доступным медикаментозным методам лечения. Непредсказуемость периода нахождения в листе ожидания и нехватка донорских органов осложняют принятие решения относительно оптимального времени постановки в лист ожидания на трансплантацию.
Алгоритм лечения
Алгоритм лечения пациентов с ЛГ показан на рис. 11 [51]. Уровни рекомендаций и доказательности для различных видов терапии ЛГ [52] представлены в табл. 4. Определение вариантов клинического ответа на терапию представлено в табл. 5.
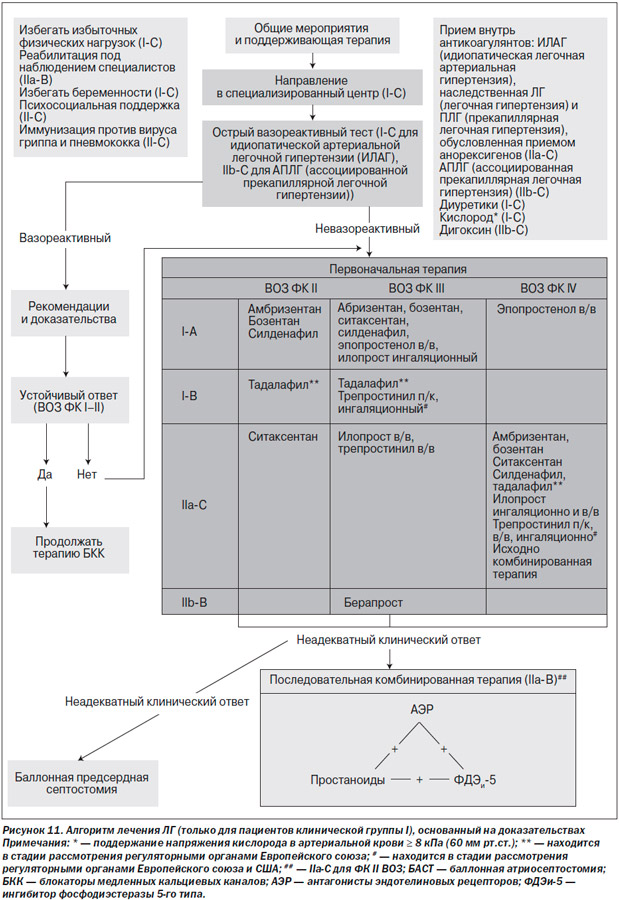
Алгоритм лечения не подходит для пациентов с ЛГ других клинических групп, особенно для пациентов с ЛГ на фоне патологии левых камер сердца или с паренхиматозными заболеваниями легких.
Общие мероприятия и начало поддерживающей терапии следует начинать только после установления диагноза ПЛГ.
Учитывая сложность обследования пациентов с ЛГ и наличие различных видов ПЛГ-специфической терапии, рекомендуется направлять пациентов с ЛГ в специализированные центры.
Необходимо выполнять острый вазореактивный тест. Терапию высокими дозами блокаторов медленных кальциевых каналов следует начинать согласно описанным правилам.
Пациентам с ЛГ II ФК по ВОЗ/NYHA и отрицательным вазореактивным тестом следует назначать терапию антагонистами рецепторов эндотелина или блокаторами фосфодиэстеразы-5.
Пациентов с отрицательным вазореактивным тестом или респондеров, которые остаются в прежнем функциональном классе по ВОЗ/NYHA или чье состояние ухудшилось до III ФК по ВОЗ/NYHA, следует считать кандидатами для назначения антагонистов рецепторов эндотелина либо ингибиторов фосфодиэстеразы-5, или простаноидов. Поскольку в этом случае нет сравнительных данных о том, который из препаратов будет наиболее предпочтителен в качестве специфической ПЛГ-терапии первой линии, выбор лекарства зависит от многих факторов, включая наличие локального одобрения к применению, способ назначения, профиль побочных эффектов, желание пациента и опыт врача. Некоторые специалисты все еще используют эпопростенол в качестве препарата первой линии у пациентов III ФК по ВОЗ/NYHA, учитывая доказанное положительное влияние на выживаемость.
Длительное в/в лечение эпопростенолом в качестве терапии первой линии может быть назначено пациентам с ЛГ IV ФК по ВОЗ NYHA, учитывая доказанное положительное влияние на выживаемость. В/в и п/к введение трепростинила также одобрено для лечения пациентов с ЛГ IV ФК по ВОЗ/NYHA в США. Несмотря на отсутствие рандомизированных контролируемых исследований с в/в введением илопроста, этот аналог простагландина I2 был одобрен к применению в Новой Зеландии. Антагонисты рецепторов эндотелина и ингибиторы фосфодиэстеразы-5 считаются препаратами второй линии для пациентов с высокой степенью тяжести ПЛГ, тем не менее даже у больных с ЛГ IV ФК по ВОЗ/NYHA в качестве терапии первой линии можно начинать с комбинированного медикаментозного лечения.
При неадекватном клиническом ответе (табл. 5) можно начинать последовательную комбинированную терапию. Комбинированная терапия может включать в себя сочетание простаноида и антагониста рецепторов к эндотелину или антагонист рецепторов к эндотелину и ингибитор фосфодиэстеразы-5, или простаноид и ингибитор фосфодиэстеразы-5. Еще до конца не определены наиболее адекватные временные интервалы для начала комбинированной терапии и дозировки, с оптимальным профилем побочных эффектов.
Баллонная атриосептостомия и/или трансплантация легких показаны пациентам с ЛГ и неадекватным клиническим ответом (табл. 5), несмотря на оптимальную медикаментозную терапию или при отсутствии доступного медикаментозного лечения. Эти виды оперативных вмешательств должны проводиться только в специализированных центрах.
Специфические типы первичной легочной гипертензии
Первичная легочная гипертензия в педиатрии
ПЛГ в педиатрии имеет сходные черты с ЛГ у взрослых, несмотря на то, что легкие ребенка находятся в процессе своего развития. Предположение о более худшей прогнозируемой выживаемости у детей (в среднем 10 мес.) по сравнению со взрослыми пациентами с ЛГ (2,8 года) не подтвердилось [21]. Точные данные о частоте и распространенности ЛГ у детей неизвестны. Персистирующая ЛГ новорожденных относится согласно классификации к ЛГ I группы, однако течение заболевания, лечение и исход совершенно отличаются, и поэтому это заболевание не будет нами обсуждаться. Не было обнаружено никаких различий в механизмах развития ЛГ у детей и взрослых. Даже частота положительного острого вазореактивного теста сопоставима у детей и взрослых с ПЛГ. Однако дети чаще всего выглядят более тяжелыми пациентами по сравнению со взрослыми. Диагностический алгоритм ЛГ у детей не отличается от такового у взрослых. Очень сложно предсказать ответ на медикаментозную терапию у детей. Так, у некоторых пациентов наблюдается существенное улучшение состояния, тогда как у других может возникнуть потребность в скорейшей эскалации лечения. Алгоритм лечения у детей практически идентичен стратегии терапии у взрослых, несмотря на недостаток доказательных исследований.
Лечение пациентов должно включать пристальное динамическое наблюдение: своевременное и быстрое лечение инфекции верхних или нижних дыхательных путей, которые могут стать причиной быстрого ухудшения состояния. Назначение антикоагулянтов детям крайне противоречиво, так как исследования по этой проблеме отсутствуют. Блокаторы медленных кальциевых каналов следует назначать только респондерам, с обязательным последующим наблюдением, поскольку длительная терапия может со временем стать неэффективной. Проведено несколько исследований, в которых изучались дозировки новых препаратов, применяемых у детей. Так, были получены данные о дозировании и фармакокинетике бозентана у детей [90]. Несколько неконтролируемых исследований продемонстрировали положительный эффект терапии у детей, сходный с таковым у взрослых и составляющий 80–90 % за год [91]. До сих пор нет сведений об эффектах селективных антагонистов рецепторов эндотелина А. Терапия силденафилом продемонстрировала некоторые положительные эффекты [92], и в настоящее время рандомизированное контролируемое исследование находится в процессе реализации. Показания к началу терапии эпопростенолом такие же, как и у взрослых. Увеличивается количество детей, получающих комбинированное медикаментозное лечение. У детей проводят септостомию с хорошим эффектом, также возможно выполнение шунтирования Пота (создание анастомоза между нисходящим отделом аорты и левой ветвью ЛА) [93]. Так же как и у взрослых, нехватка донорских легких является главной проблемой в трансплантации у детей.
Первичная легочная гипертензия, ассоциированная с врожденными пороками сердца
Первичная легочная гипертензия, ассоциированная с врожденными пороками сердца и системно-легочным шунтированием крови, относится к клинической группе I согласно классификации ЛГ (табл. 2). Клиническая (табл. 6) и патофизиологическая классификации (табл. 7) очень полезны для индивидуальной характеристики каждого пациента [2].
У взрослых пациентов с врожденными пороками сердца распространенность ЛГ составляет 5–10 % [94]. Длительная нагрузка сосудов легких увеличенным объемным кровотоком и повышенным давлением приводит к формированию обструктивной артериопатии сосудов легких, идентичной ИЛГ, которая ведет к повышенной ОЛСС. Если ОЛСС превышает общее периферическое сосудистое сопротивление (ОПСС), то происходит реверсия шунта (синдром Эйзенменгера).
Клиническая картина при синдроме Эйзенменгера включает полиорганную недостаточность, которая развивается со временем. Признаки и симптомы заболевания включают наличие центрального цианоза, одышки, слабости, кровохарканья, обмороков и в далеко зашедшей стадии — проявлений правожелудочковой ХСН. Выживаемость пациентов с синдромом Эйзенменгера снижена по сравнению с общей популяцией населения, однако она значительно выше по сравнению с пациентами с ИЛГ и сопоставимым функциональным классом ЛГ по BОЗ/NYHA.
Стратегия лечения пациентов с ПЛГ, ассоциированной с врожденными пороками сердца и системно-легочными шунтами, и в особенности больных с синдромом Эйзенменгера в основном основывается на клиническом опыте специализированных центров, нежели на основе доказательной медицины. Алгоритм лечения такой, как и ранее представленный для ЛГ [95] (рис. 11).
Общие меры включают рекомендации по физической активности, беременности и контрацепции, профилактике инфекций, путешествиям и пребывании в условиях высокогорья, оперативным вмешательствам и психологической помощи. Флеботомии показаны только при наличии симптомов гипервязкости крови и при гематокрите > 65 %. Применение кислородной поддержки в качестве терапии крайне противоречиво и может использоваться только при значительном увеличении РаО2 на фоне вдыхания кислорода. Терапия антикоагулянтами для приема внутрь (варфарином) может быть назначена пациентам с признаками тромбоза ЛА при отсутствии или незначительном кровохарканье. Три класса препаратов, корригирующих дисфункцию эндотелия, были одобрены для лечения ПЛГ: простаноиды, антагонисты рецепторов эндотелина, ингибиторы фосфодиэстеразы-5. Эффективность и безопасность этих препаратов была подтверждена в неконтролируемых исследованиях у пациентов с ПЛГ, ассоциированной с корригированными и некорригированными врожденными пороками сердца и системно-легочными шунтами, и у больных с синдромом Эйзенменгера. Единственное рандомизированное контролируемое исследование у пациентов с синдромом Эйзенменгера подтвердило благоприятные краткосрочный и долгосрочный эффекты терапии неселективным антагонистом рецепторов эндотелина бозентаном [76]. В настоящее время отсутствуют публикации о комбинированной терапии у этой группы пациентов, хотя существует такое же основание к ней, как и при ИЛГ. Трансплантация легких с коррекцией врожденного порока сердца или трансплантация комплекса «сердце — легкие» являются методом выбора для пациентов, имеющих маркеры неблагоприятного прогноза.
Первичная легочная гипертензия при системных заболеваниях соединительной ткани
ЛГ является хорошо известным осложнением системных заболеваний соединительной ткани, таких как системная склеродермия [96], системная красная волчанка, смешанные заболевания соединительной ткани, и в меньшей степени — ревматоидного артрита, дерматомиозита и первичного синдрома Шегрена. У этой категории пациентов ЛГ может развиваться в сочетании с интерстициальным фиброзом легких или в результате изолированной артериопатии легких. Кроме того, может присутствовать и ПЛГ вследствие поражения левых камер сердца. Необходимо установить, какой механизм является ведущим в формировании ЛГ, так как это определяет тактику ведения пациента, которая может существенно различаться. Наиболее часто ЛГ развивается при системной склеродермии, особенно при ее лимитированных формах или CREST-cиндроме (кальцинаты в подкожно-жировой клетчатке, синдром Рейно, поражение пищевода, склеродактилия, телеангиэктазия). Распространенность гемодинамически подтвержденной ЛГ при системной склеродермии варьирует от 7 до 12 %, по данным крупных когортных исследований [96, 97]. Гистопатологические изменения при ПЛГ, ассоциированной с системными заболеваниями соединительной ткани, обычно не отличаются от изменений при ИЛГ. Остаются неизвестными патофизиологические механизмы, которые приводят к развитию ЛГ у пациентов с системными заболеваниями соединительной ткани. Учитывая обнаружение антинуклеарных антител, ревматоидного фактора, иммуноглобулина G и отложение компонентов системы комплемента в стенке ЛА у пациентов с ПЛГ, было высказано предположение об иммунологическом механизме формирования ЛГ при системных заболеваниях соединительной ткани. По сравнению с пациентами с ИЛГ пациенты с ЛГ на фоне системных заболеваний соединительной ткани преимущественно женского пола, более старшего возраста, и у них отмечается более низкий сердечный выброс. Симптомы и признаки очень схожи с таковыми при ИЛГ. Более того, диагноз системного заболевания соединительной ткани у некоторых пациентов обнаруживается случайно при выполнении скрининговых иммунологических тестов. Доказано, что смертность при ЛГ на фоне системного заболевания соединительной ткани выше, чем при ИЛГ (40 % за год у пациентов с продвинутой стадией заболевания). Предикторы неблагоприятного исхода такие же, как и для пациентов с ИЛГ: давление в ПП, давление в ЛА и сердечный индекс. Рекомендуется ежегодная скрининговая ЭхоКГ с целью выявления ЛГ у всех пациентов со склеродермией даже при отсутствии симптомов ЛГ. При других системных заболеваниях соединительной ткани ЭхоКГ рекомендуется выполнять только при наличии симптомов. Как и при других формах ПЛГ, при подозрении на ЛГ, ассоциированную с системным заболеванием соединительной ткани, должна выполняться катетеризация полостей сердца с манометрией с целью подтверждения диагноза, оценки тяжести ЛГ, исключения патологии левых камер сердца. Лечение пациентов с ЛГ на фоне системного заболевания соединительной ткани более сложное по сравнению с пациентами с ИЛГ. Складывается впечатление, что иммуносупрессивная терапия эффективна только у небольшого числа пациентов с системными заболеваниями соединительной ткани, которые не являются склеродермией. Острый вазореактивный тест и долгосрочный положительный эффект применения блокаторов медленных кальциевых каналов встречаются еще реже у пациентов с ЛГ на фоне системных заболеваний соединительной ткани по сравнению с пациентами с ИЛГ. Остается не совсем изученным отношение риска к пользе приема антикоагулянтов для приема внутрь пациентами с ЛГ на фоне системных заболеваний соединительной ткани.
Подгрупповой анализ пациентов со склеродермией, включенных в рандомизированные контролируемые исследования с применением бозентана [73], ситаксентана [98] и силденафила, продемонстрировал положительный эффект всех препаратов. П/к введение трепростинила приводило к увеличению толерантности к физической нагрузке, уменьшению выраженности симптомов ЛГ и улучшению показателей гемодинамики у пациентов с ПЛГ, ассоциированной с системным заболеванием соединительной ткани [100]. Длительная терапия эпопростенолом улучшала переносимость физических нагрузок, симптоматику и показатели гемодинамики у пациентов с ЛГ на фоне склеродермии, что было продемонстрировано в 3-месячном клиническом исследовании [62]. При ретроспективном анализе было установлено, что при применении эпопростенола в/в у пациентов с ИЛГ выживаемость выше по сравнению с пациентами с ПЛГ, ассоциированной со склеродермией.
Портопульмональная легочная гипертензия
ПЛГ — частое осложнение хронических заболеваний печени [101, 102]. Портальная гипертензия сама является главным определяющим фактором риска развития ЛГ [101]. Были проведены 2 ретроспективных исследования среди пациентов — кандидатов для трансплантации печени, которые обнаружили распространенность ЛГ в 4 и 3,5 % случаев соответственно. Механизм, который способствует развитию ЛГ у пациентов с портальной гипертензией, остается не изученным [101]. Наличие портосистемного шунта может способствовать образованию вазоконстрикторных и васкулопролиферативных субстанций, которые достигают легочного кровотока, а в норме выводятся через печень. Клиническая картина у пациентов с портопульмональной гипертензией может быть совершенно не отличимой от ИЛГ или включать комбинацию симптомов и признаков патологии печени [101]. Кандидатам на трансплантацию печени и пациентам с патологией печени и симптомами заболевания надо проходить ЭхоКГ для исключения ЛГ. Катетеризацию правых камер сердца и манометрию следует проводить во всех случаях повышения симпатического давления в ЛА для уточнения гемодинамических нарушений, прогноза и стратегии лечения. По сравнению с пациентами с ИЛГ у больных с портопульмональной гипертензией значительно более высокий сердечный индекс, низкие ОЛСС и ОПСС. При анализе ретроспективного исследования [101] было обнаружено, что пациенты с портопульмональной гипертензией имеют лучшие показатели выживаемости по сравнению с пациентами с ИЛГ. Применение β-адреноблокаторов, часто используемых у пациентов с портопульмональной гипертензией с целью снижения риска кровотечения из варикозно расширенных вен, ухудшает гемодинамику и толерантность к физической нагрузке у пациентов с портопульмональной гипертензией. Лечение портопульмональной гипертензии не было подробно изучено, и только несколько исследований было выполнено с использованием ПЛГ-специфической терапии [103–105]. Однако алгоритм лечения, представленный на рис. 11, может быть применен и к этой категории пациентов. Следует избегать антикоагулянтной терапии у пациентов с повышенным риском кровотечения. Тщательным должно быть мониторирование терапии антагонистами рецепторов эндотелина, так как эти препараты обладают гепатотоксичностью. Пациенты с портопульмональной гипертензией хорошо отвечают на длительную в/в терапию эпопростенолом. Тяжелая ЛГ значительно увеличивает риск, сзязанный с трансплантацией печени. Обычно наличие ЛГ считают противопоказанием, если среднее давление в ЛА > 35 мм рт.ст. и/или
ОЛСС ≥ 250 дин • с • см–5 [106]. Тем не менее проводится одновременная трансплантация легких и печени [107].
Первичная легочная гипертензия при ВИЧ-инфекции
ПЛГ — редкое, но хорошо известное осложнение ВИЧ-инфекции. В большом исследовании «случай — контроль» у 3349 ВИЧ-инфицированных пациентов за период 5,5 года суммарная частота развития ЛГ составила 0,57 %, со среднегодовой частотой 0,1 % [108]. Недавно эти результаты получили свое подтверждение [109]. Механизм развития ЛГ остается неизвестным. ПЛГ, ассоциированная с ВИЧ-инфекцией, имеет схожие клинические, гемодинамические и гистологические черты, как и при ИЛГ. Не выявлено связи между путем передачи ВИЧ-инфекции и степенью иммуносупрессии. Пациентам с ВИЧ-инфекцией и симптомами показана ЭхоКГ. Необходимо исключать другие причины ЛГ, такие как патология левых камер сердца и паренхиматозные заболевания легких. Для подтверждения диагноза ПЛГ, ассоциированной с ВИЧ, оценки тяжести и исключения патологии левых камер сердца показана катетеризация правых камер сердца. ЛГ является независимым предиктором летального исхода у пациентов с ВИЧ-инфекцией [108]. Терапевтические подходы в лечении пациентов с ПЛГ, ассоциированной с ВИЧ-инфекцией, еще до конца не разработаны. Прием антикоагулянтов внутрь обычно противопоказан из-за риска кровотечения, слабой приверженности к терапии и возможным лекарственным взаимодействиям. Эффективность специфической терапии ЛГ была подтверждена в различных открытых исследованиях. Поэтому в лечении пациентов с ВИЧ-инфекцией и ЛГ рекомендуется использовать алгоритм лечения, представленный на рис. 11.
Веноокклюзионная болезнь легких
Веноокклюзионную болезнь легких и легочный капиллярный гемангиоматоз считают редкими состояниями, однако чаще всего эти заболевания обнаруживаются именно при ЛГ [110]. Они отнесены в специальную подгруппу клинической классификации (табл. 2, группа I) из-за гистологических, клинических и терапевтических отличий от других форм ПЛГ, включенных в I группу. В литературе описано менее 200 случаев веноокклюзионной болезни легких и легочного капиллярного гемангиоматоза. Эти заболевания имеют сходство между собой, особенно в отношении гистологических изменений в паренхиме легких, то есть наличие гемосидероза легких, интерстициального отека, лимфаденопатии, фиброза интимы ЛА и гипертрофии медиального слоя [3]. Клиническая картина ЛГ у пациентов с ВИЧ-инфекцией не отличается от ИЛГ. Однако при обследовании можно выявить изменения, которые отличаются от ИЛГ, такие как утолщение концевых фаланг пальцев и хрипы в нижних отделах легких при аускультации. Тем не менее дли веноокклюзионной болезни и легочного капиллярного гемангиоматоза характерны более тяжелая гипоксемия, уменьшение диффузии оксида углерода, тогда как объемные показатели легких и спирометрия обычно остаются в пределах нормы. Гемодинамические показатели веноокклюзионной болезни легких и легочного капиллярного гемангиоматоза сходные с таковыми при ИЛГ, хотя у некоторых больных гипоксемия непропорциональна степени ЛГ и дисфункции ПЖ. ДЗЛА обычно остается в пределах нормальных значений, несмотря на вовлеченность посткапиллярного сегмента. В действительности патологические изменения обычно обнаруживаются в венулах, но без вовлечения крупных вен. Причина нормальных значений ДЗЛА объясняется тем, что на статическое давление столба жидкости во время измерения ДЗЛА не влияют изменения в мелких легочных венах, так как сообщение поддерживается более крупными непораженными легочными венами, в которых и будет измеряться давление по окклюзированному артериальному сегменту. Рентгенологические методы могут быть большим подспорьем в обнаружении веноокклюзионной болезни/легочного капиллярного гемангиоматоза [111]. Наличие линий Керли, плеврального выпота и неравномерных затемнений на стандартной рентгтенограмме — важные признаки, подозрительные на эту редкую патологию. Многослойная КТ грудной клетки выявляет характерные признаки (рис. 8Б): наиболее частые находки — пятнистые центролобулярные затемнения по типу «матового стекла», утолщение междолевых перегородок, выпот в плевральной полости и аденопатия лимфоузлов средостения. По сравнению с пациентами с ИЛГ у больных с веноокклюзионной болезнью легких или легочным капиллярным гемангиоматозом значительно увеличена клеточность в бронхоальвеолярном лаваже с повышенным содержанием сидерофагов. В диагностике веноокклюзионной болезни легких и легочного капиллярного гемангиоматоза необходимо применять тот же диагностический алгоритм, как при других подгруппах ПЛГ. Прогноз для пациентов с веноокклюзионной болезнью легких и легочным капиллярным гемангиоматозом наиболее неблагоприятный с быстрым прогрессированием. В лечении следует с особой осторожностью использовать вазодилататоры, особенно эпопростенол, так как у этой группы пациентов существует высокий риск развития отека легких [112]. Тем не менее есть отдельные публикации об устойчивом клиническом улучшении среди отдельных пациентов на этой терапии. Нет сведений относительно применения новых лекарств у этой группы пациентов, таких как антагонисты рецепторов эндотелина. Применение атриосептостомии –ограничено гипоксемией. Единственный метод лечения веноокклюзионной болезни легких и легочного капиллярного гемангиоматоза — трансплантация легких, и, так же как и для ИЛГ, здесь нет сведений о рецидиве заболевания после трансплантации.
Легочная гипертензия, обусловленная патологией левых камер сердца (группа II)
Патофизиология, гистологическая картина и эпидемиология ЛГ, ассоциированной с патологией левых камер сердца, обсуждается в разделах «Патофизиология и гистология ЛГ» и «Генетика и эпидемиология».
Диагностика
Появление ЛГ у пациентов с ХСН значительно ухудшает прогноз. При наблюдении за пациентами с ХСН в течение 28 мес. было обнаружено, что у пациентов с умеренной ЛГ смертность составила 57 % по сравнению с 17 % у пациентов без ЛГ. Пациенты с ОЛСС более 6–8 ед. Вуда имеют высокий риск развития правожелудочковой недостаточности после трансплантации сердца. При возможности фармакологического снижения ОЛСС (в/в нитропруссид) риск этого осложнения может быть снижен [113]. Обследование при ЛГ на фоне патологии левых камер сердца должно осуществляться согласно диагностическому алгоритму ЛГ, представленному ранее. В качестве скринингового метода особое значение имеет ЭхоКГ с допплерографическим анализом. При обнаружении дилатации ЛП, ФП, гипертрофии ЛЖ и нарушении потоковых характеристик через митральный клапан (МК) следует предполагать наличие диастолической дисфункции ЛЖ [114]. Повышение давления заполнения ЛЖ может быть оценено с помощью допплерографического исследования во время ЭхоКГ [115]. Однако для подтверждения диагноза ЛГ при патологии левых камер сердца необходимо определить ДЗЛА или конечное диастолическое давление (КДД) ЛЖ инвазивными методами. ДЗЛА и КДД ЛЖ могут быть псевдонормальными, особенно у пациентов, получающих терапию диуретиками. С целью выявления дисфункции ЛЖ возможно выполнение нагрузки жидкостью, однако эта методика еще требует стандартизации. Увеличенный транспульмональный градиент (среднее давление в ЛА/ДЗЛА) более 12 мм рт.ст. свидетельствует о наличии внутренних изменений в легочном кровотоке, ведущих к чрезмерному пассивному повышению ДЗЛА. В некоторых случаях крайне сложно разграничить ЛГ от ЛГ на фоне патологии левых камер сердца, особенно среди пациентов с пограничным значением ДЗЛА (15–18 мм рт.ст.). Роль, значимость и методика проведения фармакологических проб у пациентов с ЛГ на фоне патологии левых камер сердца остается неясной. Однако проведение проб рекомендуется среди пациентов — кандидатов на транс-плантацию сердца, чтобы идентифицировать больных с высоким риском развития острой недостаточности ПЖ после операции [116]. В настоящее время отсутствует соглашение о стандартизированном протоколе вазореактивного теста у пациентов с ХСН и ЛГ, поэтому используются разнообразные фармакологические препараты, включая инотропные средства, вазодилататоры, простаноиды, оксид азота, ингибиторы фосфодиэстеразы-5.
Увеличение ОЛСС > 2,5 ед. Вуда и/или транспульмонального градиента > 15 мм рт.ст. у кандидатов на трансплантацию сердца ассоциировано с троекратным повышением риска недостаточности ПЖ и ранней послеоперационной летальности [9]. Однако даже у пациентов с нормальными показателями гемодинамики малого круга кровообращения может развиться правожелудочковая острая сердечная недостаточность (СН) в раннем послеоперационном периоде, что, вероятно, свидетельствует о вовлеченности других механизмов.
Терапия
В настоящее время не существует специфической терапии для ЛГ на фоне патологии левых камер сердца. Целый спектр лекарственных средств (диуретики, нитраты, гидралазин, иАПФ, β-адреноблокаторы, несиритид и инотропные препараты) или оперативных методов (имплантация искусственного ЛЖ, оперативное вмешательство на клапанном аппарате сердца, ресинхронизирующая терапия, трансплантация сердца) могут снизить давление в ЛА достаточно быстро за счет уменьшения давления наполнения ЛЖ [117]. Таким образом, терапия ЛГ на фоне патологии левых камер сердца прежде всего подразумевает лечение основного заболевания. В перечне ЛС, используемых в терапии ХСН, отсутствуют лекарства, имеющие в противопоказаниях ЛГ. Было проведено несколько исследований, которые изучали значение применения препаратов, одобренных в настоящее время для лечения ПЛГ. Рандомизированные контролируемые клинические исследования с постоянным применением эпопростенола [118] и бозентана [119] у пациентов с тяжелой ХСН были прекращены вследствие увеличения числа событий в группах, получающих исследуемые препараты, по сравнению с пациентами, принимающими стандарт-ную терапию. Исследование с маленьким количеством пациентов предположило, что силденафил может улучшить толерантность к физической нагрузке и качество жизни у пациентов с ЛГ на фоне патологии левых камер сердца [120]. Однако история медикаментозной терапии недостаточности ЛЖ имеет множество примеров, когда лекарства имели положительный эффект на суррогатные конечные точки, но в конечном итоге причиняли вред, как, например, в случае ингибиторов фосфодиэстеразы-3. Таким образом, применение специфической терапии ЛГ не рекомендуется до тех пор, пока не будет накоплено достаточно результатов, полученных из долгосрочных исследований. Устойчивое уменьшение ЛГ развивается в течение нескольких недель у пациентов, успешно оперированных по поводу патологии МК, даже в случаях, когда ЛГ является фактором риска для оперативного лечения [6].
Легочная гипертензия при болезнях легких (группа III)
Патофизиология, гистологическая картина и эпидемиология этого состояния освещены в разделах «Патофизиология и гистология легочной гипертензии» и «Генетика и эпидемиология».
Диагностика
У пациентов с патологией легких выявление симптомов и клинических признаков ЛГ представляет достаточно сложную задачу. Так, у больных с ХОБЛ периферические отеки могут быть не только проявлением недостаточности ПЖ, но и результатом влияния гипоксемии и гиперкапнии на ренин-ангиотензин-альдостероновую систему. Более того, в повышение давления в ЛА может вносить вклад сопутствующая патология левых камер сердца, которая часто ассоциирована с хроническими респираторными заболеваниями.
Как и при других формах ЛГ, ЭхоКГ является наилучшим скрининговым методом для выявления ЛГ. Тем не менее диагностические возможности ЭхоКГ у пациентов с продвинутой фазой респираторного заболевания ниже по сравнению с больными с ПЛГ. Достоверная оценка среднего давления в ЛА возможна только в ограниченных случаях. Специфичность показателя в определении ЛГ невысокая, однако и этот уровень имеет приемлемую негативную предсказательную значимость [121, 122]. Показания для скрининговой ЭхоКГ у пациентов с ХОБЛ и интерстициальным легочным фиброзом следующие:
— диагностика ЛГ;
— диагностика сопутствующей патологии левых камер сердца;
— отбор пациентов для катетеризации правых камер сердца.
Только после получения результатов катетеризации правых камер сердца можно говорить об установленном диагнозе ЛГ. При патологии легких определены следующие показания к катетеризации правых камер сердца:
— уточнение диагноза ЛГ у пациентов — кандидатов на выполнение оперативных вмешательств (транс-плантация, уменьшение объема легких);
— подозрение на диспропорциональную ЛГ, при которой может быть назначена специфическая терапия ПЛГ;
— частые эпизоды правожелудочковой СН;
— неубедительные результаты ЭхоКГ у пациентов с высокой вероятностью ЛГ.
Терапия
В настоящее время не существует специфической терапии ЛГ, ассоциированной с ХОБЛ или интерстициальным легочным фиброзом. Длительная оксигенотерапия только частично замедляет прогрессирование ЛГ при ХОБЛ. Тем не менее на фоне терапии кислородом давление в ЛА редко снижается до нормальных значений и структурная патология сосудов легких не изменяется [123]. Применение кислородотерапии у пациентов с интерстициальным легочным фиброзом менее изучено. Лечение вазодилататорами не рекомендуется, так как применение может ухудшить газообмен вследствие ингибирования гипоксической вазоконстрикции сосудов легких [124, 125]. Кроме того, отсутствуют данные об эффективности при длительном применении [126, 127]. В настоящее время крайне мало публикаций об использовании специфической ПЛГ-терапии у пациентов с ЛГ на фоне патологии легких. В основном в литературе обсуждаются острые эффекты специфической терапии [128, 129] или результаты неконтролируемых исследований с небольшим количеством пациентов [130, 134].
У пациентов с ЛГ, ассоциированной с ХОБЛ или интерстициальным легочным фиброзом, при гипоксемии выбор терапии заключается прежде всего в длительной оксигенотерапии. Пациентам с диспропорциональной ЛГ (тяжесть проявлений не может быть объяснена только механическими нарушениями легких и повышением среднего легочного артериального давления > 40–45 мм рт.ст.) может быть назначена специфическая терапия ПЛГ. В этом случае пациент должен быть проконсультирован в специализированном центре, поскольку этим пациентам можно предложить участие в клинических исследованиях. В настоящее время применение специфической терапии у пациентов с умеренной ЛГ на фоне ХОБЛ и интерстициальным легочным фиброзом не одобряется, так как нет систематических данных о безопасности и эффективности этого лечения.
Легочная гипертензия при рецидивирующей тромбоэмболии (группа IV)
Гистология, патофизиология и эпидемиология этого состояния обсуждаются в соответствующих разделах «Гистология и патобиология легочной гипертензии» и «Генетика и эпидемиология».
Диагностика
У всех пациентов с необъяснимой ЛГ должна быть исключена хроническая тромбоэмболическая ЛГ. Особенно высокий уровень подозрения на тромбоэмболическую ЛГ у пациентов с анамнезом венозных тромбоэмболий. После острого эпизода тромбоэмболий все пациенты должны быть обследованы на предмет тромбоэмболической ЛГ. У пациентов с острой ТЭЛА признаки ЛГ или правожелудочковой СН могут появиться в любой момент во время госпитализации, поэтому всем пациентам должиа быть выполнена ЭхоКГ после выписки из стационара, чтобы определить, разрешилась ли ЛГ.
Пациентам с необъяснимой ЛГ следует выполнить перфузионную сцинтиграфию легких (рис. 5Б), чтобы исключить хроническую тромбоэмболическую ЛГ. Нормальные данные перфузионной сцинтиграфии легких исключают хроническую тромбоэмболическую ЛГ. Если данные сцинтиграфии сомнительные или обнаруживаются дефекты перфузии, показано выполнение мультиспектральной компьютерной томографии (МСКТ) (рис. 7). Несмотря на эру современных МСКТ, нет достаточно доказательств того, что нормальные результаты КТ-ангиографии ЛА исключают наличие операционной тромбоэмболической ЛГ. Как только по данным перфузионной сцинтиграфии и/или КТ-ангиографии ЛА обнаруживаются признаки, подозрительные на хроническую тромбоэмболическую ЛГ, пациент должен быть доставлен в специализированный центр с опытом медикаментозного и хирургического лечения. Чтобы выбрать оптимальную стратегию лечения, необходимо выполнить катетеризацию правых камер сердца и традиционную ангиопульмонографию (рис. 8).
Лечение
Пациенты с хронической тромбоэмболической ЛГ должны получать пожизненную терапию антикоагулянтами для приема внутрь с поддержанием целевого уровня МНО 2–3.
Тромбэндартерэктомия из ЛА является основным методом выбора лечения пациентов с хронической тромбоэмболической ЛГ. Детальный предоперационный отбор и обследование, техника хирургического лечения и опыт оператора, тщательное послеоперационное ведение пациента являются необходимыми требованиями успешной операции [33]. Отбор пациентов для оперативного лечения зависит от протяженности, локализации организованных тромбов и тяжести ЛГ. Проксимальная локализация тромбов является идеальным показанием для операции (рис. 8А), тогда как дистальные тромбозы могут отрицательно повлиять на успех лечения (рис. 8Б). Эффективное хирургическое вмешательство может привести к значительному снижению ОЛСС и практически к нормализации гемодинамики в малом круге кровообращения. Центр, проводящий тромбэндартерэктомии, может считаться экспертным в этой области, только если в нем проводится не менее 20 операций в год с летальностью < 10 %. Специфическая медикаментозная терапия может иметь смысл у пациентов с хронической тромбоэмболической ЛГ в трех случаях:
— если пациент не является кандидатом для оперативного лечения;
— если планируется, что предоперационное медикаментозное лечение улучшит гемодинамику;
— если пациенты имеют симптомы резидуальной ЛГ после эндартерэктомии из ЛА.
Несколько неконтролируемых клинических исследований предполагают, что простаноиды, антагонисты рецепторов эндотелина, ингибиторы фосфодиэстеразы-5 могут иметь положительное влияние на гемодинамику и выраженность симптомов у пациентов с хронической тромбоэмболической ЛГ вне зависимости от статуcа операбельности пациента [135–140]. Только в одном рандомизированном плацебо-контролируемом исследовании с использованием бозентана было продемонстрировано снижение ОЛСС, однако при отсутствии изменений в дистанции теста 6-минутной ходьбы, функционального класса и времени до ухудшения. С учетом этих ограниченных данных необходимо получить достоверные сведения об эффектах долгосрочной медикаментозной терапии у пациентов с хронической тромбоэмболической ЛГ. В тяжелых случаях показана трансплантация легких.
Дальнейшие перспективы
Несмотря на доступность алгоритма лечения, выработанного на основании доказательной медицины, современные терапевтические стратегии для пациентов с ЛГ остаются неадекватными, потому что уровень летальности высокий, а функциональные и гемодинамические изменения тяжелые у большинства пациентов. Был достигнут необыкновенный прогресс в медикаментозном лечении этого состояния, который все равно остается недостаточным. Необходимы дополнительные усилия для поиска новых возможностей, включая рандомизированные контролируемые исследования с исходной комбинированной терапией, новыми классами препаратов и новым дизайном, включая конечные точки смертности и заболеваемости, наблюдаемые в течение более длительных периодов. Новые классы препаратов включают ингибиторы тирозинкиназы, прямые стимуляторы гуанозинциклазы, вазоактивный интестинальный пептид, непростаноидные стимуляторы рецепторов простациклина, ингибиторы RHO-киназы, тканевый антагонист рецепторов эндотелина. В настоящее время для всех этих препаратов проведены или еще проводятся II или III фазы клинических исследований. Новые направления в лечении ЛГ связаны с развитием как генной терапии, так и регенераторной медицины. Результаты использования трансфектных генов, вовлеченных в путь оксида азота и простациклина, были успешно проверены на монокроталиновой модели ЛГ на крысах. Клеточная терапия была эффективна в модели ЛГ у животных и в настоящее время тестируется для одобрения этой концепции и подбора дозы у пациентов с ПЛГ. Положительный эффект клеточной терапии был продемонстрирован в небольшом исследовании китайских ученых. Все эти виды лечения будут доступны в ближайшие 2–5 лет.
Уровень включения в клинические исследования в течение последних лет значительно снизился по нескольким причинам, включая наличие одобренных препаратов, наблюдение и лечение пациентов в небольших центрах, не вовлеченных в клинические исследования. В связи с этим необходимо оптимизировать имеющиеся в настоящее время ресурсы, включая направление пациентов в специализированные центры, развитие международного сотрудничества и поддержку ассоциаций пациентов.
Список литературы
Список литературы находится в редакции.