Газета «Новости медицины и фармации» Гастроэнтерология (551) 2015 (тематический номер)
Вернуться к номеру
Использование количественного определения HBsAg для мониторинга естественного течения хронической HBV-инфекции
Авторы: Зайцев И.А. — Национальный медицинский университет им. А.А. Богомольца, г. Киев
Рубрики: Гастроэнтерология
Версия для печати
Статья опубликована на с. 7-14
Поверхностный антиген вируса гепатита В (HBsAg) был открыт около 50 лет назад и по-прежнему является наиболее надежным маркером инфекции, вызванной вирусом гепатита В (HBV) [1]. Значимость HBsAg заключается прежде всего в том, что он является составной частью оболочки вируса и играет ключевую роль в присоединении HBV к мембране гепатоцита, что инициирует инфекционный процесс. В нескольких исследованиях продемонстрирована значимость пептида в домене preS1 как ключевого в процессе специфического связывания с плазматической мембраной гепатоцита, а также возможность ингибирования этого процесса моноклональными антителами [2–4]. Кроме того, HBs-протеин является важным антигенным компонентом, индуцирующим защитные иммунные реакции в организме человека. Имеются данные о том, что обычный для HBV-инфекции избыток циркулирующего HBs-протеина может связывать специфические нейтрализующие антитела, предохраняя цельный вирион от иммунной атаки [5].
Для клинициста HBsAg — один из наиболее надежных маркеров HBV-инфекции. Хронологически вначале было налажено его качественное определение. Затем поиск маркеров, которые бы помогали мониторировать естественное течение заболевания, прогнозировать исходы противовирусной терапии (ПВТ), привел к открытию значимости количественного исследования HBsAg (qHBsAg).
Первоначально qHBsAg рассматривался как альтернатива определению ДНК HBV для мониторинга вирусной нагрузки. Это было связано с тем, что стоимость исследования qHBsAg была невысокой и не требовала специального и сложного оборудования, использующегося для ПЦР-анализа. В 2004 году Deguchi с соавт. впервые сообщил, что qHBsAg выше у пациентов с HBeAg-позитивным гепатитом и коррелирует с количественным содержанием ДНК вируса (r = 0,862) [6]. Серия последующих работ подтвердила наличие упомянутой закономерности [7–9], хотя некоторые авторы указали на явное несоответствие между содержанием ДНК вируса и qHBsAg у некоторых категорий больных [10, 11].
Современный интерес к qHBsAg вызван прежде всего данными о тесной связи между содержанием qHBsAg и уровнем ковалентно-замкнутой циркулярной ДНК (cccDNA), которая представляет собой матрицу для репликации вируса, хранящуюся внутри ядра гепатоцита в виде микрохромосомы [12–14]. В современном арсенале средств для лечения ХГВ отсутствуют препараты, которые бы прямо воздействовали на cccDNA, что делает невозможным эрадикацию инфекции и обусловливает ее фактически пожизненную персистенцию в организме пациента.
Непосредственное исследование содержания cccDNA в гепатоците пока недоступно в клинической практике, т.к. требует биопсии печени. Поэтому qHBsAg рассматривается, по сути, как суррогатный маркер cccDNA и важное дополнение к обследованию пациента с хронической HBV-инфекцией, но не как альтернатива измерению ДНК HBV [15]. Впервые продемонстрированная Werle-Lapostolle с соавт. связь между cccDNA, qHBsAg и количеством ДНК HBV при лечении адефовиром позволила рассматривать мониторинг qHBsAg как дополнительный маркер эффективности противовирусной терапии [12, 13, 16].
Существующие методы детекции qHBsAg (Architect QT (Abbott Laboratories) и Elecsys HBsAg II Quant (Roche Diagnostic)) основаны на использовании антител к эпитопам S-протеина и не позволяют различать вирион-ассоциированный HBsAg, субвирусные частицы и HBsAg, продуцируемый из интегрированных последовательностей. С этим связаны дискордантные результаты исследований между qHBsAg и количественным содержанием ДНК HBV, но не сссDNA в различные фазы болезни [17–19].
Получаемые при помощи Architect значения обычно несколько выше, чем при использовании Elecsys [20]. В то же время параллельные результаты использования обоих методов высоко коррелируют друг с другом (r = 0,9881; p < 0,001), за исключением тех случаев, когда в образцах содержатся YMDD мутировавшие штаммы вируса [20, 21]. Установлено, что в редких случаях (около 5 %), когда в сыворотке носителей присутствуют как HBsAg, так и anti-HBs, наличие антител не влияет на результаты количественного исследования HBsAg [22].
В настоящем обзоре речь пойдет в основном о возможности использования количественного определения HBsAg для мониторинга естественного течения заболевания. Значимости исследования qHBsAg для оценки эффективности противовирусной терапии (ПВТ) хронического гепатита В (ХГВ) был посвящен предыдущий обзор.
Использование qHBsAg для мониторинга естественного течения ХГВ
При перинатальном инфицировании обычно развивается иммунотолерантная фаза HBV-инфекции, которая продолжается, как правило, первые 20–30 лет жизни и характеризуется наличием HBeAg, высокой виремией, нормальным уровнем АЛТ, а также отсутствием или минимальными гистологическими изменениями в печени [23]. Далее следует фаза иммунного клиренса, что обычно ведет к исчезновению HBeAg и появлению антител к нему. Развивается фаза неактивного носительства вируса, или же происходит спонтанное излечение от HBV-инфекции (очень редко). Однако у некоторых больных, несмотря на сероконверсию, наблюдается пролонгация неэффективного иммунного клиренса, сопровождающаяся наличием активного воспаления, повышенным риском развития цирроза печени, высоким уровнем АЛТ и ДНК HBV (хронический активный HBeAg-негативный гепатит В). Обычно разграничение фаз заболевания на основании упомянутых критериев не представляет особых сложностей. В то же время иногда очень сложно отличить больных активным HBeAg(–) гепатитом от носителей вируса, если уровень трансаминаз в норме, а вирусная нагрузка превышает 2000 МЕ/мл. В этом случае существенным подспорьем может быть исследование qHBsAg.
HBeAg-позитивный ХГВ
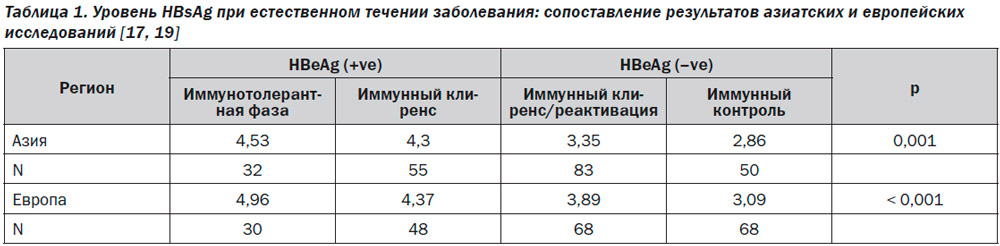
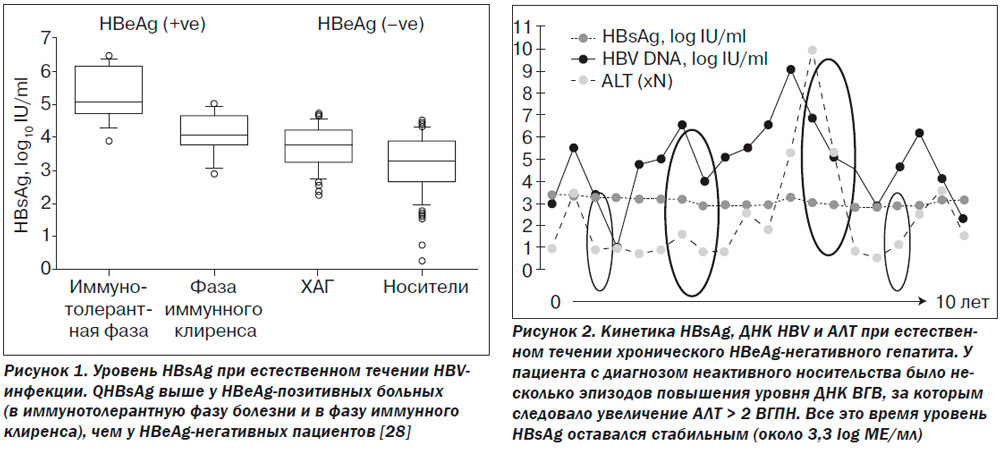
Основываясь на результатах двух перекрестных исследований, было показано, что уровень HBsAg был выше среди пациентов с иммунотолерантной фазой болезни, чем в фазе иммунного клиренса (табл. 1) [12, 17]. В одном из европейских исследований уровень HBsAg составил соответственно 4,96 log МЕ/мл и 4,37 log МЕ/мл [19], а в азиатском — 4,53 log МЕ/мл и 4,03 log МЕ/мл [17]. Одной из возможных причин более низкого уровня HBsAg в иммунотолерантную фазу в азиатском исследовании была возможность включения в исследование пациентов с АЛТ, превышающей норму менее чем в 2 раза, что не исключало наличия среди рекрутированных больных с начальной фазой иммунного клиренса. Другим объяснением может быть разница в уровне HBsAg, свойственная разным генотипам вируса. В эксперименте самая высокая экспрессия HBsAg наблюдалась при субгенотипе A2/Ae, затем — A1/Aa и B2/Ba, а самая низкая — при субгенотипах B1/Bj, С и D [24]. В исследовании, продолжавшемся 99 ± ± 16 месяцев и включавшем пациентов с ХГВ, которые не получали ПВТ, qHBsAg у больных с иммунотолерантной фазой болезни составлял приблизительно 5 log МЕ/мл и был постоянным: медиана среднегодового отклонения составила –0,006 log МЕ/мл. В фазу иммунного клиренса уровень HBsAg в среднем составлял 4 log МЕ/мл без особой разницы между больными с активным заболеванием и с развившейся HBeAg-сероконверсией. Уровень HBsAg также оставался стабильным среди HBeAg-позитивных пациентов с активным гепатитом с медианой ежегодного снижения 0,021 log МЕ/мл [25]. Отношение HBsAg к ДНК HBV, отражающее соотношение субвирусных частиц и цельных вирионов, было очень похожим среди всех НВeAg-позитивных пациентов. В различных исследованиях медиана отношения HBsAg к ДНК HBV варьировала между 0,5 и 0,6 у всех НВeAg-позитивных больных с индивидуальными различиями от 0,1 до 2,0 [17, 19, 25].
Таким образом, очень высокий уровень HBsAg (около 100 000 МЕ/мл) может быть свидетельством иммунотолерантной фазы инфекции. В фазу же иммунного клиренса qHBsAg значительно снижается (рис. 1). И если между вирусной нагрузкой и qHBsAg в иммунотолерантную фазу и в фазу иммунного клиренса существует достаточно тесная связь (r = 0,804 и r = 0,773 соответственно) [26, 27], то в низко-репликативную фазу корреляция снижается (n = 116, r = 0,289, p = 0,002) и отсутствует у пациентов с HBeAg(–) ХГВ (n = 67, r = 0,146, p = 0,237) или у больных, получающих лечение нуклеотидными аналогами (n = 267) [26]. Это позволяет использовать qHBsAg для выделения группы активных носителей вируса и позволяет отличать их от больных с HBeAg(–) ХГВ, протекающим с нормальным или пограничным уровнем трансаминаз (см. ниже).
К сожалению, нет работ, в которых было бы показано, что уровень HBsAg или соотношение HBsAg/ДНК HBV может использоваться как предиктор HBeAg-сероконверсии.
HBeAg-негативный ХГВ
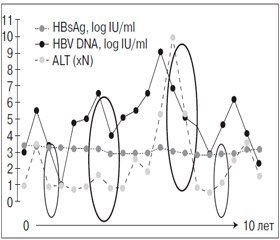
С течением времени у большинства HBV-инфицированных больных развивается фаза иммунного клиренса, что сопровождается сероконверсией — исчезновением HBeAg антигена и появлением антител к нему (anti-HBe). В связи с этим доля HBeAg-негативных больных в популяции HBV-инфицированных постоянно увеличивается [29, 30]. Уровень ДНК HBV и активность трансаминаз у этих пациентов широко варьируют [31]. У HBeAg-негативных больных с активным ХГВ вирусная нагрузка может снижаться менее 2000 МЕ/мл, что соответствует уровню носительства. При этом флуктуация уровня АЛТ наблюдается у 45–65 % больных, что может вести к ошибочной классификации пациентов как носителей или, наоборот, больных активным гепатитом (рис. 2). Поэтому регулярные исследования активности трансаминаз и вирусной нагрузки совершенно необходимы для установления правильного диагноза [32, 33]. При неактивном носительстве гистологические изменения в печени отсутствуют или соответствуют мягкому гепатиту. Прогноз же у этих пациентов благоприятный, частота цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК) низкая. Напротив, если уровень трансаминаз (активности) флуктуирует, вероятность развития ЦП велика [34, 35].
Согласно современным европейскому и североамериканскому руководствам по гепатиту В, разграничение между неактивным носительством и HBeAg-негативным ХГВ проводится с помощью определения вирусной нагрузки: ее уровень ниже 2000 МЕ/мл свидетельствует о носительстве. Тем не менее многие считают это недостаточно надежным критерием [33, 36, 37]. Основываясь на многочисленных долговременных наблюдениях, можно утверждать, что уровень HBsAg у больных с HBeAg-негативным ХГВ выше, чем у носителей: 2,98 ± 0,88 log МЕ/мл против 2,24 ± 1,61 log МЕ/мл (p = 0,054) в одном из азиатских исследований [25]. Среди 103 HBeAg-негативных больных ХГВ, находившихся под наблюдением в среднем 11 лет, уровень HBsAg в ≤ 100 МЕ/мл имел 75% чувствительность и 91% специфичность в предсказании развития спонтанного клиренса HBsAg [38]. На Тайване, где превалируют генотипы В и С, при исследовании 251 пациента установлено, что средний уровень HBsAg был выше в фазу иммунного клиренса (3,81 log МЕ/мл), значительно снижался при развитии носительства (2,25 log МЕ/мл) и повышался при реактивации инфекции (2,77 log МЕ/мл) [39]. Соотношение qHBsAg и вирусной нагрузки остается постоянным при долговременном наблюдении у носителей вируса (r = 0,509 в начале и r = 0,777 — через 5 лет исследования) [40].
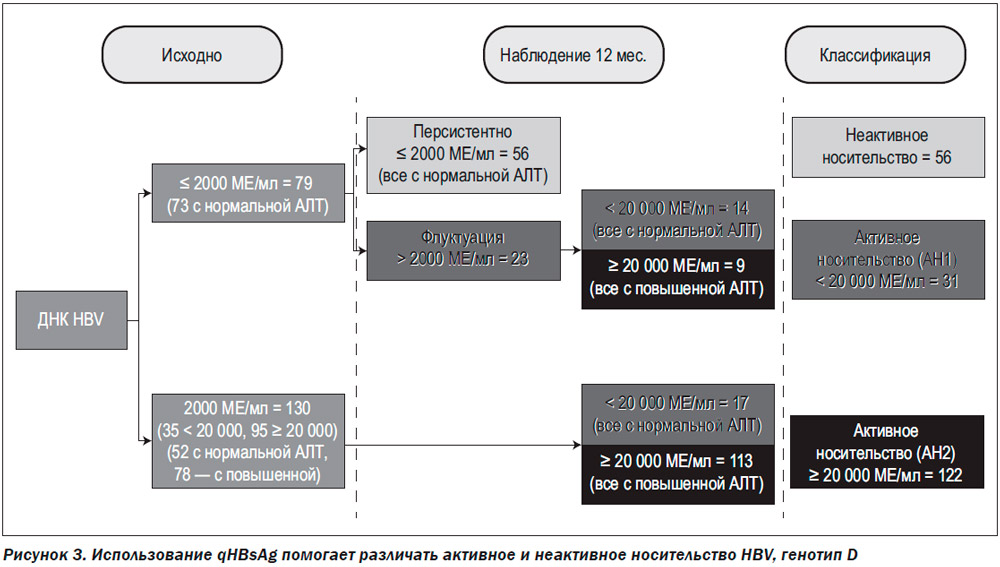
Особый интерес представляет проведенное в Италии исследование, в котором 209 пациентов, первоначально классифицированных как HBeAg-негативные носители HBV (генотип D), наблюдались в течение 34,6 месяца (от 6 до 110 месяцев). На основании ежемесячного исследования уровня ДНК HBV они были реклассифицированы как пациенты, имеющие или не имеющие активную инфекцию [41] (рис. 3).
Как следует из результатов исследования, использование вирусной нагрузки и определение активности сывороточных трансаминаз позволяют верно установить диагноз неактивного носительства у 78 % больных. В то же время больные без активного поражения печени, но с вирусной нагрузкой, превышающей 2000 МЕ/мл, и флуктуирующим уровнем АЛТ (активные носители, по определению авторов), не требующие противовирусной терапии, составляют около 13 %. И если бы решение о назначении ПВТ принималось во время первого посещения врача, им бы было назначено лечение. С другой стороны, чтобы установить истину, понадобилось наблюдение в течение 12 месяцев, что не всегда оправданно, если больной требует неотложной ПВТ. Поэтому использование дополнительных дистракторов для верного и своевременного установления диагноза было бы желательным в такой ситуации. Как показано авторами исследования, определение уровня HBsAg в этой ситуации может быть полезным для быстрого установления верного диагноза. Сопоставив результаты классификации с исходным qHBsAg, авторы нашли, что уровень HBsAg был значительно ниже при неактивном носительстве, чем при активной инфекции (62,12 против 3029 соответственно). Среди неактивных носителей qHBsAg был ниже у тех, у кого уровень ДНК был постоянно меньше 20 000 МЕ/мл, по сравнению с теми, у кого уровень ДНК флуктуировал и возрастал выше 20 000 МЕ/мл: 883 против 4233 МЕ/мл.
Таким образом, уровень qHBsAg менее 883 МЕ/мл, по мнению авторов, позволяет в трудных для диагностики случаях (вирусная нагрузка более 2000 МЕ/мл и/или флуктуирующий уровень трансаминаз) выделить группу носителей вируса, не нуждающихся в лечении.
Одним из недостатков описанного исследования было рекрутирование в него больных гепатитом В, вызванным только генотипом D, что оставляло вопрос о правомочности распространения результатов исследования на инфицированных другими генотипами открытым.
Частично этот недостаток был преодолен во французском исследовании, в которое было вовлечено 122 HBeAg-негативных больных с ХГВ (генотипы А-Е) [42]. 102 пациента первоначально были классифицированы как неактивные носители (нормальный уровень АЛТ при трех последовательных измерениях за год) и 20 были пациентами с HBeAg-негативным ХГВ. У носителей уровень qHBsAg был ниже, чем у больных активным гепатитом: 3,30 ± 0,97 log МЕ/мл против 3,77 ± 0,11 log МЕ/мл (p < 0,001).
При включении в исследование 50 из 54 (92,5 %) пациентов с HBsAg ≤ 2000 МЕ/мл и 53 из 57 (93 %) с ДНК HBV ≤ 2000 МЕ/мл были классифицированы как неактивные носители. У 32 пациентов выполнялись оба условия, и они также были классифицированы как неактивные носители (ППЗ 100 %).
Авторы делают вывод о том, что даже при однократном исследовании сочетание HBsAg < 1000 МЕ/мл и ДНК HBV < 2000 МЕ/мл идентифицирует пациента как неактивного носителя с вероятностью 86 %. А уровень HBsAg > 1000 МЕ/мл и ДНК HBV > 2000 МЕ/мл позволяет предсказать высокий риск реактивации с НПЗ 96 % и чувствительностью 92 %.
Необходимо отметить, что возможность установления верного диагноза на основании однократного определения маркеров, в том числе qHBsAg, является дискутабельной.
Во-первых, отличаются используемые граничные значения qHBsAg. Например, в турецком исследовании, продолжавшемся 3 года, было показано, что уровень HBsAg 2040 МЕ/мл является достаточным, чтобы разделить носителей и больных активным гепатитом (чувствительность 87,2 %, специфичность 75,3 %) [44]. В корейском исследовании использовались те же значения, что и во французском: уровень HBsAg < 1000 МЕ/мл и ДНК HBV < 2000 МЕ/мл позволял идентифицировать неактивного носителя с ППЗ 87,9 % и НПЗ 96,7 % [45].
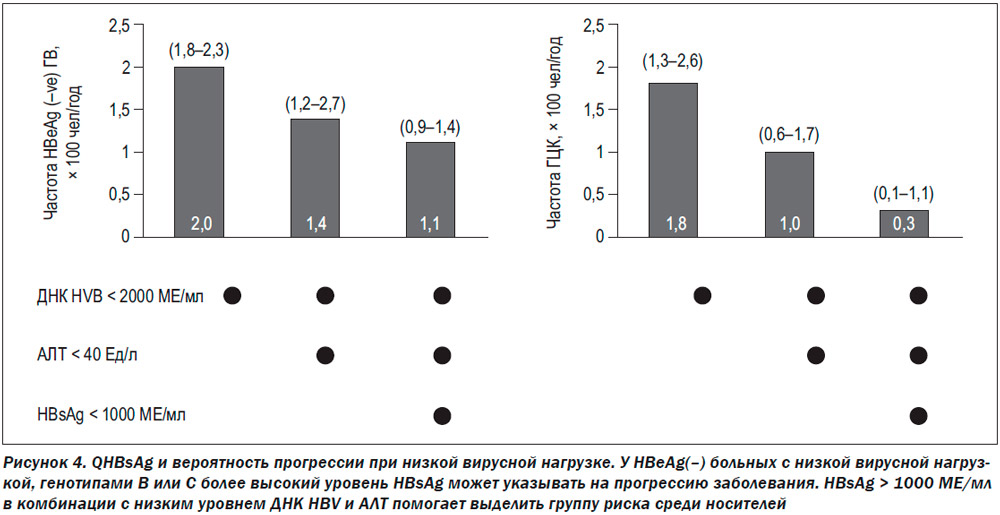
Поэтому следует считать правильным проведение исследования на qHBsAg, ДНК HBV и АЛТ в динамике. Это увеличивает точность предсказания. Например, у НВеАg(–) пациентов с вирсной нагрузкой менее 2000 МЕ/мл вероятность активного гепатита колеблется от 1,1 до 2 случаев на 100 больных в год, а ГЦК — от 0,3 до 8 на 1000 человек в год. Если в качестве 2-го необходимого критерия использовать АЛТ < 40 Ед/л, то шансы на развитие хронического гепатита у таких больных падают до 1,1–1,4/100 человек/год, а ГЦК — до 0,3–1,0/1000 человек/год. Если же использовать третий критерий — qHBsAg < 1000 МЕ/мл,то шансы на развитие хронического гепатита у таких –больных не превысят 1,1/100 человек/год, а ГЦК — 0,3/1000 человек/год [46].
Прогнозирование HBsAg-сероконверсии
Исчезновение HBsAg — наиболее желанный из возможных результатов лечения или исходов естественного течения заболевания. Частота спонтанного клиренса низкая и оценивается в среднем в менее 1 % в год, однако может быть существенно выше в группе неактивных носителей вируса (до 2,7 % в год) [47, 48]. У HBeAg(+) пациентов на возможность HBsAg-сероконверсии указывает быстрое и значимое снижение вирусной нагрузки [49]. Более точные данные могут быть получены при совместной оценке qHBsAg и содержания ДНК HBV [40]. Так, в исследовании Chen с соавт., в которое были рекрутированы пациенты с HBeAg(–) гепатитом и стойко нормальной АЛТ, уровень qHBsAg мониторировался каждые 2 года [50]. Лучшим предиктором исчезновения HBsAg был уровень qHBsAg менее 200 МЕ/мл при однократном исследовании или снижение титра HBsAg ≥ 1 log10 МЕ/мл за период наблюдения (ППЗ = 100 %). На более высокий уровень qHBsAg (менее 3,3 log10 МЕ/мл) как прогностически благоприятный указывает S. Nagaoka с соавт. [47]. Они же нашли, что снижение HBsAg примерно на 1 log10 каждые 10 лет позволяет выделить пациентов с высокой вероятностью исчезновения HBsAg. Другие авторы считают, что темп снижения должен быть более высоким (≥ 0,3 log10 каждый год). В этом случае НПЗ исчезновения HBsAg составляет 95 %, а ППЗ — 85 % [50].
В другом исследовании, включавшем 390 HBeAg-негативных пациентов, вероятность клиренса HBsAg была выше, если его уровень был от 100 до 999 МЕ/мл или < 100 МЕ/мл, c отношением шансов как 4,4 (95% доверительный интервал 1,1–17,0) и 24,3 (95% доверительный интервал 8,7–67,5) соответственно. Позитивная предсказательная значимость исчезновения HBsAg в течение 6 лет у пациентов с уровнем ДНК менее 200 МЕ/мл и qHBsAg < 100 МЕ/мл оценивалась как 45,5 %, а негативная предсказательная значимость — 98,6 %.
HBsAg и гистологические изменения в печени
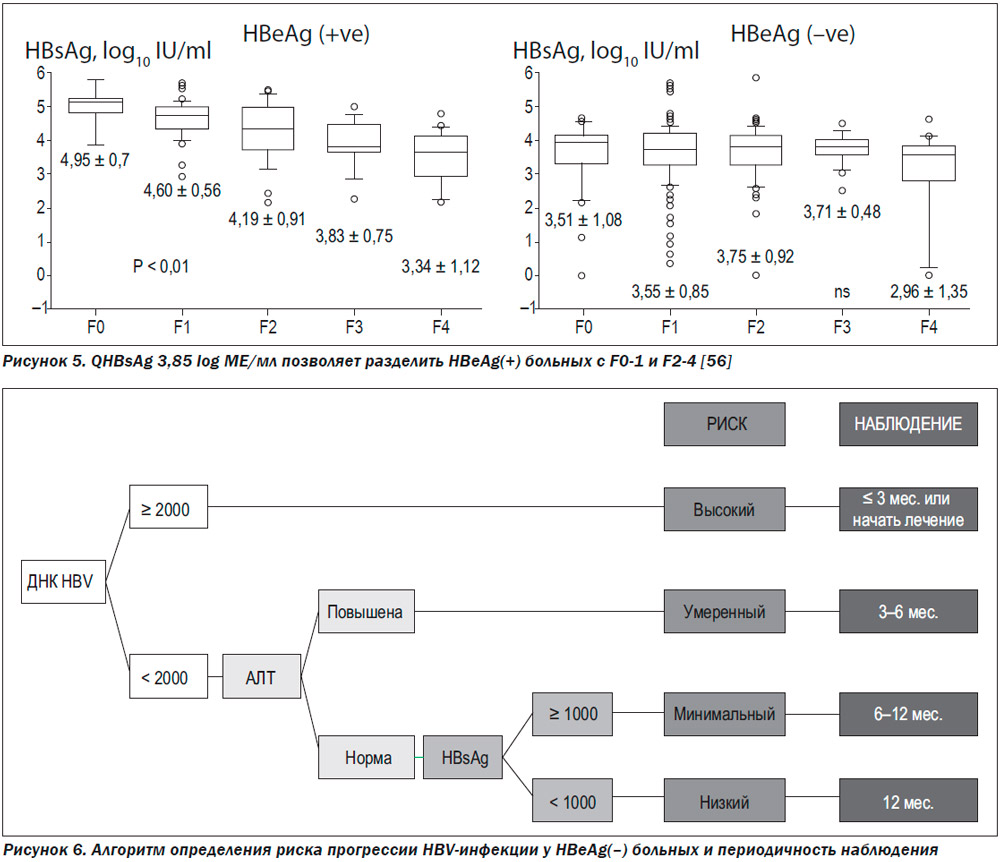
Seto с соавт. нашел связь между содержанием qHBsAg ≥ 25 000 МЕ/мл и наличием мягкого фиброза (стадия F ≤ 1) в когорте 140 азиатских больных с HBeAg-позитивным гепатитом В (без идентификации по генотипам вируса) и АЛТ менее 2 верхних границ показателя в норме [53]. Похожие результаты получены на большей выборке больных ХГВ (406 человек) с генотипами А-Е [54]. Отрицательная корреляция между уровнем HBsAg и выраженностью фиброза может служить для разграничения пациентов с мягким (F0/1 по шкале Metavir) и более тяжелым фиброзом (≥ F2) у HBeAg(+) больных (НПЗ = 91 %). Для пациентов, инфицированных генотипами В и С, такой уровень HBsAg составляет 3,85 log10 МЕ/мл (рис. 5). Самые низкие значения qHBsAg обычно выявляются у пациентов с циррозом печени (2,69 log10 IU/mL) [27]. Наличие зависимости между уровнем HBsAg и выраженностью фиброза у HBeAg-позитивных пациентов чрезвычайно важно, т.к. уровень ДНК со степенью фиброза никак не связан [55].
У HBeAg-негативных пациентов четкой связи между фиброзом и qHBsAg нет (рис. 5).
В единичных публикациях указывается на связь между уровнем HBsAg и гистологической активностью заболевания. Так, Demirren с соавт. нашли, что у детей, инфицированных HBV и не получавших терапию, уровень HBsAg тем выше, чем выше индекс гистологической активности. В то же время они не нашли связи между выраженностью фиброза и HBsAg [57]. S.B. Larsson с соавт. показали, что уровень HBsAg < 3,0 log10 МЕ/мл указывает на минимальное повреждение печени (нормальная АЛТ и мягкое воспаление) с вероятностью 92 или 96 % — в комбинации с вирусной нагрузкой менее 4 log10 копий/мл, в то время как уровень HBsAg > 3,5 log10 МЕ/мл указывает на тяжелое воспаление с вероятностью 16 или 33 % — в комбинации с ДНК HBV более 5,0 log10 копий/мл [58].
HBsAg и прогнозирование риска развития гепатоцеллюлярной карциномы
В исследовании REVEAL было продемонстрировано, что уровень ДНК HBV ≥ 2000 МЕ/мл указывает на повышенный риск развития ГЦК, в то время как риски у пациентов с ДНК HBV < 2000 МЕ/мл значительно ниже [59]. Те же авторы в той же популяции показали высокую корреляцию между уровнем HBsAg и развитием ГЦК. 20-летний кумулятивный риск ГЦК был 1,4; 4,5 и 9,2 % у пациентов с уровнем HBsAg < 100, 100–999 и ≥ 1000 МЕ/мл соответственно [60]. В исследовании ERADICATE, также проводившемся в Азии, была продемонстрирована связь между уровнем HBsAg, но не ДНК и развитием ГЦК у HBeAg(–) больных ХГВ. У пациентов с уровнем ДНК < 2000 МЕ/мл уровень qHBsAg < 1000 МЕ/мл указывает на низкий (2 %) риск развития ГЦК в течение 20 лет, в то время как при qHBsAg > 1000 МЕ/мл он составляет 8 % [61]. Связи между уровнем qHBsAg и риском развития ГЦК у пациентов с уровнем ДНК выше 2000 МЕ/мл не выявлено. Также подобной связи не выявлено и у HBeAg(+) пациентов. На основании этого был предложен алгоритм для определения риска прогрессии заболевания и соответствующего наблюдения за HBeAg(–) азиатскими пациентами (рис. 6) [62]. Безоговорочно перенести эти данные на всю популяцию больных ХГВ нельзя, т.к. в упомянутых азиатских исследованиях превалировали генотипы В и С HBV [25, 59, 60, 63].
Ближайшие перспективы
Очевидно, что использование qHBsAg, ДНК HBV и уровня сывороточных трансаминаз позволяет достаточно точно и в короткие сроки решить вопрос о наличии носительства вируса или активного гепатита у HBeAg(–) больных. Необходимы дополнительные исследования, которые бы показали выгоды от использования такого подхода для решения вопроса о необходимости проведения ПВТ.
Влияние возраста на уровень qHBsAg изучено недостаточно [63]. Очевидно, что у пациентов с тяжелым фиброзом значение показателя может быть меньше, чем у больных с мягким или умеренным фиброзом. В то же время низкая концентрация qHBsAg во многих моделях оценивается как благоприятный прогностический фактор для спонтанного выздоровления или прекращения ПВТ. Очевидно, что в этой ситуации гистологическая оценка уровня фиброза и его влияния на уровень qHBsAg является совершенно необходимой.
Развитие лабораторной техники, возможно, позволит уточнить прогностическую роль различных форм HBs-протеина для мониторинга естественного течения заболевания или эффективности ПВТ. Пока что явно недостаточно данных, чтобы определить значимость исследования qHBsAg для мониторинга пациентов, завершивших противовирусную терапию, в частности, в прогнозировании серореверсии HBeAg.
Не вызывает сомнения необходимость унификации использования qHBsAg для мониторинга естественного течения заболевания и противовирусной терапии, с закреплением рекомендаций в континентальных руководствах по HBV-инфекции.
Выводы
1. У HBeAg(+) больных:
— высокий уровень HBsAg (около 100 000 МЕ/мл) может быть свидетельством иммунотолерантной фазы инфекции;
— уровень qHBsAg > 3,85 log10 МЕ/мл указывает на отсутствие или минимальный фиброз (F0–1 по шкале METAVIR).
2. У HBeAg(–) больных уровень HBsAg менее 1000 МЕ/мл указывает:
— на неактивное носительство;
— низкий риск реактивации инфекции;
— минимальный риск развития ГЦК.
3. У HBeAg(–) больных уровень HBsAg < 100 МЕ/мл может быть предиктором спонтанного клиренса HBsAg.
Список литературы
1. Blumberg B.S., Alter H.J., Visnich S. A «new» antigen in leukemia sera // JAMA. 1965; 191: 541-6.
2. Pontisso P., Ruvoletto M.G., Gerlich W.H. et al. Identification of an attachment site for human liver plasma membranes on hepatitis B virus particles // Virology. 1989; 173: 522-530.
3. Ishikawa T., Ganem D. The pre-S domain of the large viral envelope protein determines host range in avian hepatitis B viru–ses // Proc. Natl. Acad. Sci. USA. 1995; 92: 6259-6263.
4. Hertogs K., Leenders W.P., Depla E. et al. Endonexin II, present on human liver plasma membranes, is a specific bin-ding protein of small hepatitis B virus (HBV) envelope protein // Viro–logy. 1993; 197: 549-557.
5. Ganem D. Assembly of hepadnaviral virions and subviral particles // Curr. Top Microbiol. Immunol. 1991; 168: 61-83.
6. Deguchi M., Yamashita N., Kagita M. et al. Quantitation of hepatitis B surface antigen by an automated chemiluminescent microparticle immunoassay // J. Virol. Methods. 2004; 115: 217-222.
7. Manesis E.K., Hadziyannis E.S., Angelopoulou O.P., Hadziyannis S.J. Prediction of treatment-related HBsAg loss in HBeAG-negative chronic hepatitis B: a clue from serum HBsAg levels // Antivir. Ther. 2007; 12: 73-82.
8. Moucari R., Mackiewicz V., Lada O. et al. Early serum HBsAg drop: a strong predictor of sustained virological response to pegylated interferon alfa-2a in HBeAg-negative patients // Hepatology. 2009; 49: 1151-1157.
9. Brunetto M.R., Moriconi F., Bonino F. et al. Hepatitis B virus surface antigen levels: a guide to sustained response to peginterferon alfa-2a in HBeAg-negative chronic hepatitis B // Hepatology. 2009; 49: 1141-1150.
10. Kuhns M.C., Kleinman S.H., McNamara A.L. et al. Lack of correlation between HBsAg and HBV DNA levels in blood donors who test positive for HBsAg and anti-HBc: implications for future HBV screening policy // Transfusion. 2004; 44: 1332-1339.
11. Wiegand J., Wedemeyer H., Finger A. et al. A decline in hepatitis B virus surface antigen (HBsAg) predicts clearance, but does not correlate with quantitative HBeAg or HBV DNA levels // Antivir. Ther. 2008; 13: 547-554.
12. Werle-Lapostolle B., Bowden S., Locarnini S. et al. Persistence of cccDNA during the natural history of chronic hepatitis B and decline during adefovir dipivoxil therapy // Gastroenterology. 2004; 126: 1750-1758.
13. Chan H.L., Wong V.W., Tse A.M. et al. Serum hepatitis B surface antigen quantitation can reflect hepatitis B virus in the liver and predict treatment response // Clin. Gastroenterol. Hepatol. 2007; 5: 1462-1468.
14. Tuttleman J.S., Pourcel C., Summers J. Formation of the pool of covalently closed circular viral DNA in hepadnavirusinfected cells // Cell. 1986; 47: 451-460.
15. Chevaliez S. Is HBsAg quantification ready, for prime time? // Clin. Res. Hepatol. Gastroenterol. 2013 Dec; 37 (6): 559-63.
16. Wursthorn K., Lutgehetmann M., Dandri M. et al. Peginterferon alpha-2b plus adefovir induce strong cccDNA decline and HBsAg reduction in patients with chronic hepatitis B // Hepatology. 2006; 44: 675-684.
17. Nguyen T., Thompson A.J., Bowden S. et al. Hepatitis B surface antigen levels during the natural history of chronic hepatitis B: a perspective on Asia // J. Hepatol. 2010; 52: 508-513.
18. Thompson A.J., Nguyen T., Iser D. et al. Serum hepatitis B surface antigen and hepatitis B e antigen titers: disease phase influences correlation with viral load and intrahepatic hepatitis B virus markers // Hepatology. 2010; 51: 1933-1944.
19. Jaroszewicz J., Calle Serrano B., Wursthorn K. et al. Hepatitis B surface antigen (HBsAg) levels in the natural history of hepatitis B virus (HBV)-infection: a European perspective // J. Hepatol. 2010; 52: 514-22.
20. Liu W.W., Wang A.Z., Xie F.Y. et al. Comparison between Elecsys HBsAg II and Architect assays for quantification of serum hepatitis B surface antigen in Chinese patients with chronic hepatitis B // Clin. Lab. 2015; 61(1-2): 141-7.
21. Chen L., Chao W.H., Po W.G. et al. Comparison of the Elecsys HBsAg II Assay and the Architect Assay for Quantification of Hepatitis B Surface Antigen in Chronic Hepatitis B Patients // Biomed. J. 2014 Oct 30. [Epub ahead of print]
22. Pancher M., Désiré N., Ngo Y. et al. Coexistence of circulating HBsAg and anti-HBs antibodies in chronic hepatitis B carriers is not a simple analytical artifact and does not influence HBsAg quantification // J. Clin. Virol. 2015 Jan; 62: 32-7.
23. Chan H.L., Wong G.L., Wong V.W. A review of the natural history of chronic hepatitis B in the era of transient elastography // Antivir. Ther. 2009; 14: 489-499.
24. Sugiyama M., Tasuhito T., Kato T. et al. Influence of he-patitis B virus genotypes on the intra- and extracellular expression of viral DNA and antigens // Hepatology. 2006; 44: 915-924.
25. Chan H.L., Wong V.W., Wong G.L. et al. A longitudinal study on the natural history of serum HBsAg changes in chronic hepatitis B // Hepatology. 2010; 52: 1232-1241.
26. Chung K., Kim W., Kim B. et al. Hepatitis B Surface Antigen Quantification across Different Phases of Chronic Hepatitis B Virus Infection Using an Immunoradiometric Assay // Gut and Liver, Published online February 26, 2015.
27. Zeng L., Lian J., Chen J. et al. Hepatitis B surface antigen levels during natural history of chronic hepatitis B: A Chinese perspective study // World J. Gastroenterol. 2014 July 21; 20(27): 9178-9184.
28. Martinot-Peignoux M., Lapalus M., Lada O. et al. Na-tural history of hepatitis B (HBV) infection: role of HBV genotype (A to E) assessed in a large cohort // Hepatology. 2011; 54 (Suppl.): 609A.
29. Gaeta G.B., Stornaiuolo G., Precone D.F. et al. Epidemiological and clinical burden of chronic hepatitis B virus/hepatitis C virus infection. A multicentre Italian study // J. Hepatol. 2003; 39: 1036-1041.
30. Hadziyannis S., Papatheodoridis G.V. Hepatitis B e antigen-negative chronic hepatitis: natural history and treatment // Semin Liver Dis. 2006; 26: 130-141.
31. Brunetto M.R., Oiveri F., Coco B. et al. Outcome of anti-HBe positive chronic hepatitis B in alpha-interferon and untreated patients: a long term cohort study // J. Hepatol. 2002; 36: 263-270.
32. Sung J.J., Chan H.L., Wong M.L. et al. Relationship of clinical and virological factors with hepatitis activity in hepatitis B e antigen-negative chronic hepatitis B virus-infected patients // J. Viral. Hepat. 2002; 9: 229-234.
33. Martinot-Peignoux M., Boyer N., Colombat M. et al. Serum hepatitis B virus HBV DNA levels and liver histology in inactive HBsAg carriers // J. Hepatol. 2002; 36: 543-546.
34. Papatheodoridis G.V., Manesis E.K., Manalakopoulos S. et al. Is there a meaninful serum hepatitis B virus DNA cut-off level for therapeutic decisions in hepatitis B e antigen-negative chronic hepatitis B infection? // Hepatology. 2008; 48: 1451-1459.
35. McMahon B.J. The natural history of chronic hepatitis B virus infection // Hepatology. 2009; 49: S45-S55.
36. Seo Y., Yoon S., Truong B.X. et al. Serum HBV DNA levels differentiating inactive carriers from patients with chronic hepatitis B // Eur. J. Gastroenterol. Hepatol. 2005; 17: 753-757.
37. Feld J.J., Ayers M., El-Ashry D. et al. Hepatitis B virus DNA prediction rules for Hepatitis B e antigen-negative chronic hepatitis B // Hepatology. 2007; 46: 1070-1507.
38. Chan H.L., Wong G.L., Tse C.H. et al. Viral determinants of hepatitis B surface antigen seroclearance in hepatitis B e antigen-negative chronic hepatitis B patients // J. Infect. Dis. 2011; 204: 408-414.
39. Su T.H., Hsu C.S., Chen C.L. et al. Serum hepatitis B surface antigen concentration correlates with HBV DNA level in patients with chronic hepatitis B // Antivir. Ther. 2010; 15: 1133-1139.
40. Lui J., Lee M.H., Batrla-Utermann R. et al. A predictive scoring system for the seroclearance of HBsAg in HBeAg-seronegative chronic hepatitis B patients with genotype B or C infection // J. Hepatol. 2013; 58: 845-60.
41. Brunetto M.R., Oliveri F., Colombatto P. et al. Hepatitis B surface antigen serum levels help to distinguish active from inactive hepatitis B virus genotype D carriers // Gastroentero-logy. 2010; 139: 483-490.
42. Martinot-Peignoux M., Lada O., Cardoso A.C. et al. Quantitative HBsAg: A new specific marker for the diagnosis of HBsAg inactive carriage // Hepatology. 2010; 52: 992A.
43. Martinot-Peignoux M., Lapalus M., Laouenan C. et al. How to distinguish HBeAg negative chronic hepatitis B, with high risk of reactivation, from inactive carriers: is there a place for HBsAg quantification? // Hepatology. 2012; 56 (Suppl.): 434A.
44. Yakut M., Bektas M., Seven G. et al. Characterization of the inactive HBsAg carrier state with 3 year follow-up // J. Hepatol. 2011; 54: Abstract 398.
45. Yeon J. Clinical Significance of Hepatitis B Surface Antigen Quantification in Chronic Hepatitis B // Korean J. Gastroenterol. 2014; 63: 335-340.
46. Tseng T.C., Liu C.J., Yang H.C. et al. Serum hepatitis B surface antigen levels help predict disease progression in patients with low hepatitis B virus loads // Hepatology. 2013 Feb; 57 (2): 441-50.
47. Nagaoka S., Abiru S., Komori A. et al. Hepatic flares promote rapid decline of serum hepatitis B surface antigen (HBsAg) in patients with HBsAg seroclearance: A long-term follow-up study. Hepatol Res. 2015 May 7. doi: 10.1111/hepr.12533. [Epub ahead of print]
48. Kuo Y.H., Chang K.C., Wang J.H. et al. Changing serum levels of quantitative hepatitis B surface antigen and hepatitis B virus DNA in hepatitis B virus surface antigen carriers: a follow-up study of an elderly cohort // Kaohsiung J. Med. Sci. 2015 Feb; 31(2): 102-7.
49. Lui J., Yang H.I., Lee M.H. et al. Incidence and determinants of spontaneous hepatitis B surface antigen seroclearance: a community-based follow-up study // Gastroenterology. 2012; 139: 474-82.
50. Chen Y.C., Jeng W.J., Chu C.M., Liaw Y.F. Decreasing levels of HBsAg predict HBsAg seroclearance in patients with inactive chronic hepatitis B virus infection // Clin. Gastroenterol. Hepatol. 2012; 10: 297-302.
51. Martinot-Peignoux M., Lapalus M., Laouenan C. et al. Prediction of disease reactivation in asymptomatic hepatitis B e antigen-negative chronic hepatitis B patients using baseline serum measurements of HBsAg and HBV-DNA // J. Clin. Virol. 2013; 58: 401-7.
52. Tseng T.C., Liu C.J., Su T.H. et al. Serum Hepatitis B surface antigen levels predict surface antigen loss in hepatitis B e antigen seroconverters // Gastroenterology. 2011 Aug; 141(2): 517-25.
53. Seto W.K., Wnog D.K.H., Fung J. et al. High hepatitis B surface antigen levels predict insignificant fibrosis in he-patitis B e antigen positive chronic hepatitis B // PLoS ONE. 2012; 7: e43087.
54. Martinot-Peignoux M., Carvalho R.J., Cardoso A.C. et al. Significant genotype-specific association of hepatitis B surface antigen level and severity of liver disease in patients with chronic hepatitis B // Hepatology. 2011; 54 (Suppl): 1078A.
55. Cheng P.N., Tsai H.W., Chang T.T. Serum hepatitis B surface antigen level is associated with liver fibrosis in patients with HBeAg-positive chronic hepatitis B // J. Hepatol. 2011; 54: Abstract 362.
56. Martinot-Peignoux M., Carvalho-Filho R., Lapalus M. et al. Hepatitis B surface antigen serum level is associated with fibrosis severity in treatment-nave, e antigen-positive patients // J. Hepatol. 2013 Jun; 58 (6): 1089-95.
57. Demirren К., Kocamaz Н., Doğan Y. The importance of the serum quantitative levels of hepatitis B surface antigen and hepatitis B e antigen in children with chronic hepatitis B // Turk. J. Gastroenterol. 2015; 26: 36-41.
58. Larsson S.B., Eilard A., Malmström S. et al. HBsAg quantification for identification of liver disease in chronic hepatitis B virus carriers // Liver Int. 2014 Aug; 34(7): e238-45.
59. Chen C.J., Yang H.I., Su J. et al. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level // JAMA. 2006; 295: 65-73.
60. Lee M.H., Yang H.I., Liu J. et al. Prediction model of long-term cirrhosis and hepatocellular carcinoma risk in chronic hepatitis B patients: risk score integrating host and virus profiles // Hepatology. 2013; 58: 546-54.
61. Tseng T.C., Liu C.J., Yang H.C. et al. High levels of hepatitis B surface antigen increase risk of hepatocellular carcinoma in patients with low HCV load // Gastroenterology. 2012; 142: 1140-9.
62. Tseng T.C., Liu C.J., Yang H.C. et al. Serum hepatitis B surface antigen levels help predict disease progression in patients with low hepatitis B virus load // Hepatology. 2013; 57: 441-50.
63. Jang J.W., Yoo S.H., Ho B.S. et al. Distribution patterns of serum hepatitis B surface antigen levels over the natural course of chronic hepatitis B: the role of age and immune phase // J. Hepatol. 2011; 54: Abstract 373.