Газета «Новости медицины и фармации» Неврология. Нейрохирургия. Психиатрия (549) 2015 (тематический номер)
Вернуться к номеру
Рекомендации по лечению пациентов со спонтанным внутримозговым кровоизлиянием. Рекомендации Американской кардиологической ассоциации/Американской ассоциации по изучению инсульта для специалистов сферы здравоохранения
Авторы: J. Claude Hemphill III, MD, MAS, FAHA, Chair; Steven M. Greenberg, MD, PhD, Vice-Chair;
Craig S. Anderson, MD, PhD; Kyra Becker, MD, FAHA; Bernard R. Bendok, MD, MS, FAHA;
Mary Cushman, MD, MSc, FAHA; Gordon L. Fung, MD, MPH, PhD, FAHA; Joshua N. Goldstein, MD, PhD, FAHA; R. Loch Macdonald, MD, PhD, FRCS; Pamela H. Mitchell, RN, PhD, FAHA; Phillip A. Scott, MD, FAHA; Magdy H. Selim, MD, PhD; Daniel Woo, MD, MS; от лица Совета по инсульту, Совета по уходу за пациентами с сердечно-сосудистыми заболеваниями и инсультом, а также Совета по клинической кардиологии Американской кардиологической ассоциации
Рубрики: Неврология, Психиатрия
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 47-63
Американская академия неврологии подтверждает ценность данных рекомендаций в качестве образовательного инструмента для невропатологов.
Одобрено Американской ассоциацией нейрохирургов, Американским конгрессом нейрохирургов и Международным обществом нейрореаниматологов.
Одобрено Американской ассоциацией нейрохирургов, Американским конгрессом нейрохирургов и Международным обществом нейрореаниматологов.
Спонтанное нетравматическое внутримозговое кровоизлияние (ВМК) остается значимой причиной заболеваемости и смертности по всему миру. Несмотря на то, что ВМК традиционно уступает ишемическому инсульту и аневризматическому субарахноидальному кровоизлиянию по количеству полученных в ходе клинических исследований доказательных данных в отношении лечения пациентов, в течение последнего десятилетия значительно увеличилось количество исследований вмешательств по поводу ВМК. В ходе популяционных исследований было продемонстрировано, что у большинства пациентов наблюдаются небольшие ВМК, которые при оказании должной медицинской помощи достаточно легко излечиваются, не ставя под угрозу жизнь пациента [1]. Данный факт позволяет предположить, что высокое качество медицинской помощи может оказывать потенциальное прямое влияние на связанную с ВМК заболеваемость и смертность. При разработке данных рекомендаций было поставлено несколько задач. Первой из них является обновление опубликованных в 2010 году последних рекомендаций по ВМК Американской кардиологической ассоциации/Американской ассоциации по изучению инсульта на основании результатов более новых исследований, опубликованных с того времени [2]. Другой задачей аналогичной важности является напоминание врачам о важности их участия в определении исходов ВМК, а также разработка основанного на доказательных данных алгоритма оказания помощи.
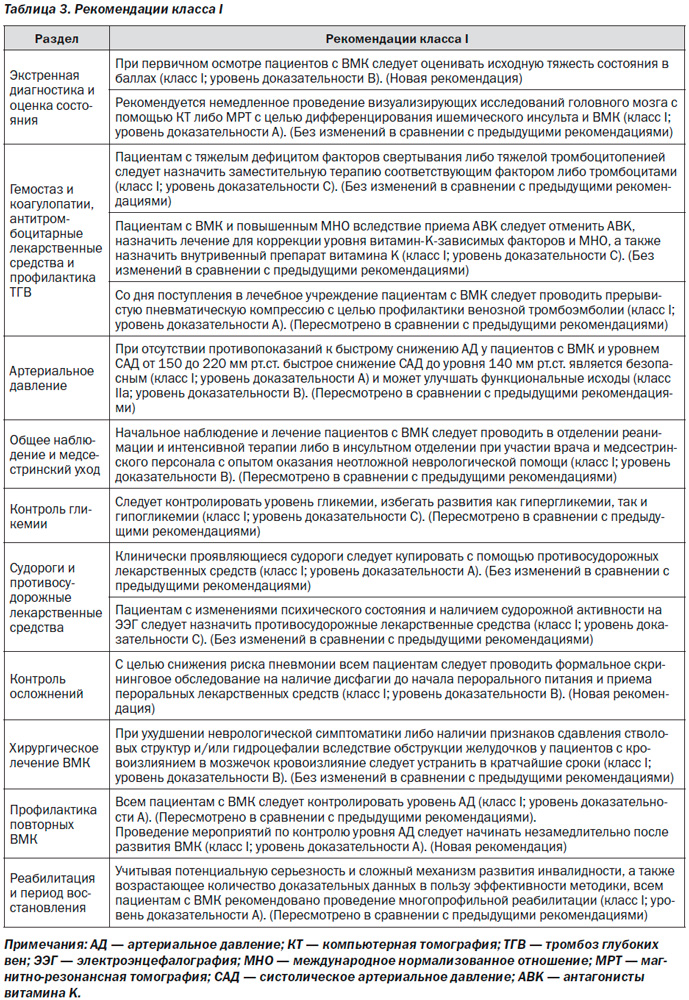
Все рекомендации класса I перечислены в табл. 3.
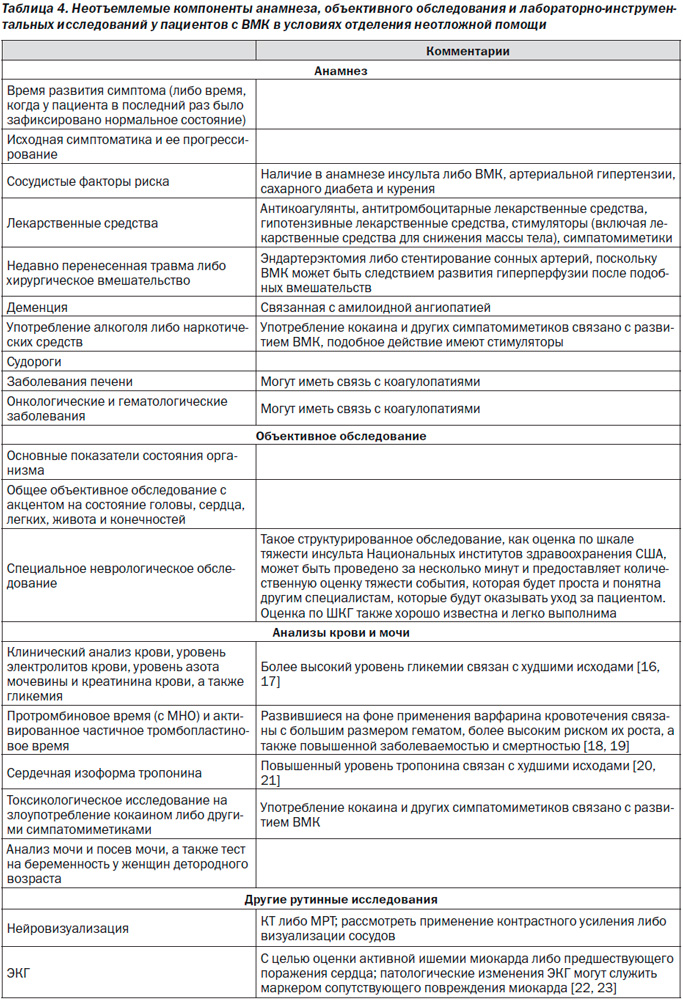
ВМК является неотложным состоянием. Быстрая диагностика наряду с тщательным наблюдением и лечением пациентов с ВМК крайне важны, поскольку часто их состояние ухудшается рано, в течение нескольких первых часов после развития ВМК. Более чем у 20 % пациентов показатель по шкале комы Глазго (ШКГ) в период между оценкой во время оказания экстренной медицинской помощи на догоспитальном этапе и первичным осмотром при поступлении в отделение неотложной помощи (ОНП) снижается на 2 балла и более [6]. Более того, еще у 15–23 % пациентов состояние продолжает ухудшаться в течение первых часов после госпитализации в лечебное учреждение [7, 8]. Риск раннего ухудшения неврологической симптоматики и высокая частота неблагоприятных долгосрочных исходов подчеркивают необходимость проведения раннего агрессивного лечения.
Визуализация головного мозга
Острое развитие очаговой неврологической симптоматики –бычно свидетельствует о сосудистой этиологии, если не доказано обратное; тем не менее, на основании исключительно клинических признаков невозможно различить патологию ишемического и геморрагического генеза. Несмотря на неспецифичность данных симптомов, в пользу ВМК свидетельствуют рвота, уровень систолического АД > 220 мм рт.ст., сильная головная боль, кома либо угнетение сознания, а также прогрессирование симптоматики в течение минут либо часов; в данной ситуации визуализация головного мозга обязательна [40]. С целью первичной оценки пациента может быть проведена как компьютерная, так и магнитно-резонансная томография. КТ имеет крайне высокую чувствительность в диагностике острых кровотечений и считается в данном отношении золотым стандартом; градиентное эхо и МРТ в режиме T2-взвешенного изображения имеют аналогичную КТ чувствительность в диагностике острых кровотечений и более высокую чувствительность в диагностике предшествующих кровоизлияний [41, 42]. Тем не менее во многих случаях проведению ургентной МРТ могут препятствовать временные рамки, стоимость, удаленность от ОНП, переносимость процедуры, клиническое состояние пациента и доступность МРТ [43].
Высокая частота раннего развития неврологического дефицита после ВМК отчасти связана с активным кровотечением, которое может продолжаться в течение нескольких часов после развития симптоматики. Как правило, гематома увеличивается в размерах сразу после развития ВМК, что повышает риск неблагоприятных функциональных исходов и смерти [7, 44–49]. У 28–38 % пациентов, которым КТ головы проводится в течение 3 часов после развития ВМК, при проведении повторных КТ исходный размер гематомы увеличивается более чем на одну треть [7, 45]. В связи с этим выявление пациентов с риском роста гематомы является активной областью исследований. Присутствие контрастного вещества внутри гематомы, часто называемое симптомом пятна, при проведении КТ-ангиографии (КТА) и КТ с контрастом указывает на высокий риск увеличения размеров ВМК [50–54]. Наличие большого количества очагов с контрастом свидетельствует в пользу еще более высокого риска роста гематомы [55, 56].
Раннее выявление лежащих в основе развития патологии сосудистых аномалий может оказывать влияние как на лечение, так и на прогноз у пациентов с ВМК. Факторами риска наличия подобных сосудистых аномалий являются возраст < 65 лет, женский пол, отсутствие приверженности к курению, лобарное ВМК, внутрижелудочковое распространение и отсутствие артериальной гипертензии либо коагулопатий в анамнезе [57, 58]. С помощью МРТ, магнитно-резонансной ангиографии, магнитно-резонансной венографии, КТА либо КТ-венографии могут быть выявлены отдельные причины развития кровоизлияния, включая артериовенозные мальформации, опухоли, болезнь –мойя-мойя и тромбоз вен головного мозга [59–61]. КТА более широко изучена и имеет высокую чувствительность и специфичность в выявлении сосудистых аномалий [58, 62–64]. При высокой клинической настороженности либо наличии при проведении неинвазивных исследований признаков патологии, лежащей в основе развившегося кровоизлияния, можно рассмотреть проведение катетерной ангиографии [65]. К рентгенологическим данным в пользу развития ВМК на фоне сосудистой аномалии может относиться наличие субарахноидального кровоизлияния, расширение сосудов либо наличие кальцинатов вдоль границы ВМК, наличие уплотненных очагов в пределах венозного синуса твердой –мозговой оболочки либо кортикальных вен вдоль предполагаемого пути венозного оттока [56], необычная форма гематомы, наличие отека, непропорционального времени предполагаемого развития ВМК, необычная локализация кровоизлияния, а также наличие других аномальных структур в мозге (например, новообразований). Пациенты с лобарными кровоизлияниями в возрасте < 55 лет и без артериальной гипертензии в анамнезе имеют более высокую вероятность выявления вторичной причины ВМК при выполнении дополнительной МРТ, помимо КТ без контраста [66]. В тех случаях, когда локализация кровоизлияния, относительный размер области отека либо патологический сигнал в области синусов мозга при проведении рутинной визуализации головного мозга позволяют заподозрить тромбоз вен головного мозга, следует провести магнитно-резонансную венографию либо КТ-венографию.
Таким образом, ВМК представляет собой неотложное медицинское состояние, требующее тщательной диагностики и лечения. В течение первых нескольких часов после его развития гематома часто увеличивается в размерах, а также возникает раннее ухудшение состояния.
Экстренная диагностика и оценка состояния: рекомендации
1. При первичном осмотре пациентов с ВМК следует оценивать исходную тяжесть состояния в баллах (класс I; уровень доказательности B). (Новая рекомендация)
2. Рекомендуется неотложное проведение визуализации головного мозга с помощью КТ либо МРТ с целью дифференцирования ишемического инсульта и ВМК (класс I; уровень доказательности A). (Без изменений в сравнении с предыдущими рекомендациями)
3. Может рассматриваться проведение КТА и КТ с контрастом для выявления пациентов с риском роста гематомы (класс IIb; уровень доказательности B); при наличии клинической либо рентгенологической настороженности КТА, КТ-венография, КТ с контрастом, МРТ с контрастом, магнитно-резонансная ангиография и магнитно-резонансная венография, а также катетерная ангиография могут быть полезными для выявления лежащих в основе развития патологии структурных нарушений, включая сосудистые мальформации и опухоли (класс IIa; уровень доказательности B). (Без изменений в сравнении с предыдущими рекомендациями)
Медикаментозное лечение ВМК
Гемостаз и коагулопатии, антитромбоцитарные лекарственные средства и профилактика тромбоза глубоких вен
Наличие сопутствующих нарушений гемостаза может вносить вклад в развитие ВМК. В группу риска входят пациенты, принимающие оральные антикоагулянты (ОАК) и антитромбоцитарные лекарственные средства, пациенты с приобретенным либо врожденным дефицитом факторов свертывания крови, а также пациенты с врожденной либо приобретенной качественной либо количественной патологией тромбоцитов. Пациенты, принимающие ОАК, составляют от 12 до 20 % всех пациентов с ВМК [67–69]; данный показатель повысился в связи с увеличением возраста популяции и более частым назначением антикоагулянтов в течение последних десятилетий [67, 70]. Наиболее часто назначаемыми ОАК являются антагонисты витамина K, такие как варфарин, однако в настоящее время все чаще начинают применяться новые препараты, которые не требуют проведения лабораторного контроля и не всегда увеличивают время свертывания крови по результатам скрининговых тестов; к данной группе препаратов относятся дабигатран [71], ривароксабан [72] и апиксабан [73]. По всей видимости, данные новые лекарственные средства связаны с более низким риском развития ВМК в сравнении с АВK [74]. Важно, чтобы медработники, оказывающие помощь пациентам с ВМК, выявляли применение антитромботических лекарственных средств либо наличие сопутствующей коагулопатии при проведении первичного –осмотра пациентов с ВМК для включения в схему лечения соответствующих мероприятий.
Пациентам с установленным дефицитом факторов свертывания крови либо патологией тромбоцитов показана заместительная терапия соответствующим фактором либо тромбоцитами, часто при участии в лечении консультанта-гематолога. При развитии спонтанного ВМК у пациента, получающего гепарин внутривенно, пациенту можно внутривенно ввести протамина сульфат в дозировке 1 мг на 100 ЕД гепарина (максимальная дозировка составляет 50 мг), также следует корректировать дозировку на основании времени, прошедшего после прекращения инфузии гепарина [75]. Аналогичные дозировки препарата могут применяться у пациентов, получающих низкомолекулярный гепарин; тем не менее ингибирование действия препарата может быть неполным [39].
ВМК, связанное с применением АВK
Существуют рекомендации по ингибированию действия ОАК [76]. Пациентам с ВМК, принимающим АВK, рекомендована неотложная коррекция величины международного нормализованного отношения [76, 77]. В течение многих лет основным методом лечения в США было введение свежезамороженной плазмы (СЗП) и витамина K, однако в последнее время в качестве возможных методов лечения было рассмотрено введение концентратов протромбинового комплекса (КПК), активированного КПК с шунтирующей активностью при наличии в организме ингибиторов фактора VIII и рекомбинантного активированного фактора VIIa (рфVIIa). Изолированное внутривенное назначение витамина K является недостаточным для ингибирования действия АВK в течение первых часов, однако введение данного препарата в дозировке от 5 до 10 мг должно быть компонентом всех схем лечения, направленных на ингибирование действия АВK; обычно витамин K вводится внутривенно медленно. При сохраненной функции печени действие препарата начинается через 2 часа после введения и достигает максимума через ≈ 24 часа [78]. Назначение СЗП требует размораживания препарата и проведения перекрестных проб на совместимость, несет риск развития аллергических и инфекционных трансфузионных реакций, также для полной коррекции МНО часто требуется введение больших объемов препарата. В одном исследовании вероятность коррекции величины МНО в течение 24 часов связывалась со временем назначения СЗП, хотя 17 % пациентов так и не достигли величины МНО < 1,4 в данной временной точке, что предполагает недостаточность подобного назначения СЗП для неотложного лечения коагулопатий [79]. Недостатки применения СЗП привели к поиску альтернативных препаратов для ингибирования действия АВK.
КПК представляют собой полученные из плазмы крови концентраты факторов свертывания, изначально разработанные для лечения дефицита фактора IX (гемофилия B). Трехкомпонентные КПК содержат факторы II, IX и X; четырехкомпонентные КПК дополнительно содержат фактор VII. Назначение КПК не требует проведения перекрестных проб на совместимость, КПК может быть незамедлительно разведен и введен в небольшом объеме (20–40 мл), также препарат проходит обработку с целью инактивации инфекционных возбудителей. В ходе нескольких исследований было продемонстрировано, что применение КПК приводит к быстрой нормализации МНО (в течение минут) у пациентов, принимающих АВK [80–82]. Несмотря на то, что в ходе нерандомизированных ретроспективных обзоров и небольшого исследования «случай — контроль» была продемонстрирована более быстрая нормализация МНО при применении витамина K и КПК в сравнении с применением витамина K и СЗП, ни одна из работ четко не продемонстрировала улучшения клинических исходов у пациентов при применении КПК [83–85]. В одном рандомизированном исследовании проводилось сравнение применения КПК (конайн) в сочетании с СЗП и изолированного применения СЗП у пациентов с ВМК на фоне приема АВK; при назначении исключительно СЗП пациентам требовалось введение больших объемов препарата, также в данном случае развивалось больше нежелательных явлений, прежде всего связанных с гиперволемией [86]. При применении КПК может повышаться риск развития тромботических осложнений, хотя в целом данный риск не является высоким [80]. В 2013 году в ходе первого крупного рандомизированного контролируемого клинического исследования фазы III была продемонстрирована не меньшая эффективность 4-компонент-ного КПК в сравнении с СЗП в отношении ургентного ингибирования действия варфарина в когорте из 202 пациентов с острым кровотечением (у 24 из которых развилось внутричерепное кровоизлияние) [87]. В данном исследовании частота достижения величины МНО < 1,3 в течение 30 минут после завершения введения препарата составила 62,2 % при применении КПК и 9,6 % — при применении СЗП. Частота тромбоэмболических явлений была одинаковой в обеих группах (7,8 % при применении КПК и 6,4 % при применении СЗП), перегрузка жидкостью чаще развивалась при применении СЗП (12,8 % против 4,9 %). Аналогичные рандомизированные исследования для прямого сравнения 3- и 4-компонентных КПК не проводились. Кроме того, не установлено особое целевое значение МНО для ингибирования действия АВK при ВМК, развившемся на фоне приема ОАК; в ходе различных исследований, в том числе и цитируемых в данной работе, использовались целевые значения в диапазоне от < 1,3 до < 1,5 [88].
РфVIIa, одобренный для лечения пациентов с гемофилией и высокими титрами ингибиторов фактора VII либо врожденным дефицитом фактора VII, привлекает внимание в качестве потенциального препарата для лечения спонтанных и связанных с применением ОАК ВМК. Несмотря на то, что рфVIIa может в кратчайшие сроки нормализовать МНО при ВМК, развившихся на фоне приема АВK [89–93], данный препарат не восполняет дефицит всех витамин-K-зависимых факторов и не может восстанавливать синтез тромбина столь же эффективно, как и КПК [94]. Таким образом, в настоящее время не рекомендовано рутинное применение рфVIIa с целью ингибирования действия варфарина [95].
ВМК на фоне приема новых антикоагулянтов
Данные рандомизированных исследований лекарственных средств для ингибирования более новых антикоагулянтов у пациентов с ВМК либо другими серьезными осложнениями, связанными с развитием кровотечений, отсутствуют; поскольку данные лекарственные средства применяются в течение лишь нескольких лет, практические данные в отношении их ингибирующей активности ограничены. Применяемые в настоящее время в США лекарственные средства (дабигатран, ривароксабан и апиксабан) имеют относительно короткие периоды полураспада в диапазоне от 5 до 15 часов. С целью обеспечения индивидуального подхода к лечению следует определять активированное частичное тромбопластиновое время и протромбиновое время, а также консультировать пациентов у гематолога. Могут быть рассмотрены потенциальные способы ингибирования действия антикоагулянтов с помощью FEIBA (factor VIII inhibitor bypassing activity), других КПК либо рфVIIa. Целесообразность применения СЗП остается неясной, препараты витамина K не применяются. Было выдвинуто предположение о том, что назначение FEIBA либо рфVIIa предпочтительнее в случае применения прямого ингибитора тромбина дабигатрана, в то время как назначение других КПК может быть более эффективным в случае применения ингибиторов факто-
ра Xa ривароксабана и апиксабана [96–99], однако указанные данные являются предварительными. В случаях, когда последняя доза дабигатрана, апиксабана либо ривароксабана была принята в течение двух предшествующих часов, может применяться активированный уголь [100]. При применении дабигатрана вариантом лечения является проведение гемодиализа, однако данная методика не эффективна при применении ривароксабана либо апиксабана, поскольку последние в значительной степени связываются с белками крови [90]. Специфические антидоты для данных лекарственных средств находятся на ранней стадии клинической разработки [101].
ВМК на фоне приема антитромбоцитарных лекарственных средств
В ходе исследований влияния предшествующего приема антитромбоцитарных лекарственных средств либо патологии тромбоцитов на прогрессирование ВМК и его исходы были получены противоречивые результаты. Установленный прием антитромбоцитарных лекарственных средств не имел связи с ростом гематомы либо клиническими исходами в группе приема плацебо в ходе исследования нейропротекции при ВМК [102]. В ходе других исследований было выдвинуто предположение о том, что дисфункция тромбоцитов, выявленная по результатам функционального анализа тромбоцитов, может иметь связь с ростом гематомы и клиническими исходами [103, 104]. Мониторинг функции тромбоцитов может быть полезным для оценки действия антитромбоцитарных лекарственных средств и определения гемостатических вмешательств, однако данный подход не был изучен в полной мере. В ходе исследования серии случаев из 45 пациентов с ВМК, которым по усмотрению лечащего врача было проведено переливание тромбоцитарной массы, было продемонстрировано улучшение реактивности тромбоцитов после проведения трансфузии; реактивность тромбоцитов определялась при помощи системы VerifyNow-ASA [105]. В ходе подгруппового анализа пациентов из группы высокого риска роста гематомы было выдвинуто предположение о том, что переливание тромбоцитарной массы в течение 12 часов после развития симптоматики было связано с лучшими окончательными исходами кровотечения и способностью к самообслуживанию по прошествии 3 месяцев. В настоящее время продолжаются два контролируемых рандомизированных клинических исследования, оценивающих эффективность переливания тромбоцитарной массы у пациентов с ВМК, принимающих антитромбоцитарные лекарственные средства [106, 107].
Применение рфVIIa при ВМК, не связанных с приемом антикоагулянтов
Также изучалось применение рфVIIa при ВМК, не связанных с приемом ОАК. Несмотря на то, что в ходе рандомизированного клинического исследования фазы II было продемонстрировано ограничение роста гематомы и улучшение клинических исходов при применении рфVIIa в течение 4 часов после развития ВМК в сравнении с плацебо, в ходе последующего исследования фазы III клинической пользы выявлено не было [108, 109]. Применение рфVIIa было связано с повышенной частотой тромбоэмболических явлений в сравнении с плацебо (7 % против 2 %) в исследовании фазы II и достоверно большим числом артериальных явлений в исследовании фазы III. В будущем необходимо установить возможную пользу применения рфVIIa у данной подгруппы пациентов с ВМК, однако в настоящий момент его польза у пациентов с ВМК как на фоне приема ОАК, так и без такового остается недоказанной.
Профилактика тромбоза у пациентов с ВМК
Пациенты с ВМК имеют высокий риск тромбоэмболической патологии [110]. Более высокому риску подвержены женщины и темнокожие пациенты [110–112]. В рандомизированном клиническом исследовании, включившем 151 пациента с ВМК, проведение прерывистой пневматической компрессии в сочетании с использованием эластичных чулок снижало частоту развития бессимптомного тромбоза глубоких вен (ТГВ) после ВМК в сравнении с изолированным использованием эластичных чулок (4,7 % против 15,9 %) [113]. Исследования CLOTS (Clots in Legs Оr sTockings аfter Stroke — тромбы вен нижних конечностей или использование чулок после перенесенного инсульта) включали 3 различных рандомизированных исследования (CLOTS 1, 2 и 3), в ходе которых оценивались различные подходы к лечению, включая сравнение использования компрессионных чулок с сегментами разной степени плотности и компрессионных гольфов, а также сравнение проведения прерывистой пневматической компрессии с отсутствием таковой [114–117]. В ходе исследования CLOTS 1, включившего 2518 пациентов с инсультом (232 из которых имели ВМК), было выявлено, что использование компрессионных чулок не приводило к снижению частоты развития ТГВ, эмболии легочной артерии (ЭЛА) либо смерти [115]. В ходе исследования CLOTS 2 было выявлено, что ТГВ чаще развивался у пациентов, использовавших компрессионные гольфы с сегментами разной степени плотности, в сравнении с пациентами, использовавшими компрессионные чулки с сегментами разной степени плотности [114]. Наконец, в ходе исследования CLOTS 3, включившего 2876 пациентов (376 из которых имели ВМК), было выявлено, что раннее начало проведения прерывистой пневматической компрессии со дня поступления пациента в лечебное учреждение приводило к снижению частоты развития проксимального ТГВ; данное влияние было особенно выраженным у пациентов с геморрагическим инсультом (6,7 % против 17,0 %, отношение шансов (ОШ) 0,36; 95% доверительный интервал (ДИ) 0,17–0,75) [116]. В ходе метаанализа профилактики тромбоза при помощи антикоагулянтов, включившего 1000 пациентов с ВМК из 4 исследований (2 из которых были рандомизированными) и оценивавшего раннее применение эноксапарина либо гепарина (в течение от 1 до 6 дней после поступления пациента в лечебное учреждение), было выявлено снижение частоты развития ЭЛА (1,7 % против 2,9 %; относительный риск (ОР) 0,37; 95% ДИ 0,17–0,80) и незначимое снижение смертности (16,1 % против 20,9 %; ОР 0,76; 95% ДИ 0,57–1,03), однако различия в частоте развития ТГВ (4,2 % против 3,3 %; ОР 0,77; 95% ДИ 0,44–1,34) либо увеличении размеров гематомы (8,0 % против 4,0 %; ОР 1,42; 95% ДИ 0,57–3,53) отсутствовали [118].
У пациентов с ТГВ либо ЭЛА на фоне ВМК может быть рассмотрено проведение системной антикоагулянтной терапии либо имплантации фильтра в нижнюю полую вену (НПВ). Учитывая общую частоту рецидивов нефатальной ЭЛА при отсутствии лечения от 12 до 15 % (включая не только пациентов с ВМК), не рекомендуется ограничиваться исключительно наблюдением. Доступна лишь крайне ограниченная информация в отношении принятия решения о постановке фильтра в НПВ в сравнении с проведением антикоагулянтной терапии, а также в отношении выбора оптимальной схемы антикоагуляции [119]. Во внимание принимаются такие факторы, как длительность периода между развитием кровотечения и выявлением ТГВ/ЭЛА, регистрация стабильного размера гематомы при проведении визуализации головного мозга, наличие лобарной в сравнении с глубоко расположенной гематомой, а также практическая возможность удаления фильтра из НПВ в последующем. Общие рекомендации по применению фильтров для НПВ в случае острого ТГВ предполагают традиционное применение антикоагулянтов в случае исчезновения риска кровотечений; тем не менее приведенные данные не специфичны для пациентов с ВМК [120].
Гемостаз и коагулопатии, антитромбоцитарные лекарственные средства и профилактика ТГВ: рекомендации
1. Пациентам с тяжелым дефицитом факторов свертывания либо тяжелой тромбоцитопенией следует назначать заместительную терапию соответствующим фактором либо тромбоцитами (класс I; уровень доказательности C). (Без изменений в сравнении с предыдущими рекомендациями)
2. Пациентам с ВМК и повышенным МНО вследствие приема АВK следует отменить АВK, назначить лечение для коррекции уровня витамин K-зависимых факторов и МНО, а также назначить внутривенный препарат витамина K (класс I; уровень доказательности C). При назначении КПК возможно более редкое развитие осложнений и более быстрая коррекция величины МНО в сравнении с применением СЗП; применение КПК может быть предпочтительнее в сравнении с применением СЗП (класс IIb; уровень доказательности B). Применение рфVIIa не восполняет дефицит всех факторов свертывания; несмотря на то, что МНО может снижаться, свертывание крови in vivo может быть не восстановлено в полной мере; таким образом, применение рфVIIa не рекомендовано для ингибирования действия АВK при развитии ВМК (класс III; уровень доказательности C). (Пересмотрено в сравнении с предыдущими рекомендациями)
3. У пациентов с ВМК, принимающих дабигатран, риваро-ксабан либо апиксабан, в индивидуальном порядке может быть рассмотрено назначение FEIBA, других КПК либо рфVIIa. В тех случаях, когда последняя доза дабигатрана, апиксабана либо ривароксабана была принята в течение < 2 последних часов, может применяться активированный уголь. При применении дабигатрана может быть рассмотрен гемодиализ (класс IIb; уровень доказательности C). (Новая рекомендация)
4. С целью ингибирования действия гепарина у пациентов с острым ВМК может быть рассмотрено применение протамина сульфата (класс IIb; уровень доказательности C). (Новая рекомендация)
5. Польза переливания тромбоцитарной массы пациентам с ВМК при наличии приема антитромбоцитарных препаратов в анамнезене установлена (класс IIb; уровень доказательности C). (Пересмотрено в сравнении с предыдущими рекомендациями)
6. Несмотря на то, что применение рфVIIa может приводить к ограничению роста гематомы у пациентов с ВМК при отсутствии сопутствующей коагулопатии, применение данного препарата повышает риск развития тромбоэмболических осложнений; также отсутствует четкая клиническая польза применения рфVIIa у случайно выбранных пациентов. Таким образом, применение рфVIIa не рекомендовано (класс III; уровень доказательности A). (Без изменений в сравнении с предыдущими рекомендациями)
7. Со дня поступления в лечебное учреждение пациентам с ВМК следует проводить прерывистую пневматическую компрессию с целью профилактики венозной тромбоэмболии (класс I; уровень доказательности A). Использование компрессионных чулок с сегментами разной степени плотности не приводит к снижению частоты развития ТГВ либо улучшению исходов (класс III; уровень доказательности A). (Пересмотрено в сравнении с предыдущими рекомендациями)
8. После подтверждения прекращения кровотечения у пациентов с ограничением подвижности по прошествии 1–4 дней после развития ВМК может быть рассмотрено подкожное назначение низких дозировок низкомолекулярного либо нефракционированного гепарина с целью профилактики венозного тромбоза (класс IIb; уровень доказательности B). (Без изменений в сравнении с предыдущими рекомендациями)
9. Проведение системной антикоагулянтной терапии либо имплантации фильтра в НПВ, вероятно, показано пациентам с ВМК и клинически проявляющимися ТГВ либо ЭЛА (класс IIa; уровень доказательности C). При выборе между данными двумя вмешательствами следует принимать во внимание несколько факторов, включая промежуток времени после развития кровотечения, стабильность гематомы, причину кровотечения и общее состояние пациента (класс IIa; уровень доказательности C). (Новая рекомендация)
Уровень АД и исходы при ВМК
Повышенный уровень АД часто сопровождает развитие острого ВМК [121, 122] в силу различных факторов, включающих стрессовое состояние, болевой синдром, повышенное внутричерепное давление (ВЧД) и преморбидное острое либо хроническое повышение уровня АД. Высокий уровень САД связан с распространением гематомы на большую площадь, ухудшением неврологической симптоматики, смертельным исходом и отсутствием способности к самообслуживанию после развития ВМК [122–124]. В сравнении с ишемическим инсультом, при котором была продемонстрирована стойкая U- либо J-образная связь между наиболее низким уровнем САД в 140 и 150 мм рт.ст. и неблагоприятными исходами [125], наличие неблагоприятных исходов при низких уровнях САД (< 140 мм рт.ст.) было продемонстрировано лишь в одном исследовании ВМК [126].
Артериальное давление: рекомендации
1. При отсутствии противопоказаний к быстрому снижению АД у пациентов с ВМК и уровнем САД от 150 до 220 мм рт.ст. быстрое снижение САД до уровня 140 мм рт.ст. является безопасным (класс I; уровень доказательности A) и может улучшать функциональные исходы (класс IIa; уровень доказательности B). (Пересмотрено в сравнении с предыдущими рекомендациями)
2. У пациентов с ВМК и уровнем САД > 220 мм рт.ст. может быть целесообразным рассмотрение агрессивного снижения уровня АД с помощью непрерывной внутривенной инфузии препаратов и частого контроля уровня АД (класс IIb; уровень доказательности C). (Новая рекомендация)
Общее наблюдение и медсестринский уход: рекомендация
1. Начальное наблюдение и лечение пациентов с ВМК следует проводить в отделении реанимации и интенсивной терапии либо в инсультном отделении при участии врача и медсестринского персонала с опытом оказания неотложной неврологической помощи (класс I; уровень доказательности B). (Пересмотрено в сравнении с предыдущими рекомендациями)
Контроль гликемии: рекомендация
1. Следует контролировать уровень гликемии, избегать развития как гипергликемии, так и гипогликемии (класс I; уровень доказательности C). (Пересмотрено в сравнении с предыдущими рекомендациями)
Контроль температуры тела: рекомендация
1. Лечение развившейся после ВМК лихорадки может быть целесообразным (класс IIb; уровень доказательности C). (Новая рекомендация)
Судороги и противосудорожные лекарственные средства: рекомендации
1. Клинически проявляющиеся судороги следует купировать противосудорожными лекарственными средствами (класс I; уровень доказательности A). (Без изменений в сравнении с предыдущими рекомендациями)
2. Пациентам с изменениями психического состояния и наличием судорожной активности на ЭЭГ следует назначить противосудорожные лекарственные средства (класс I; уровень доказательности C). (Без изменений в сравнении с предыдущими рекомендациями)
3. Непрерывный мониторинг ЭЭГ, вероятно, показан пациентам с ВМК при угнетении сознания, непропорциональной степени поражения головного мозга (класс IIa; уровень доказательности C). (Пересмотрено в сравнении с предыдущими рекомендациями)
4. Профилактическое применение противосудорожных лекарственных средств не рекомендовано (класс III; уровень доказательности B). (Без изменений в сравнении с предыдущими рекомендациями)
Контроль осложнений: рекомендации
1. С целью снижения риска пневмонии всем пациентам следует проводить формальное скрининговое обследование на наличие дисфагии до начала перорального питания и приема лекарственных средств (класс I; уровень доказательности B). (Новая рекомендация)
2. Является целесообразным проведение систематического скрининга на наличие ишемии миокарда либо инфаркта миокарда после перенесенного ВМК при помощи электрокардио-графии и анализов на кардиоспецифические ферменты (класс IIa; уровень доказательности C). (Новая рекомендация)
Мониторинг и контроль ВЧД: рекомендации
1. Является целесообразным дренирование желудочков с целью лечения гидроцефалии, особенно у пациентов со сниженным уровнем сознания (класс IIa; уровень доказательности B). (Пересмотрено в сравнении с предыдущими рекомендациями)
2. Необходимость мониторинга и контроля ВЧД может быть рассмотрена у пациентов с баллом по ШКГ ≤ 8, клиническими признаками транстенториального вклинения головного мозга, серьезным внутрижелудочковым кровоизлиянием (ВЖК) либо гидроцефалией. Может быть целесообразным поддержание церебрального перфузионного давления (ЦПД) на уровне 50–70 мм рт.ст. в зависимости от состояния ауторегуляции головного мозга (класс IIb; уровень доказательности C). (Без изменений в сравнении с предыдущими рекомендациями)
3. Глюкокортикостероиды не следует применять для контроля повышенного ВЧД у пациентов с ВМК (класс III; уровень доказательности B). (Новая рекомендация)
ВЖК: рекомендации
1. Несмотря на то, что внутрижелудочковое введение рекомбинантного тканевого активатора плазминогена (ртАП) при ВМК характеризуется объективно низкой частотой развития осложнений, эффективность и безопасность данного способа лечения не установлены (класс IIb; уровень доказательности B). (Пересмотрено в сравнении с предыдущими рекомендациями)
2. Эффективность эндоскопического лечения ВМК не установлена (класс IIb; уровень доказательности B). (Новая рекомендация)
Хирургическое лечение ВМК: рекомендации
1. При ухудшении неврологической симптоматики либо наличии признаков сдавления стволовых структур и/или гидроцефалии вследствие обструкции желудочков у пациентов с кровоизлиянием в мозжечок кровоизлияние следует устранить в кратчайшие сроки (класс I; уровень доказательности B). При лечении данной группы пациентов рекомендуется отдавать преимущество не дренированию желудочков, а хирургическому устранению очага кровоизлияний (класс III; уровень доказательности C). (Без изменений в сравнении с предыдущими рекомендациями)
2. Для большинства пациентов с супратенториальным ВМК польза хирургического вмешательства должным образом не установлена (класс IIb; уровень доказательности A). (Пересмотрено в сравнении с предыдущими рекомендациями) Особые исключения и возможные варианты в подгруппах изложены ниже в рекомендациях 3–6.
3. Тактика раннего удаления гематомы не имеет явных преимуществ в сравнении с тактикой удаления гематомы при ухудшении состояния пациентов (класс IIb; уровень доказательности A). (Новая рекомендация)
4. Удаление супратенториальной гематомы у пациентов с ухудшением может рассматриваться в качестве жизнесохраняющего вмешательства (класс IIb; уровень доказательности C). (Новая рекомендация)
5. Проведение декомпрессионной трепанации черепа (ДТЧ) с удалением гематомы либо без такового может снизить смертность среди пациентов с супратенториальными ВМК при развитии коматозного состояния, наличии гематом большого размера со значительным срединным смещением либо рефрактерном к лекарственным средствам повышении ВЧД (класс IIb; уровень доказательности C). (Новая рекомендация)
6. Эффективность малоинвазивного удаления тромбов с помощью стереотаксической либо эндоскопической аспирации с применением тромболитиков либо без такового не установлена (класс IIb; уровень доказательности B). (Пересмотрено в сравнении с предыдущими рекомендациями)
Прогнозирование исходов и прекращение аппаратной поддержки: рекомендация
1. Вероятно, можно рекомендовать раннее агрессивное лечение после развития ВМК и отсрочку выполнения новых протоколов DNAR (do-not-attempt-resuscitation, отказ от реанимационных мероприятий) как минимум до окончания второго полного дня с момента госпитализации (класс IIa; уровень доказательности B). В данную рекомендацию не включаются пациенты с ранее подписанными протоколами DNAR. В существующие в настоящее время прогностические модели для пациентов в раннем периоде после ВМК вносится систематическая ошибка оценки в связи с невозможностью оценить влияние прекращения аппаратной поддержки и выполнения ранних протоколов DNAR. Статус протокола DNAR не должен ограничивать проведение соответствующих медикаментозных либо хирургических вмешательств при отсутствии иных однозначных показаний (класс III; уровень доказательности C). (Пересмотрено в сравнении с предыдущими рекомендациями)
Факторы риска
Важными факторами риска рецидива ВМК являются артериальная гипертензия, пожилой возраст и локализация первичного кровоизлияния (лобарное либо глубоко расположенное) [269, 271]. Повышенное АД связано с повышением частоты рецидивирования как глубоко расположенных, так и лобарных кровоизлияний [271]. У пожилых пациентов повышенный риск связан с более высокой распространенностью церебральной амилоидной ангиопатии (ЦАА) и более частым приемом антитромботических лекарственных средств, приводящим к увеличению числа сопутствующих патологий [272]. ЦАА является общепризнанным фактором риска рецидивирования ВМК, особенно лобарной локализации [271]. Носители аллелей ε2 либо ε4 аполипопротеина E [273], пациенты с наличием ВМК в анамнезе [274], а также пациенты с множественными микрокровотечениями (особенно с микрокровотечениями в лобарных областях головного мозга) на МРТ-изображениях, полученных с помощью последовательности градиентного эхо, очевидно, имеют более высокий риск развития рецидива ВМК [272, 275]. У белокожих пациентов чаще встречается лобарная локализация к ак первичных, так и рецидивных кровоизлияний; для азиатов более характерно развитие глубоко расположенных кровоизлияний (как первичных, так и рецидивных) [269, 276]. Также в роли предиктора рецидива ВМК может выступать наличие в анамнезе ишемического инсульта, особенно лакунарного инсульта вследствие поражения мелких сосудов, который имеет общий с ВМК патогенез [277, 278].
Профилактика повторных ВМК: рекомендации
1. В тех случаях, когда оценка риска развития рецидива ВМК у пациента может влиять на выбор схемы лечения, целесообразно учитывать следующие факторы риска развития рецидива ВМК: 1) лобарная локализация первичного ВМК; 2) пожилой возраст; 3) наличие и количество микрокровотечений на МРТ-изображениях, полученных с помощью последовательности градиентного эхо; 4) продолжающийся прием антикоагулянтов; 5) наличие аллелей ε2 либо ε4 аполипопротеина E (класс IIa; уровень доказательности B). (Пересмотрено в сравнении с предыдущими рекомендациями)
2. Всем пациентам с ВМК следует контролировать уровень АД (класс I; уровень доказательности A). (Пересмотрено в сравнении с предыдущими рекомендациями). Проведение мероприятий по контролю уровня АД следует начинать незамедлительно после развития ВМК (класс I; уровень доказательности A). (Новая рекомендация). Целесообразным является установление долго-срочного целевого уровня АД < 130 мм рт.ст. для систолического и 80 мм рт.ст. для диастолического (класс IIa; уровень доказательности B). (Новая рекомендация)
3. Вероятно, эффективны модификация образа жизни, включая исключение употребления алкоголя свыше 2 порций в сутки, курения табака и приема запрещенных наркотиков, а также лечение синдрома обструктивного апноэ сна (класс IIa; уровень доказательности B). (Пересмотрено в сравнении с предыдущими рекомендациями)
4. В связи с относительно высоким риском развития рецидива, вероятно, рекомендовано исключение долгосрочного назначения варфарина в качестве лечебного средства при неклапанной фибрилляции предсердий после развития спонтанного лобарного ВМК на фоне приема варфарина (класс IIa; уровень доказательности B). (Без изменений в сравнении с предыдущими рекомендациями)
5. Может быть рассмотрено применение антикоагулянтов после развития нелобарного ВМК и монотерапия антитромбоцитарными лекарственными средствами после развития ВМК любой локализации, особенно при наличии серьезных показаний к назначению данных лекарственных средств (класс IIb; уровень доказательности B). (Пересмотрено в сравнении с предыдущими рекомендациями)
6. Оптимальный период возобновления приема оральных антикоагулянтов после развития ВМК на фоне их применения не установлен. Исключение приема оральных антикоагулянтов в течение как минимум 4 недель при отсутствии у пациентов искусственных клапанов сердца может снижать риск развития рецидива ВМК (класс IIb; уровень доказательности B). (Новая рекомендация). При наличии показаний возможно возобновление монотерапии аспирином через несколько дней после развития ВМК, хотя оптимальный промежуток времени не установлен (класс IIa; уровень доказательности B). (Новая рекомендация)
7. Польза применения дабигатрана, ривароксабана либо апиксабана с целью снижения риска развития рецидива ВМК у пациентов с фибрилляцией предсердий и ВМК в анамнезе не установлена (класс IIb; уровень доказательности C). (Новая рекомендация)
8. Данных для рекомендации в пользу ограничения приема статинов у пациентов с ВМК недостаточно (класс IIb; уровень доказательности C). (Без изменений в сравнении с предыдущими рекомендациями)
Реабилитация и период восстановления: рекомендации
1. Учитывая потенциальную серьезность и сложный механизм развития инвалидности, а также возрастающее количество доказательных данных в пользу эффективности методики, всем пациентам с ВМК рекомендовано проведение многопрофильной реабилитации (класс I; уровень доказательности A). (Пересмотрено в сравнении с предыдущими рекомендациями)
2. При возможности реабилитационные мероприятия следует начинать как можно раньше и продолжать в общественно-социальной обстановке в качестве компонента согласованной непрерывной программы, включающей ускоренную выписку из лечебного учреждения и возвращение в домашние условия с целью способствования непрерывному восстановлению (класс IIa; уровень доказательности B). (Без изменений в сравнении с предыдущими рекомендациями)
Печатается в сокращении