Резюме
У статті повідомляється про результати ендопротезування колінного суглоба при пухлинах кісток у 72 пацієнтів. У 43 пацієнтів під час ендопротезування застосована трубка з поліетилентерефталату для ізоляції ендопротеза та підшивання до неї резеційованих м’язів та сухожилків. У 28 пацієнтів при ендопротезуванні колінного суглоба виникла необхідність у формуванні адекватного м’язового футляра для укриття ендопротеза, що вимагало проведення додаткового пластичного етапу операції. Як пластичний матеріал застосовано м’язовий клапоть, сформований із медіальної частини литкового м’яза, та м’язовий клапоть, сформований із медіальної частини широкого м’яза стегна. Частка інфекційних ускладнень після ендопротезування колінного суглоба становила 18,06 %. У групі з 43 пацієнтів, у яких застосовувалася трубка з поліетилентерефталату, при ендопротезуванні колінного суглоба інфекційні ускладнення спостерігалися у 4 пацієнтів, а в групі з 28 пацієнтів, яким виконано пластичний етап операції, інфекційні ускладнення відзначені в 1 пацієнта. Отже, застосування пластичного етапу операції при дефіциті м’яких тканин та трубки з поліетилентерефталату для ізоляції ендопротеза дозволило розширити показання до ендопротезування колінного суглоба при пухлинах кісток та знизити кількість інфекційних ускладнень у ложі ендопротеза після ендопротезування.
В статье сообщается о результатах эндопротезирования коленного сустава при опухолях костей у 72 пациентов. У 43 пациентов после эндопротезирования использована трубка из полиэтилентерефталата для изоляции эндопротеза и подшивания к ней резецированных мышц и сухожилий для более полного восстановления функции коленного сустава. У 28 пациентов при эндопротезировании коленного сустава возникла необходимость в формировании адекватного мышечного футляра для укрытия эндопротеза, что требовало проведения дополнительного пластического этапа операции. В качестве пластического материала использован мышечный лоскут, сформированный из медиальной части икроножной мышцы, и мышечный лоскут, сформированный из медиальной части широкой мышцы бедра. Доля инфекционных осложнений после эндопротезирования коленного сустава составила 18,06 %. В группе из 43 пациентов, у которых применялась трубка из полиэтилентерефталата, при эндопротезировании коленного сустава инфекционные осложнения наблюдались у 4 пациентов, а в группе из 28 пациентов, которым выполнен пластический этап операции, инфекционные осложнения отмечены у 1 пациента. Таким образом, использование пластического этапа операции при дефиците мягких тканей и трубки из полиэтилентерефталата для изоляции эндопротеза позволило расширить показания к проведению эндопротезирования коленного сустава при опухолях костей и снизить количество инфекционных осложнений в ложе эндопротеза после эндопротезирования.
The article reported the results of knee replacement at bone tumors in 72 patients. In 43 patients, during arthroplasty we have used polyethylene teraphthalate tube to isolate the implant and to suture resected muscles and tendons to it. In 28 patients with knee replacement, it became necessary to form proper muscle sheath to cover the implant, which required an additional plastic stage of surgery. As a plastic material, we have used muscle flap formed from medial gastrocnemius muscle and muscle flap formed from vastus medialis. Proportion of infectious complications after knee replacement was 18.06 %. In the group of 43 patients, in which we have used polyethylene teraphthalate tube, during knee replacement, infectious complications were observed in 4 patients, and in the group of 28 patients, who completed the plastic stage of the surgery, infectious complications were detected in 1 patient. Consequently, the use of plastic stage of the surgery in soft tissues deficiency and of polyethylene teraphthalate tube to isolate the implant made it possible to expand indications for knee replacement in bone tumors and to reduce the number of infectious complications in implant bed after arthroplasty.
Статтю опубліковано на с. 59-64
Вступ
Захворюваність на первинні злоякісні пухлини кісток становить у середньому в чоловіків 1,5, у жінок — 0,9 на 100 000 населення. Частіше за все вони виникають у дітей та осіб молодого віку. Пік захворюваності кістковими новоутвореннями припадає на соціально значимий вік: при остеосаркомі, злоякісній фіброзній гістіоцитомії й саркомі Юїнга — 10–25 років, при хондросаркомі — 35–40 років [2, 4, 7]. Ці захворювання характеризуються агресивністю клінічного перебігу та високою схильністю до метастазування. Метастатичне ураження довгих кісток зустрічається в 2–4 рази частіше, ніж первинні пухлини, і найчастіше діагностується при раку молочної залози — у 65–75 %, раку простати — у 56–68 % і раку легені — у 30–36 % пацієнтів [1, 6]. На сьогодні світовий стандарт лікування цих хворих — комбінований або комплексний підхід, одним з етапів якого є хірургічне лікування. За даними літератури, 90 % пацієнтів зі злоякісними пухлинами довгих кісток виконується органозберігаюче хірургічне лікування в обсязі сегментарної резекції з ендопротезуванням [5]. За даними ряду авторів, ендопротезування покращує функціональні та психологічні результати протипухлинного лікування й не впливає на прогноз захворювання [2, 14]. Одним із протипоказань при ендопротезуванні є неможливість адекватного формування м’язового футляра імплантата, оскільки це збільшує ризик інфекційних ускладнень і тим самим погіршує функціональні результати [12]. Неправильний вибір місця біопсії або порушення техніки її виконання, виражений м’якотканинний компонент пухлини або анатомічна особливість ділянки ендопротезування не дозволяють адекватно сформувати м’язове ложе для укриття ендопротеза [3]. Це ставить під загрозу адекватний локальний контроль пухлини, обмежує вибір способу м’язової пластики й підвищує ризик інфекційних ускладнень та відторгнення ендопротеза [2, 5]. Для вирішення цієї проблеми, за даними різних авторів, необхідно проведення пластичного етапу, що дозволяє адекватно укрити встановлений ендопротез і тим самим зменшити ризик розвитку інфекційних ускладнень [8, 10, 13]. Такі втручання можуть бути особливо актуальними для пацієнтів, первинно прооперованих з приводу пухлинних уражень кісток [12]. Як пластичний матеріал можуть застосовуватись як переміщені, так і вільні васкуляризовані клапті на мікросудинних анастомозах [3]. Серед всіляких способів хірургічних реконструкцій при дефектах навколосуглобових м’яких тканин у хворих з пухлинами кісток протягом усього періоду існування цієї проблеми провідні позиції займала і продовжує займати невільна пластика клаптями литкового м’яза, поверхня яких укривається вільними шкірними автотрансплантатами [8, 9]. При цьому частота збереження ендопротезів залишається досить високою й досягає 80–92 % [11]. Розробка нового протипухлинного й супутнього лікування, а також вдосконалення техніки встановлення та дизайну ендопротезів, розробка пластичних етапів операцій на м’яких тканинах дозволили на сьогодні розширити показання до ендопротезування й отримати добрі ортопедичні та онкологічні результати.
Матеріали та методи
У клінічному відділі ДУ «Інститут травматології та ортопедії НАМН України» з 2009 по 2015 рік ендопротезування колінного суглоба виконано 72 пацієнтам з пухлинами дистального відділу стегнової кістки й проксимального відділу великогомілкової кістки. Чоловіків було 40, жінок — 32, вік хворих варіював від 15 до 76 років (у середньому становив 26,90 ± 1,25 року). Розподіл кількості хворих за гістологічними формами пухлин подано в табл. 1.
За локалізацією пухлини в кістках, що формують колінний суглоб, розподіл пацієнтів був таким (табл. 2).
Передопераційне обстеження включало клініко-рентгенологічне обстеження (зокрема, при необхідності, виконували комп’ютерну томографію (КТ), магнітно-резонансну томографію (МРТ)), обов’язково проводилась трепан- або відкрита біопсія ураженого сегмента кістки з метою верифікації процесу, а також розрахунок протяжності резекції сегмента кістки та розмірів ендопротеза за даними рентгенографії, КТ або МРТ ураженої кістки.
У 17 (23,61 %) хворих до операції відзначався патологічний перелом кістки на тлі пухлинного ураження, що значною мірою ускладнювало перед–операційне обстеження та створювало додаткові технічні складності під час операції та при подальшій реабілітації. 10 (13,89 %) пацієнтам до операції ендопротезування колінного суглоба за місцем проживання були виконані різноманітні хірургічні втручання (кістково-пластичні операції з використанням авто- та алотрансплантатів, керамічного матеріалу на основі гідроксіапатиту та трикальційфосфату, матеріалу на основі біоактивного скла — біокомпозиту, різні види металоостеосинтезу), що теж мало значення при розвитку післяопераційних ускладнень. 37 (51,39 %) хворим у передопераційному та післяопераційному періоді були проведені курси внутрішньоартеріальної або внутрішньовенної поліхіміотерапії. 7 (9,72 %) пацієнтам у передопераційному періоді проведено курс променевої терапії до сумарної осередкової дози 40 Грей, що також відігравало роль у розвитку післяопераційних ускладнень.
За весь час роботи ми імплантували 72 ендопротези колінного суглоба, з них конструкції НВО «Інмед» (Україна) — 41, фірми «Страйкер» (США) — 22 і фірми «Вальдемар Лінк» (Німеччина) — 9.
У 27 (37,5 %) пацієнтів після резекції проксимального відділу великогомілкової кістки з пухлиною та ендопротезування колінного суглоба виникла необхідність у формуванні адекватного м’язового футляра для укриття ендопротеза, що вимагало проведення додаткового пластичного етапу операції. Як пластичний матеріал у 27 (37,5 %) хворих застосований м’язовий клапоть, сформований з медіальної частини литкового м’яза. У 1 (1,39 %) хворого після резекції дистального відділу стегнової кістки з пухлиною використаний м’язовий клапоть, сформований з медіальної частини широкого м’яза стегна. У 43 (59,7 %) пацієнтів з метою обмеження контакту металевої частини ендопротеза з прилеглими тканинами та реконструкції сухожильно-зв’язкового апарату ми застосовували трубку з поліетилентерефталату фірми Implantcast (Німеччина). До неї підшивалися резецийовані м’язи та сухожилки, що дозволяло більш повно відновити функцію суглоба.
Результати функціональної активності прооперованого відділу скелета визначалися нами за шкалою МSTS. Для визначення якості життя хворих після резекції суглобового сегмента кістки з пухлиною та ендопротезування колінного суглоба ми використовували опитувальник EORTC QLQ-C30, у якому якість життя визначалася в балах. Виживаність хворих аналізували за методом Каплана — Мейєра.
Отримані результати
Термін спостереження становив від 6 до 82 місяців (у середньому 40,4 місяця). Кількість ускладнень після ендопротезування колінного суглоба залежно від локалізації пухлинного процесу в кістці подано в табл. 3.
/61.jpg)
Як видно з табл. 3, із 72 прооперованих хворих ускладнення спостерігалися у 33 пацієнтів, що становило 45,83 %. Інфекційні ускладнення спостерігалися в 13 (18,06 %) пацієнтів, асептичне розхитування ніжки ендопротеза — у 12 (16,67 %), перелом кістки в місці імплантації ніжки ендопротеза — у 5 (6,94 %), перелом конструкції ендопротеза — у 3 (4,17 %). У групі із 45 хворих при локалізації пухлини в дистальному відділі стегнової кістки ускладнення після ендопротезування колінного суглоба спостерігалися у 22 хворих: асептичне розхитування стегнової ніжки ендопротеза — 10, інфекційні ускладнення — 8, перелом конструкції ендопротеза — 2, перелом стегнової кістки — 2. Рецидиви пухлини після ендопротезування колінного суглоба при локалізації пухлини в дистальному відділі стегнової кістки виявлено в 4 пацієнтів. Метастази в легені — 8. Померло в процесі лікування 4 хворих за рахунок метастазів у легені. У групі із 27 хворих з локалізацією пухлини в проксимальному відділі великогомілкової кістки ускладнення після ендопротезування спостерігалися в 11 хворих: інфекційні ускладнення — 5, перелом великогомілкової кістки — 3, асептичне розхитування великогомілкової ніжки ендопротеза — 2, перелом конструкції ендопротеза — 1. Рецидиви пухлини при локалізації пухлини в проксимальному відділі великогомілкової кістки виявлено у 1 пацієнта. Метастази в легені — 2. Померло в процесі лікування 2 хворих за рахунок метастазів у легені.
При асептичному розхитуванні ніжки ендопротеза у 12 випадках виконано реендопротезування суглоба. При інфекційних ускладненнях у 13 випадках проведено тривалий курс антибіотикотерапії, у 10 хворих вдалося купірувати інфекційні ускладнення, у 2 випадках виконано видалення ендопротеза й встановлено металоцементний спейсер з подальшим реендопротезуванням, в 1 випадку купірувати інфекційне ускладнення не вдалося, тому хворому виконана ампутація на рівні середньої третини стегна.
При парапротезному переломі кістки у 5 випадках виконано металоостеосинтез за допомогою накісткових пластин та серкляжів; при переломі конструкції ендопротеза в 3 випадках виконано реендопротезування колінного суглоба.
З 43 пацієнтів, яким застосовувалася трубка з поліетилентерефталату, при ендопротезуванні колінного суглоба інфекційні ускладнення відзначені в 4 (9,3 %) пацієнтів, тоді як у групі з 29 пацієнтів, яким не застосовувалася трубка з поліетилентерефталату, інфекційні ускладнення відзначені в 9 (31 %) хворих. Отже, на нашу думку, застосування трубки з поліетилентерефталату, що обмежує контакт металевої частини ендопротеза з прилеглими м’якими тканинами та запобігає розвитку металозу в прилеглих до ендопротеза м’яких тканинах, дозволяє мінімізувати інфекційні ускладнення. У групі з 28 пацієнтів, яким виконано пластичний етап операції, інфекційні ускладнення відзначені в 1 (3,5 %) пацієнта, рецидив пухлини був у 1 (3,5 %) пацієнта. Серед решти 44 прооперованих пацієнтів інфекційні ускладнення відзначені в 12 (27,27 %) пацієнтів та рецидиви пухлини — у 4 (9,1 %) пацієнтів.
На рис. 1 та 2 відображено хід операції ендопротезування колінного суглоба при локалізації хондросаркоми в проксимальному відділі великогомілкової кістки та укриття ендопротеза за рахунок переміщення медіальної частини musculus hastroсnemius.
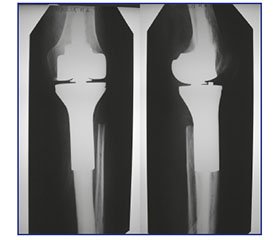
Результати ендопротезування колінного суглоба при локалізації пухлини в проксимальному відділі великогомілкової кістки відображено на рис. 3, 4.
Функціональний результат кінцівки після ендопротезування колінного суглоба за шкалою MSTS у середньому становив: після резекції дистального відділу стегнової кістки та ендопротезування колінного суглоба — 84,4 %, після резекції проксимального відділу великогомілкової кістки — 79,2 %.
Функціональний результат кінцівки в групі пацієнтів, яким виконувався пластичний етап операції після резекції дистального відділу стегнової кістки та ендопротезування колінного суглоба, становив 82,2 %, після резекції проксимального відділу великогомілкової кістки — 78,6 %. Як бачимо, суттєвих розбіжностей за функціональним результатом в групах хворих, у яких виконувався і не виконувався пластичний етап операції, не відзначалося.
Якість життя пацієнтів після ендопротезування колінного суглоба (опитувальник EORTC QLQ-C30) поліпшилася з 40 до 80 балів. Загальна трирічна виживаність пацієнтів становила 80,60 ± 0,18 %, п’ятирічна — 74,4 ± 0,2 %.
Отже, незалежно від гістологічної форми пухлини кістки, що утворює колінний суглоб, коли є показання до його ендопротезування, саме стан навколосуглобових покривних тканин та м’яких тканин, що глибоко залягають, виявляється тим чинником, що майже повністю визначає успіх, а іноді й саму можливість проведення цієї операції. У цілому отримані нами результати вказують на те, що в пацієнтів, які потребують ендопротезування колінного суглоба, застосування пластичних методик при дефіциті м’яких тканин сприяє зменшенню кількості післяопераційних ускладнень і рецидивів пухлини.
Висновки
1. Застосування пластичного етапу операції при дефіциті м’яких тканин і трубки з поліетилентерефталату для ізоляції ендопротеза при ендопротезуванні колінного суглоба з приводу пухлин кісток дозволило знизити кількість інфекційних ускладнень у ложі ендопротеза.
2. Пластичні методики при дефіциті м’яких тканин дозволили розширити показання до проведення ендопротезування колінного суглоба при пухлинах кісток, знизити частоту рецидивів пухлин, що дозволило покращити якість життя пацієнтів.
Список литературы
1. Алиев М.Д. Эндопротезирование как основа онкоортопедии / М.Д. Алиев // Поволжский онкологический весник — 2012. — № 2. — С. 14-20.
2. Амирасланов А.О. Эндопротезирование крупных костей и суставов у онкологических больных: Автореф. дис. … д-ра мед. наук. — М., 2007.
3. Кутянов Д.И. Эволюция «проблемы мягких тканей» при эндопротезировании коленного сустава и роль технологий реконструктивно-пластической микрохирургии в ее решении / Д.И. Кутянов, Л.А. Родоманова // Травматология и ортопедия России. — 2014. — № 1 (71). — С. 114-121.
4. Соловьев Ю.Н. Опухоли костей: классификация, номенклатура, проблемы диагностики / Ю.Н. Соловьев // Архив патологии. — 2003. — № 5. — С. 3-6.
5. Тепляков В.В. Эндопротезирование длинных костей и суставов при дефиците мягких тканей / В.В. Тепляков, В.Ю. Карпенко, А.М. Шаталов // Саркомы костей, мягких тканей и опухоли кожи. — 2011. — № 3. — С. 16-22.
6. Тепляков В.В. Хирургическое лечение больных с метастатическими поражениями длинных костей / В.В. Тепляков, В.Ю. Карпенко, М.Д. Алиев // Вестник травматологии и ортопедии им. Н.Н. Пирогова. — 2007. — № 4. — С. 73-77.
7. Dennis A. Manual of clinical oncology. — 5th ed. Philadelphia: Lippincott Williams & Wilkins, 2004. — P. 510-527.
8. Garbedian S. Wound healing problems in total knee arthroplasty / S. Garbedian, А. Sternheim, D. Backstein // Orthopedics. — 2011. — Vol. 34(9). — P. 516- 518.
9. Gastrocnemius muscle flap coverage of exposed or infected knee prostheses / M. Gerwin, K.O. Rothaus, R.E. Windsor [et al.] // Clin. Orthop. Relat. Res. — 1993. — Vol. 286 — P. 64-70.
10. Operative managementand outcome of complex wounds following total knee arthroplasty / M.Y. Nahabedian, M.A. Mont, J.C. Orlando [et al.] // Plast. Reconstr. Surg. — 1999. — Vol. 104(6). — P. 1688-1697.
11. Papp A. Pedicled gastrocnemius flap in complicated total knee arthroplasty / A. Papp, J. Kettunen, H. Miettinen // Scand. J. Surg. — 2003. — Vol. 92(2). — P. 156-159.
12. Qadir I. Functional outcome of limb salvage surgery with mega-endoprosthetic reconstruction for bone tumors / I. Qadir, M. Umer, N. Baloch // Arch. Orthop. Trauma Surg. — 2012. — Vol. 132(9). — P. 1227-1232.
13. Reconstruction of soft tissue defects following total knee arthroplasty / A. Menderes, C. Demirdover, M. Yilmaz [et al.] // Knee. — 2002. — Vol. 9(3). — P. 215-219.
14. Survivorship and clinical аutcome of modular endoprosthetic reconstruction for neoplastic disease of the lower limb / E.R. Ahlmann, L.R. Menendez, С. Kermani [et al.] // J. Bone Joint Surg. Br. — 2006. — Vol. 88(6). — P. 790-795.
/61.jpg)

/60.jpg)
/61_2.jpg)
/62.jpg)