Журнал «Травма» Том 16, №6, 2015
Вернуться к номеру
Применение плазмы, обогащенной тромбоцитами, в лечении повреждений мягких и костных тканей (обзор литературы)
Авторы: Климовицкий В.Г., Соловьев И.А. - НИИ травматологии и ортопедии Донецкого национального медицинского университета им. М. Горького
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Проведен анализ литературы, изучавшей влияние отцентрифугированной плазмы крови (PRP) с заданной концентрацией тромбоцитов на регуляцию регенерации поврежденных тканей, которые запускают и регулируют каскад процессов, направленных на миграцию, дифференциацию, пролиферацию клеток. Обобщающим выводом все авторы считали то, что PRP является важным звеном комплексного лечения, воздействующим на процессы регенерации и способствующим ускорению заживления повреждений мягких и костных тканей. Как эндогенное вещество она нивелирует риск побочных эффектов и позволяет снизить количество неудовлетворительных результатов и сократить сроки лечения.
Проведений аналіз літератури, що вивчала вплив відцентрифугованої плазми крові (PRP) із заданою концентрацією тромбоцитів на регуляцію регенерації пошкоджених тканин, які застосовують і регулюють каскад процесів, що спрямовані на міграцію, диференціацію, проліферацію клітин. Узагальнюючим висновком усі автори вважали те, що PRP є важливою ланкою комплексного лікування, яка впливає на процеси регенерації та сприяє прискоренню загоєння ушкоджень м’яких і кісткових тканин. Як ендогенна речовина вона нівелює ризик побічних ефектів і дозволяє знизити кількість незадовільних результатів і скоротити терміни лікування.
There has been carried out the analysis of the literature on the effect of the platelet-rich plasma (PRP) with a predetermined concentration of platelets on the regulation of regeneration of damaged tissues, which trigger and regulate the cascade of processes aimed at the migration, differentiation, cell proliferation. All the authors considers as a generalization the fact that PRP is an important part of comprehensive treatment influencing the processes of regeneration and promoting the acceleration of the healing of soft and bone tissue injuries. As an endogenous substance, it eliminates the risk of side effects, and can reduce the number of unsatisfactory results and the time of treatment.
Статья опубликована на с. 77-80
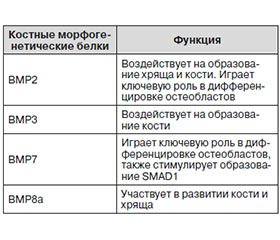
C развитием современных технологий и науки стало возможным определить базовые закономерности развития как самого организма, так и многих процессов, протекающих в нем. С учетом наличия знаний о физиологических и патофизиологических процессах наука продвигается по пути изучения их моделирования.
/78_2.jpg)
1. Первый клинический опыт применения обогащенного тромбоцитами фибринового геля / Калашников А.В., Зубенко А.Г., Руденко И.А., Ренев К.В., Руденко Р.И. // Травма: научно-практический журнал. — 2011. — Т. 12, № 3. — С. 137-140.
2. Применение обогащенной тромбоцитами плазмы в купировании болевого синдрома большого вертела / А.С. Башкина, Л.Ю. Широкова, Т.С. Князева, О.М. Паруля, Е.Б. Абросимова, С.М. Носков // Травматология и ортопедия России. — 2011. — № 60. — С. 57-61.
3. Сочетанное применение обогащенной тромбоцитами аутоплазмы и биокомпозиционного материала коллапан в комплексном лечении больных с длительно несрастающимися переломами и ложными суставами длинных костей конечностей / Г.А. Кесян, Г.Н. Берченко, Р.З. Уразгильдеев, Д.С. Микелаишвили, Б.Н. Шулашов // Вестник травматологии и ортопедии им. Н.Н. Приорова. — 2011. — № 2. — С. 26-32.
4. Сочетанное использование остеопластики и обогащенной тромбоцитами плазмы в травматологии и ортопедии (обзор литературы) / И.А. Кирилова, Н.Г. Фомичев, В.Т. Подорожная, Ю.В. Этитейн // Травматология и ортопедия России. — 2008. — № 3(49). — С. 63-67.
5. Страфун С.С. Застосування факторів росту у хворих із застарілими пошкодженнями ротаторної манжети плеча / С.С. Страфун, А.Я. Вовченко, І.В. Гайович // Травма: научно-практический журнал. — 2011. — Т. 12, № 1. — С. 65-68.
6. Agata H., Asahina I., Yamazaki Y., Uchida M., Shinohara Y., Honda M.J., Kagami H., Ueda M. Effective bone engineering with periosteum-derived cells // Journal of dental research. — 2007. — 86(1). — 79-83.
7. Alvarado A.S., Tsonis P.A. Bridging the regeneration gap: genetic insights from diverse animal models // Nat. Rev. Genet. — 2006. — 7(11). — 873-884.
8. Burt D.W., Law A.S. Evolution of the transforming growth factor-beta superfamily // Prog. Growth Factor Res. — 1994. — 5(1). — 99-118.
9. Comparison between hyaluronic acid and platelet-rich plasma, intra-articular infiltration in the treatment of gonarthrosis / Cerza F., Carnì S., Carcangiu A., Di Vavo I., Schiavilla V., Pecora A., De Biasi G., Ciuffreda M. // Am. J. Sports Med. — 2012 Dec. — 40(12). — 2822-7.
10. Edwards S.G., Calandruccio J.H. Autologous blood injections for refractory lateral epicondylitis // Am. J. Hand Surg. — 2003. — 28(2). — 272-8.
11. Effects of platelet-rich fibrin matrix on repair integrity of at risk rotator cuff tears / Bergeson A.G., Tashjian R.Z., Greis P.E., Crim J., Stoddard G.J., Burks R.T. // Am. J. Sports Med. — 2012 Feb. — 40(2). — 286-93.
12. Elledge S.J. Cell cycle checkpoints: preventing an identity crisis // Science. — 1996. — 274. — 1664-1672.
13. Even J., Eskander M., Kang J. Bone morphogenetic protein in spine surgery: current and future uses // J. Am. Acad. Orthop. Surg. — 2012. — 20. — 547-52.
14. Foster T.E., Puskas B.L., Mandelbaum B.R., Gerhardt M.B., Rodeo S.A. Platelet-rich plasma: from basic science to clinical applications // Am. J. Sports Med. — 2009. — 37. — 2259-72.
15. Herpin A., Lelong C., Favrel P. Transforming growth factor-beta-related proteins: an ancestral and widespread superfamily of cytokines in metazoans // Dev. Comp. Immunol. — 2004 May. — 28(5). — 461-85.
16. http://en.wikipedia.org/wiki/Bone_morphogenetic_protein
17. http://moikompas.ru/compas/reg_prolif_regener
18. McAleer J.P., Kaplan E., Persich G. Efficacy of concentrated autologous platelet-derived growth factors in chronic lower-extremity wounds // J. Am. Podiatr. Med. Assoc. — 2006. — 96(6). — 482-8.
19. Ongoing positive effect of platelet-rich plasma versus corticosteroid injection in lateral epicondylitis: a double-blind randomized controlled trial with 2-year follow-up / Go–sens T., Peerbooms J.C., van Laar W., den Oudsten B.L. // Am. J. Sports Med. — 2011 Jun. — 39(6). — 1200-8.
20. Platelet quantification and growth factor analysis from platelet-rich plasma: implications for wound healing / Eppley B.L., Woodell J.E., Higgins J. // Plast. Reconstr. Surg. — 2004 Nov. — 114(6). — 1502-8.
21. Effect of different bone substitutes on the concentration of growth factors in platelet-rich plasma / H.S. Cho et al. // J. Biomater. Appl. — 2008, Jan. 14.
22. Platelet rich concentrate: basic science and current clinical applications / Mehta S., Watson J.T. // J. Orthop. Trauma. — 2008 Jul. — 22(6). — 432-8.
23. Platelet-rich plasma differs according to preparation method and human variability / Mazzocca A.D., McCarthy M.B., Chowaniec D.M., Cote M.P., Romeo A.A., Bradley J.P., Arciero R.A., Beitzel K. // J. Bone Joint Surg. Am. — 2012, Feb 15. — 94(4). — 308-16.
24. Treatment of chronic elbow tendinosis with buffered platelet-rich plasma / Mishra A., Pavelko T. // Am. J. Sports Med. — 2006 Nov. — 34(11). — 1774-8.
25. Platelet rich plasma: myth or reality? // Eur. J. Dent. — 2007 Oct. — 1(4). — 192-194.
26. Marx R. Platelet-rich plasma: evidence to support its use // Journal of Oral and Maxillofacial Surgery. — 62(4). — 489-96.
27. Andrade M.G. Evaluation of factors that can modify platelet-rich plasma properties / Andrade M.G., de Freitas Brandão C.J., Sá C.N., de Bittencourt T.C., Sadi–gursky M. // Oral. Surg., Oral. Med., Oral. Pathol., Oral Radiol., Endod. — 2008 Jan. — 105(1). — e5-e12.
28. Marx R.E. Platelet-Rich Plasma: Evidence to Support its Use / R.E. Marx // Journal of Oral and Maxillofacial Surgery. — 2004. — № 62. — С. 489-496.

/78.jpg)