Статтю опубліковано на с. 45-49
Вступ
Кількість пацієнтів, які потребують трансплантації нирки, щорічно збільшується. Це не дивно, бо саме цей метод визнано в усьому світі золотим стандартом лікування термінальної хронічної ниркової недостатності (ТХНН). У той же час в умовах дефіциту донорських органів збільшується й строк очікування цієї операції. Згідно зі звітом United States Renal Data System Annual Report 2013 року, у США середній термін очікування донорської нирки залежно від групи крові сягав 4 та більше років [9]. В Україні, де трупне органне донорство практично відсутнє, пересадка нирки від живого родинного донора є одним з найбільш реальних та ефективних методів лікування хворих із ТХНН [1]. Одною з об’єктивних причин, що не дозволяє збільшити кількість таких операцій, є відсутність у родині пацієнта сумісного за групою крові донора. Така ситуація не є рідкісною й зустрічається у 20–30 % випадків. Виходом з неї міг би стати парний обмін родинними донорами або обмін за принципом доміно, але вони не відповідають чинному в Україні законодавству. Крім того, програма парного обміну не надає суттєвих переваг реципієнтам з 0 (І) групою крові. Тому в таких випадках пацієнту залишається або продовження лікування діалізом як кінцевим методом терапії, або виконання АВ0-несумісної трансплантації нирки.
АВ0-несумісна трансплантація нирки раніше вважалася абсолютно протипоказаною для хворих із ТХНН, оскільки більшість перших таких операції, що були виконані в США у 50–60-х роках, супроводжувалися відторгненням та закінчилися невдало [3, 7]. Однак спроби подолання бар’єра групової несумісності не припинялися. Базуючись на першому позитивному досвіді, отриманому бельгійськими вченими в середині 80-х [2], у 1989 році в Японії стартувала найбільш масштабна на той час програма досліджень з подолання бар’єра групової несумісності при трансплантації нирки. Великий інтерес японських трансплантологів до цієї теми був викликаний украй малою кількістю трупних донорських органів у цій країні. Були виконані 494 AB0-несумісні трансплантації нирки від живого родинного донора. Для проведення цих операцій використовувався ряд протоколів підготовки, що включали плазмаферез і різні комбінації імуносупресивних препаратів. У 98 % випадків для зниження рівня анти-A/B-антитіл та запобігання їх de novo утворенню виконувалась спленектомія. Після трансплантації призначалася трикомпонентна підтримуюча імуносупресивна терапія: інгібітори кальциневрину, азатіоприн, глюкокортикостероїди. Деякі центри як доповнення до базової імуносупресії використовували антитимоцитарний глобулін, циклофосфамід. У ранньому післяопераційному періоді планові сеанси плазмаферезу, як правило, не проводили. Із запровадженням у 2001 році в клінічну практику мікофенолатів і анти-CD25-моноклональних антитіл (базиліксимаб, даклізумаб) покращились результати операцій: одно- та дворічне виживання трансплантатів становило 96 та 94 % відповідно. Ґрунтуючись на цих позитивних результатах, ряд центрів трансплантації, у яких виконуються АВ0-несумісні трансплантації нирки, вважають спленектомію невід’ємною частиною протоколу десенсибілізації [10].
На відміну від японських дослідників в США поширена думка про те, що необхідність симультанного виконання спленектомії та трансплантації є серйозною перешкодою до значного поширення АВ0-несумісної трансплантацій як з боку пацієнтів, так і з боку медичної спільноти. Застосування моноклональних анти-CD20-антитіл (ритуксимаб) здатне викликати так званий стан транзиторної біологічної спленектомії, це дозволяє в ранньому післяопераційному періоді уникнути втрати трансплантата, знизити ризик розвитку гострого гуморального відторгнення і в той же час не має віддалених побічних ефектів, що виникають після спленектомії. Одна з провідних північноамериканських клінік — Johns Hopkins University Hospital — запропонувала власний протокол проведення АВ0-несумісних трансплантацій нирки від живого донора [6]. Для проведення передопераційної підготовки, індукційної та підтримувальної імуносупресивної терапії використовувалися плазмаферез, людський ЦМВ-гіперімунний імуноглобулін у низьких дозах (100 мг/кг), ритуксимаб (анти-CD20 моноклональне антитіло), анти-CD25 моноклональні антитіла (даклізумаб), такролімус, мікофенолат і глюкокортикостероїди. За 10 днів до запланованої дати трансплантації починали сеанси плазмаферезу, заміщення плазми крові проводили 5% альбуміном або свіжозамороженою плазмою від донорів з AB (IV) групою крові. Прийнятним для проведення трансплантації вважали титр анти-A/B-антитіл 1 : 16 і менше. Якщо після п’яти сеансів плазмаферезу не вдавалося досягти цільового титру антитіл, трансплантацію відкладали й продовжували лікування плазмаферезом.
Особливістю європейського підходу до передопераційної десенсибілізації є широке застосування селективних методів видалення антигрупових антитіл за допомогою анти-A або анти-B імуноадсобційних колонок. Як і в США, перевага віддається введенню ритуксимабу, а не виконанню спленектомії. Сироватковий імуноглобулін вводиться одноразово у високій дозі — 0,5 г/кг. Стокгольмська група під керівництвом G. Tyden уперше в Європі повідомила про успішну серію АВ0-несумісних трансплантацій нирки з використанням антиген-специфічної імуноадсорбції й ритуксимабу, без виконання спленектомії [11, 12].
Більшість центрів трансплантації, у яких виконуються АВ0-несумісні трансплантації нирки, повідомляють про добрі результати цих операцій і відзначають практичну відсутність вірогідних відмінностей за такими параметрами, як виживання пацієнтів і виживання трансплантатів, порівняно із сумісними за групою крові трансплантаціями нирки від живого донора [5]. Незважаючи на це, частота імунологічних ускладнень (гостре клітинне й гостре гуморальне відторгнення) при АВ0-несумісних трансплантаціях дещо вища [8].
Відторгнення при АВ0-несумісної трансплантації нирки розвивається за типом надгострого або швидко прогресуючого кризу та запускається в той момент, коли присутні в крові реципієнта анти-A- або анти-B-антитіла зв’язуються відповідно з антигенами A або B, що експресовані на ендотеліальних клітинах трансплантата. Далі відбувається практично миттєва активація системи комплементу, руйнування ендотеліальних клітин, викид прозапальних цитокінів, залучення нейтрофілів і тромбоцитів у ділянку пошкодження, тромбоз капілярів і більших судин трансплантата. Отже, протягом кількох годин припиняється ефективне кровопостачання трансплантата, що призводить до необоротної втрати його функцій.
Однією з головних задач при проведенні АВ0-несумісної трансплантації є передопераційне видалення анти-А/B-антитіл до безпечного рівня та підтримання його протягом принаймні раннього післяопераційного періоду. Для вирішення цієї задачі застосовується цілий ряд методів, що можуть бути поділені за ступенем селективності на такі групи: неселективні — плазмаферез; напівселективні — каскадний плазмаферез, імуноадсорбція з протеїном А та Ig-імуноадсорбція; селективні — специфічна анти-А/В-імуноадсорбція.
У статті обговорюються результати перших АВ0-несумісних трансплантацій нирки, що були виконані в ДУ «Національний інститут хірургії та трансплантології імені О.О. Шалімова» НАМН України протягом 2014–2015 рр.
Матеріал та методи
З липня 2014 по листопад 2015 р. у відділенні трансплантації нирки нашого інституту виконано перші 4 операції трансплантації нирки від АВ0-несумісного живого родинного донора. Демографічна характеристика реципієнтів, причина розвитку ТХНН, тривалість замісної ниркової терапії до операції, групи крові донорів та їх реципієнтів, титри анти-А/В-антитіл та вміст В-лімфоцитів до початку підготовчої терапії подані в табл. 1. Слід звернути увагу, що усі реципієнти були молодого віку (від 32 до 44 років), мали різні початкові титри анти-АВ0-антитіл (але вони не перевищували 1 : 128), а результат крос-матчу в лімфоцитотоксичному тесті (ЛТТ) в усіх випадках був негативним. Донорами були батьки реципієнтів віком від 51 до 65 років. Усі реципієнти після трансплантації отримували однакову трикомпонентну імуносупресивну терапію: інгібітор кальциневрину такролімус (програф) + препарати мікофенолової кислоти (мофетилу мікофенолат (селсепт) або мікофенолат натрію (міфортик)) + метилпреднізолон. Також усім пацієнтам для індукції імуносупресії двічі (за 2 години до операції та на 4-ту добу після неї) вводили препарат моноклональних антитіл до рецептора інтерлейкіну-2 (базиліксимаб) у дозі 20 мг та метилпреднізолон у дозі 500 мг перед реперфузією трансплантата.
/47.jpg)
Контроль стану імунної системи реципієнта здійснювався за рівнем анти-А/В-антитіл, кількістю В-клітин та показниками ЛТТ. Титр анти-A/B-антитіл визначали за допомогою ізогемаглютинуючого тесту серійних розведень у сольовому середовищі. Тест проводили перед введенням ритуксимабу, перед початком та після кожного сеансу імуноадсорбції, вранці в день трансплантації, двічі на тиждень протягом наступних 3 тижнів та далі через 3, 6, 12 місяців.
Згідно зі Стокгольмським протоколом передтрансплантаційну підготовку розпочинали за місяць до запланованої трансплантації із введення ритуксимабу у дозі 375 мг/м2. Після цього аналіз крові фіксував зменшення вмісту В-лімфоцитів (CD3–, CD20+, HLA-DR+) із 8,3–15,6 % до 0–0,2 %. Імуносупресивну терапію розпочинали за два тижні до оперативного втручання, і вона включала: такролімус у стартовій дозі 0,2 мг/кг маси тіла на добу з подальшою її корекцією до отримання цільової концентрації препарату в крові на рівні 15–20 нг/мл,
мікофенолат натрію 720 мг/добу або мофетилу мікофенолат 1000 мг/добу та низькі дози стероїдів (метилпреднізолон у дозі 16 мг/добу). За тиждень до передбачуваної операції починали проведення сеансів специфічної імуноадсорбції із застосуванням колонок «Адсопак А» або «Адсопак В», при цьому за одну процедуру обробляли від 2000 до 3000 мл плазми. Втрати білка під час імуноадсорбції компенсували введенням 100 мл 5% розчину альбуміну. Сеанси в кількості від 6 до 8 проводили через день до досягнення цільового титру анти-А/В-антитіл 1 : 4. Останній передопераційний сеанс завершували введенням внутрішньовенного імуноглобуліну в дозі 0,5 г/кг маси тіла. Двом реципієнтам у зв’язку із тенденцією до зростання титру анти-А/В-антитіл в післяопераційному періоді також було проведено 2 та 3 сеанси імуноадсорбції. Сроки спостереження за реципієнтами після трансплантації становили від 5 до 18 місяців.
Результати та їх обговорення
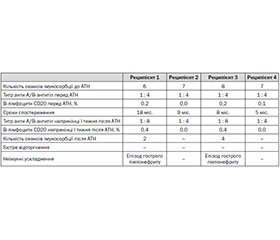
Десенсибілізуюча терапія (ритуксимаб + імуноадсорбція + велики дози імуноглобуліну), яка проводилась в передопераційному періоді, виявилася ефективною. В усіх хворих після введення ритуксимабу отримано заплановане зниження В-лімфоцитів до 0–0,2 %. Титр анти-А/В-антитіл за допомогою імуноадсорбції знижувався до рівня 1 : 4, для цього знадобилося від 6 до 8 сеансів (табл. 2).
Ініціальна функція трансплантованої нирки була задовільною й супроводжувалась достатньо високим діурезом та зниженням креатиніну крові до рівня менше ніж 150 мкмоль/л у двох реципієнтів до кінця першого післяопераційного тижня, в одного — до кінця ІІ тижня та ще в одного — до кінця ІІІ тижня (табл. 2). В жодного пацієнта необхідності в проведенні сеансів гемодіалізу після трансплантації не було.
Протягом перших трьох тижнів після операції в реципієнтів 1 та 3 ми спостерігали тенденцію до зростання кількості аглютинінів до рівня 1 : 8. За даними літератури, сеанси імуноадсорбції можна не проводити, якщо титр анти-А/В-антитіл не перевищує 1 : 16 [1]. Однак враховуючи те, що операції такого роду проводилися вперше в Україні та в нашому лікувальному закладі, а також для щоб нівелювати можливі погрішності застосованої методики виявлення анти-А/В-антитіл, нами було проведено відповідно 2 та 4 сеанси імуноадсорбції для повернення титрів до рівня 1 : 4. Така підвищена настороженість, можливо, і стала причиною того, що в жодного хворого у післятрансплантаційному періоді ми не спостерігали кризів гострого відторгнення трансплантата. Серед неімунних ускладнень у реципієнтів 1 та 3 мали місце епізоди гострого пієлонефриту, що були успішно вилікувані курсом антибіотикотерапії.
/48.jpg)
На даний час виживання реципієнтів і ниркових трансплантатів становить 100 %, хоча термін спостереження поки що надто малий і не дозволяє робити якісь висновки відносно додаткових ризиків АВ0-несумісної трансплантації. На сьогодні функція всіх 4 трансплантованих нирок задовільна. Підтримуюча імуносупресивна терапія включає програф, міфортик або селсепт та метилпреднізолон. Усі пацієнти соціально реабілітовані.
Подолання бар’єра АВ0-несумісності є перспективним напрямком розвитку трансплантології. Наведений опис перших клінічних випадків свідчить про те, що в Україні існують умови для успішного виконання АВ0-несумісної трансплантації нирки, яка може збільшити пул живих родинних донорів та певною мірою допомогти вирішити проблему гострого дефіциту трупних донорських органів.
Основним недоліком АВ0-несумісної трансплантації нирки від живого донора є вартість, що суттєво перевищує таку при АВ0-сумісній трансплантації у зв’язку з необхідністю додаткового придбання дорогих медикаментів та витратних матеріалів (ритуксимаб, внутрішньовенний імуноглобулін, колонка для специфічної анти-А/В-імуноадсорбції). Однак економічні переваги перед іншими методами замісної ниркової терапії, зокрема гемодіалізом, залишаються. Так, за даними закордонних авторів, у довготривалій перспективі витрати на лікування пацієнтів за допомогою такої операції були на 15 % меншими, ніж на лікування гемодіалізом [4].
Висновки
Подолання бар’єра АВ0-несумісності є перспективним напрямком розвитку трансплантології, що відкриває реальний шлях до збільшення пулу живих донорів. В Україні існують умови для успішного виконання АВ0-несумісної трансплантації нирки від живого родинного донора. Такі операції можуть допомогти вирішити проблему гострого дефіциту трупних донорських органів в країні.
Мала кількість власних спостережень поки не дозволяє робити висновки стосовно додаткових ризиків, пов’язаних з несумісністю донора та реципієнта за антигенами АВ0.
Основним недоліком АВ0-несумісної трансплантації нирки є її вартість, що суттєво перевищує таку при АВ0-сумісній трансплантації і пов’язана з необхідністю придбання дорогих медикаментів та витратних матеріалів. Незважаючи на це, така операція залишається привабливою з економічного погляду порівняно з іншими методами замісної ниркової терапії, зокрема гемодіалізом.
Конфлікт інтересів: автор повідомляє про відсутність конфлікту інтересів та відсутність спонсорського фінансування статті.
Рецензенти: І.О. Дудар, д.м.н., професор, завідувач відділом еферентних технологій ДУ «Інститут нефрології»; В.Є. Дриянська, д.м.н., професор, заступник директора ДУ «Інститут нефрології» з науки, завідуюча лабораторією імунології.
Список литературы
1. Сушков А.І., Шаршаткин А.В., Азаренкова О.В. Преодоление барьера несовместимости по группе крови при трансплантации почки от родственного донора // Нефрология и диализ. — 2013. — Т 15, № 4. — C. 286-292.
2. Alexandre G.P., Squifflet J.P., De Bruyère M. et al. Present experiences in a series of 26 ABO-incompatible living donor renal allografts // Transplant. Proc. — 1987. — Vol. 19, № 6. — P. 4538-4542.
3. Hume D.M., Merrill J.P., Miller B.F. et al. Experiences with renal homotransplantation in the human: report of nine cases // J. Clin. Invest. — 1955. — Vol. 34, № 2. — Р. 327-382.
4. Schnitzler M., Machnicki G. ABO-incompatible living donor transplantation: is it economically «compatible»? // Transplantation. — 2006. — Vol. 82, № 2. — Р. 168-169.
5. Shin E., Kwon S.W., Yang W.S. et al. Long Term Outcomes of ABO-Incompatible Living Donor Kidney Transplantation: A Comparative Analysis // Transpl. Proc. — 2015. — Vol. 47, № 6. — P. 1720-1726.
6. Sonnenday C.J., Warren D.S., Cooper M. et al. Plasmapheresis, CMV hyperimmune globulin, and anti-CD20 allow ABO-incompatible renal transplantation without splenectomy // Am. J. Transplant. — 2004. — Vol. 4, № 8. — Р. 1315-1322.
7. Starzl T.E., Marchioro T.L., Holmes J.H. et al. Renal Homografts in Patients with Major Donor-Recipient Blood Group Incompatibilities // Surgery. — 1964. — Vol. 55, № 1. — Р. 195-200.
8. Stel V.S., van de Luijtgaarden M.W., Wanner C. et al. The 2008 ERA-EDTA Registry Annual Report // NDT Plus. — 2011. — Vol. 4, № 1. — Р. 1-13.
9. SYSTEM U. S. R. D. 2013 Annual Data Report, 2013.
10. Takahashi K., Saito K., Takahara S. et al. Excellent long-term outcome of ABO-incompatible living donor kidney transplantation in Japan // Am. J. Transplant. — 2004. — Vol. 4. — № 1. — Р. 1089-1096.
11. Tyden G., Kumlien G., Genberg H. et al. ABO incompatible kidney transplantations without splenectomy, using antigen-specific immunoadsorption and rituximab // Am. J. Transplant. — 2005. — Vol. 5, № 1. — Р. 145-148.
12. Tyden G., Kumlien G., Genberg H. et al. The Stockholm experience with ABO-incompatible kidney transplantations without splenectomy // Xenotransplantation. — 2006. — Vol. 13, № 2. — Р. 105-107.

/47.jpg)
/48.jpg)