Статтю опубліковано на с. 35-39
Вступ
Гострий панкреатит (ГП) вважається однією з найскладніших проблем ургентної хірургії [1, 12]. Це захворювання характеризується низькою загальною летальністю в межах 5 %, але у хворих із тяжкими формами ГП може досягати 80 %, незважаючи на досягнуті успіхи в діагностиці та лікуванні ГП [2, 3]. Серед важливих факторів розвитку тяжкого перебігу, септичних ускладнень і смертності при ГП — транслокація бактерій із кишок у внутрішні органи [9–11]. Саме транслокація бактерій, що супроводжується бурхливою запальною реакцією та призводить до розвитку інфекційно-запальної патології різної тяжкості, перебуває в центрі уваги та вивчається багатьма дослідниками [4, 8]. Попередні наші дослідження вивчили динаміку гематогенної та черезтканинної транслокації мікроорганізмів із кишечника, та, на жаль, встановлення динаміки та рівнів лімфогенного поширення досі не досліджувалось [6, 7].
Мета дослідження — встановити динаміку лімфогенної транслокації мікрофлори кишечника при експериментальному гострому деструктивному панкреатиті (ГДП) та визначити її видовий склад і популяційні рівні.
Матеріал і методи
Експерименти проведено на 72 самцях безпородних білих щурів масою 200–220 г. Індукцію експериментального ГДП (модель Міцунума) і виведення щурів з експерименту здійснювали відповідно до основних положень ухвали Першого національного конгресу з біоетики «Загальні етичні принципи експериментів на тваринах» (2001), Конвенції Ради Європи про охорону хребетних тварин, що використовуються в експериментах та інших наукових цілях, від 18.03.1986 р., Директив ЄЕС № 609 від 24.11.1986 р. і наказу МОЗ України № 66 від 13.02.2006 р. [5].
По 7 щурів кожної групи виводили з експерименту через 6, 12, 24, 48, 72, 96, 120, 168 годин. Під час лапаротомії проводили макроскопічний огляд органів черевної порожнини і забір матеріалу для бактеріологічного та гістологічного дослідження. У випадку смерті тварина виключалася з експерименту, моделювання ГДП виконували на додатковій тварині.
Дослідним матеріалом були мезентеріальні лімфатичні вузли, що забирали стерильними інструментами з дотриманням усіх правил асептики. До гомогенізованої наважки з лімфатичної тканини (0,1 г) додавали 0,9 мл стерильного розчину хлориду натрію для отримання однорідного гомогенату, розведеного 1 : 10. У подальшому здійснювали підготовку серійних десятикратних розведень гомогенату дослідного матеріалу в стерильному ізотонічному розчині хлориду натрію від 10–2 до 10–9. З кожної пробірки титраційного ряду робили висіви 0,1 мл розведеного гомогенату дослідного матеріалу на сектори оптимальних для кожного виду мікроорганізмів поживних середовищ та інкубували при оптимальних температурних умовах. Після інкубації досліджуваного матеріалу перераховували отримані однотипні колонії, визначаючи їх кількість при кожному із зазначених розведень, та визначали популяційний рівень кожного виду мікроорганізмів.
Усі отримані цифрові дані опрацьовані статистично згідно з відомими методиками з використанням критерію (t) Стьюдента при нормальному розподіленні величин, що аналізуються, та непараметричним методом з використанням критерію Вілкоксона — при відхиленні від нормального розподілення.
Результати та обговорення
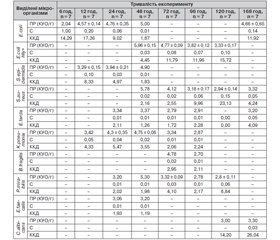
Мікробіологічне дослідження видового складу мікрофлори тканин мезентеріальних лімфатичних вузлів у тварин із ГДП засвідчило (табл. 1), що транслокація ешерихій здійснюється в мезентеріальні лімфатичні вузли вже через 6 год від моменту моделювання ГДП в однієї із семи тварин. Контамінація мезентеріальних лімфатичних вузлів у всіх тварин відбувається протягом 24–120 год, а після 7-го дня експерименту мікроорганізми виявляються тільки в 4 тварин.
/36.jpg)
Через 12 год мезентеріальні лімфатичні вузли контамінують тільки умовно-патогенні ентеробактерії (ешерихії, клебсієли) та стафілококи, в одному спостереженні виявлено асоціацію умовно-патогенних ешерихій та стафілококів. Через 24 год зростає кількість видів ентеробактерій (P.mirabilis та E.tarda), що контамінують мезентеріальні лімфатичні вузли. Така ситуація продовжується й через 48 год, при цьому зменшується кількість штамів стафілококу (епідермальний стафілокок виявлено в однієї тварини). Починаючи з цього терміну в мезентеріальних лімфатичних вузлах двох тварин з’являються ентеротоксигенні ешерихії, які продовжують персистувати до 7-ї доби. З 72-ї год спостерігається тенденція до зменшення видів аеробних та факультативно анаеробних (ентеробактерій і стафілококів) мікроорганізмів, а також з’являються анаеробні умовно-патогенні бактероїди, які виділяються в 14,3 % тварин протягом 72–96 год та елімінують через 120 год. Із 96-ї до 120-ї год зменшується кількість штамів ентеробактерій та зростає кількість штамів стафілококів, однак через 7 діб провідними мікроорганізмами знову стають звичайні ешерихії. Дріжджоподібні гриби роду Сandida виділяються з дослідного матеріалу в пізні терміни дослідження (120–168 год), індекс постійності та частота їх виявлення — від 14,29 до 28,57 і від 0,09 до 0,33 відповідно.
Формування та розвиток експериментального ГДП супроводжуються транслокацією патогенних та умовно-патогенних ентеробактерій, стафілококів, бактероїдів у регіональні лімфатичні вузли. До того ж цей процес починається через 6 год в однієї із семи тварин, а вже через 24 год настає контамінація в усіх досліджуваних тварин. Такий ступінь контамінації зберігається протягом 24–120 год спостереження, а через 7 діб зменшується. Протягом 72–96 год до аеробних і факультативно анаеробних бактерій приєднуються облігатні анаероби — бактероїди.
На наступному етапі нами проведено мікробіологічні дослідження, направлені на встановлення популяційного рівня, індексу значущості (С%) та вирахування коефіцієнта кількісного домінування кожного виду мікроорганізмів, що персистують у тканині мезентеріальних лімфатичних вузлів (табл. 2).
Через 6 год у мезентеріальних лімфатичних вузлах виявляються ешерихії в мінімальних кількостях, що значно нижчі від критичного рівня. Це слід розглядати як контамінацію та пристосування ешерихій до нового середовища, де знаходиться велика кількість імунокомпетентних клітин та їх продуктів секреції, що інгібують ріст та розмноження цих бактерій.
Спостереження та виконання бактеріологічних досліджень у наступні періоди (12 год) показали, що концентрація E.coli зростає вдвічі, але не досягає критичного рівня. У цей період досить високий (але нижче за критичний) популяційний рівень в епідермального стафілокока, дещо нижчий — у клебсієл. Із рівнем С% та ККД основними представниками мікрофлори в мезентеріальних лімфатичних вузлах через 12 год моделювання ГДП є ешерихії в 2 тварин, в інших двох — асоціація ентеробактерій (E.coli та K.pneumoniaе) та епідермального стафілокока.
Протягом наступних 24 та 48 год процес зростання контамінації продовжується й у цей період домінуючими мікроорганізмами є умовно-патогенні ентеробактерії (клебсієли й едварсієли) та стафілококи, популяційний рівень яких практично досягає критичного рівня.
Характерною особливістю 72-годинного періоду перебігу ГДП є контамінація мезентеріальних лімфовузлів ентеротоксигенними ешерихіями та облігатними анаеробними бактеріями (бактероїдами), які виявляються у відносно високому популяційному рівні.
Період з 96-ї до 120-ї год характеризується зменшенням вмісту патогенних (E.coli Hly+) та умовно-патогенних (K.pneumoniaе, E.coli, E.tarda) ентеробактерій, стафілококів та бактероїдів, що персистують у тканині мезентеріальних лімфатичних вузлів усіх тварин з експериментальним ГДП. Через 7 діб тільки в 2 тварин виявляються звичайні ешерихії в асоціації зі стафілококом, едварсієлами та C.albicans на помірному популяційному рівні (нижче за критичний).
Висновки
Формування та розвиток експериментального ГДП характеризується транслокацією патогенних і умовнопатогенних ентеробактерій, стафілококів, анаеробних бактероїдів із кишечника в мезентеріальні лімфатичні вузли, що підтверджує лімфогенне поширення мікроорганізмів. На підставі аналізу динаміки даної транслокації встановлено, що за кількістю виділених штамів, індексом постійності та частотою виявлення провідними транслокантами є E.coli Hly+, E.coli та S.aureus на високих популяційних рівнях. У ранні терміни (6–12 год) домінують E.coli, K.pneumoniaе та S.epidermidis. У пізні терміни (120–168 год) S.aureus залишався основним контамінантом мезентеріальних лімфатичних вузлів, але за коефіцієнтом кількісного домінування також суттєва роль відводилася E.coli, E.coli Hly+, E.tarda, P.mirabilis та C.albicans.
Список литературы
1. Бойко В.В. Этапное хирургическое лечение больных некротическим панкреатитом в фазе гнойных осложнений / В.В. Бойко, А.М. Тищенко, Ю.В. Иванова [и др.] // Укр. журн. хірург. — 2011. — № 2(11). — С. 98-102.
2. Ганжий В.В. Современные возможности прогнозирования и диагностики некротической формы панкреатита (обзор) / В.В. Ганжий, И.П. Колесник, Н.А. Ярешко // Укр. журн. хірург. — 2011. — № 5. — С. 220-227.
3. Ничитайло М.Е. Клинические и экономические аспекты консервативной терапии больных деструктивным панкреатитом / М.Е. Ничитайло, А.К. Влахов // Укр. хіміотерапевт. журн. — 2012. — № 3(26). — С. 170-176.
4. Морар І.К. Особливості бактеріальної транслокації при гострому деструктивному панкреатиті та внутрішньочеревній гіпертензії в експерименті / І.К. Морар, О.І. Іващук, І.С. Давиденко, Є.С. Піжовський // Клін. анатом. та оператив. хірург. — 2012. — Т. 11, № 1. — С. 14-22.
5. Пат. 80071 Україна, МПК G09B 23/28 (2006.01). Спосіб моделювання гострого панкреатиту / Іващук С.І.: заявник і патентовласник Буковинський державний медичний університет. — № u201213805; заявл. 03.12.2012; опубл. 13.05.2013, Бюл. № 9.
6. Ротар Д.В. Бактеріальна контамінація підшлункової залози при гострому панкреатиті / Д.В. Ротар // Буковинський медичний вісник. — 2008. — Т. 12, № 1. — С. 104-109.
7. Ротар Д.В. Бактеріальна контамінація внутрішніх органів при експериментальному гострому панкреатиті / Д.В. Ротар // Укр. журн. хірург. — 2008. — № 1. — С. 78-85.
8. Третьяков Е.В. Современный взгляд на кишечную транслокацию бактерий как основную причину гнойно-септических осложнений при деструктивном панкреатите / Е.В. Третьяков, М.В. Варганов, Е.Е. Нифинтова // Успехи современного естествознания. — 2013. — № 9. — С. 78-80.
9. Fritz S. Bacterial translocation and infected pancreatic necrosis in acute necrotizing pancreatitis derives from small bowel rather than from colon / Stefan Fritz, Thilo Hackert, Werner Hartwig [et al.] // The American Journal of Surgery. — July 2010. — Vol. 200, Issue 1. — P. 111-117.
10. Sanna M. Intestinal bacterial translocation and tight junction structure in acute porcine pancreatitis / Sanna M., Jyrki M., Vesa K. [et al.] // Hepato-Gastroenterology. — 2012. — Vol. 59. — P. 599-606.
11. Sezai A. Effects of infliximab on bacterial translocation in experimental acute necrotizing pancreatitis / Sezai Aydin, A.Turan Isik, Bulent Unal [et al.] // The Indian Journal of Medical Research. — May 2012. — Vol. 135. — P. 656-661.
12. Van Minnen L.P. Acute Pancreatitis: Surgery, Pathophysiology, Probiotic Prophylaxis / Leo Paul van Minnen. — Enschede (The Netherlands): Gildeprint Drukkerijen BV, 2006. — 274 p. — (Thesis, Utrecht University, with a summary in Dutch).

/36.jpg)
/37.jpg)