Резюме
Цель исследования: установить целесообразность применения адаптированных бактериофагов в комплексном лечении больных с разлитым перитонитом. Материалы и методы. В основу работы положен анализ результатов лечения 65 больных. Все больные были прооперированы в ургентном порядке согласно протоколам оказания неотложной и экстренной хирургической помощи. Для сравнительного анализа больные были разделены на 2 группы. В основной группе больных для санации брюшной полости и селективной деконтаминации кишечника использовали адаптированные селективные полибактериофаги (пиобактериофаг поливалентный, интести-бактериофаг, колипротейный). Бактериологическому анализу подвергли отделяемое по назоинтестинальному зонду, перитонеальный экссудат из брюшной полости. Результаты и обсуждение. Исходный уровень бактериальной контаминации у больных основной и контрольной групп был одинаковым. Количество видов микроорганизмов колебалось от 3 до 9. У больных контрольной группы снижение процентного высевания микробной флоры проходило медленно. Если воспалительный процесс в брюшной полости не удавалось купировать за 1–2 санации брюшной полости, то на 3–4-й санациях инфекция была вызвана только ассоциациями микроорганизмов. Если в бактериологических посевах перитонеального экссудата на первичной операции или первой санации преобладали E.coli, Enterococcus spp., Proteus spp., то на 3–4-й санациях в посевах преобладали Acinetobacter spp., P.aeruginosa, K.pneumoniae. При этом менялась и антибиотикорезистентность выделенных штаммов микроорганизмов. Исследование экссудата брюшной полости у больных основной группы показало в динамике, что только у 5 больных изменялись первоначально выделенный вид микробной флоры и ее чувствительность к антибиотикам на 3–4-й день после операции. В основной группе больных, которым применялось внутрикишечное введение адаптированных бактериофагов, отмечено уменьшение бактериальной обсемененности брюшной полости и нормализация микрофлоры тонкой кишки на 4–5-е сутки послеоперационного периода. К 5-м суткам в основной группе у 100 % больных посевы роста патогенных микроорганизмов из тонкой кишки и промывной жидкости из брюшной полости не давали, в контрольной группе при неэффективности предпринятого лечения и этапных санаций на фоне системной антибактериальной терапии у 3 больных отмечали резкое увеличение количества бактерий в перитонеальном экссудате. Выводы. При этапном лечении острого разлитого перитонита с каждой последующей операцией происходит смещение микробного пейзажа перитонеального экссудата в сторону микробных ассоциаций и замещение внебольничных штаммов на антибиотикорезистентные госпитальные.
Мета дослідження: встановити доцільність застосування адаптованих бактеріофагів у комплексному лікуванні хворих із розлитим перитонітом. Матеріали і методи. В основу роботи покладений аналіз результатів лікування 65 хворих. Усі хворі були прооперовані в ургентному порядку згідно з протоколами надання невідкладної та екстреної хірургічної допомоги. Для порівняльного аналізу хворі були розділені на 2 групи. В основній групі хворих для санації черевної порожнини та селективної деконтамінації кишечника використовували адаптовані селективні полібактеріофаги (піобактеріофаг полівалентний, інтесті-бактеріофаг, коліпротейний). Бактеріологічному аналізу піддали виділення з назоінтестинального зонду, перитонеальний ексудат з черевної порожнини. Результати та обговорення. Вихідний рівень бактеріальної контамінації у хворих основної та контрольної груп був однаковим. Кількість видів мікроорганізмів коливалася від 3 до 9. У хворих контрольної групи зниження висівання мікробної флори проходило повільно. Якщо запальний процес у черевній порожнині не вдавалося усунути за 1–2 санації черевної порожнини, то на 3–4-й санаціях інфекція була викликана тільки асоціаціями мікроорганізмів. Якщо в бактеріологічних посівах перитонеального ексудату на первинній операції або першій санації переважали E.coli, Enterococcus spp., Proteus spp., то на 3–
4-й санаціях у посівах переважали P.aeruginosa, K.pneumoniae. При цьому змінювалася і антибіотикорезистентність виділених штамів мікроорганізмів. Дослідження ексудату черевної порожнини у хворих основної групи в динаміці показало, що тільки у 5 хворих змінювалися початково виділений вид мікробної флори і її чутливість до антибіотиків на 3–4-й день після операції. В основній групі хворих, у яких застосовували внутрішньокишкове введення адаптованих бактеріофагів, відзначено зменшення бактеріального обсіменіння черевної порожнини і нормалізація мікрофлори тонкої кишки на 4–5-ту добу післяопераційного періоду. До 5-ї доби в основній групі у 100 % хворих посіви зростання патогенних мікроорганізмів з тонкої кишки і промивної рідини з черевної порожнини не давали, в контрольній групі при неефективності проведеного лікування та етапних санацій на тлі системної антибактеріальної терапії у 3 хворих відзначали різке збільшення кількості бактерій у перитонеальному ексудаті. Висновки. При етапному лікуванні гострого розлитого перитоніту з кожною наступною операцією відбувається зміщення мікробного пейзажу перитонеального ексудату у бік мікробних асоціацій та заміщення позалікарняних штамів на антибіотикорезистентні госпітальні.
The aim of the study: to establish the feasibility of the use of adapted bacteriophages in combined treatment of patients with generalized peritonitis. Materials and methods. The research is based on the analysis of treatment outcomes of 65 patients. All patients were operated urgently according to protocols of providing emergency surgical care. For comparative analysis, patients were divided into 2 groups. In the main group of patients, for sanitation of the abdominal cavity and selective intestinal decontamination we used adapted selective polybacteriophages (pyobacteriophage polyvalent, intesti-bacteriophage, bacteriophagum coliproteicum). Bacteriological analysis was subjected to discharge by nasointestinal tube, peritoneal exudate from the abdominal cavity. Results and discussion. The initial level of bacterial contamination in patients of the main and control groups was the same. The number of species ranged from 3 to 9. In patients in the control group, the percentage reduction of the microbial flora seeding has been slow. If the inflammatory process in the abdominal cavity failed to stop for 1–2 sanitation of the abdominal cavity, during sanitation 3–4 the infection is caused by associations of microorganisms. If in bacterial seeding of the peritoneal exudate at the primary surgery or the first sanitation E.coli, Enterococcus spp., Proteus spp. dominated, then during sanitation 3–4 Acinetobacter spp., P.aerиginosa, K.pneumoniae prevailed in the seeding. Antibiotic resistance of the isolated strains of microorganisms changed too. The study of the exudate of the abdominal cavity in patients of the main group showed in the dynamics that only 5 patients had changes in the initially selected species of the microbial flora and its sensitivity to antibiotics on the days 3–4 after surgery. In the main group of patients who were applied intracolonic introduction of adapted bacteriophages, we have marked a reduction of bacterial contamination of the abdominal cavity and normalization of the microflora of the small intestine on days 4–5 of the postoperative period. By day 5, in the main group in 100 % of patients we hadn’t noted the growth of pathogenic microorganisms from the small intestine and lavage fluid from the abdominal cavity, in the control group, if the treatment and staged sanitations failed, on the background of systemic antibacterial therapy we have detected a sharp increase in the number of bacteria in peritoneal exudates in 3 patients. Conclusions. During staged treatment of acute generalized peritonitis with each subsequent surgery there is a shift of the microbial landscape of peritoneal exudates in the direction of microbial associations and the substitution of community-acquired strains with antibiotic-resistant hospital ones.
Статья опубликована на с. 51-55
Введение
Несмотря на выполнение основных положений приказа МЗ Украины от 4 апреля 2012 г. № 236 «Об организации контроля и профилактики послеоперационных гнойно-воспалительных инфекций, вызванных микроорганизмами, резистентными к действию антимикробных препаратов», частота выявления метициллин-резистентного Staphylococcus aureus (MRSA), ванкомицин-резистентных энтерококков (VRE), резистентных штаммов Escherichia coli в хирургических стационарах остается высокой [1]. Особенно остро проблема адекватной противомикробной терапии стоит у больных с клиникой абдоминального сепсиса, в программе лечения которых используется метод программированных хирургических санаций брюшной полости [2, 3].
Лидерство среди патогенов острой хирургической патологии Escherichia coli не случайно. В условиях гнойного воспаления брюшины развивается дисбаланс между различными видами микроорганизмов и их распределением по различным отделам кишечника. Различают 4 степени (фазы) нарушения кишечной микробиологической экосистемы, характерные для синдрома энтеральной недостаточности в условиях перитонита [3]. В первой (начальной) фазе патологического процесса происходит резкое уменьшение количества симбионтов в естественных местах их обитания. Во второй фазе изменяется видовое соотношение микрофлоры с увеличением численности определенных бактерий (Escherichia, Klebsiella и энтерококков). В третьей фазе патологического процесса меняется локализация аутохтонной микрофлоры — она перемещается в участки кишечника, где ранее не встречалась. Развивается процесс так называемой проксимальной микробной контаминации или колонизации. В четвертой фазе у представленных микробных ассоциаций, перемещенных проксимально по пищеварительному каналу, возникают признаки патогенности [4]. Прогрессирующие изменения микроэкологии кишечника и инфицирование брюшной полости патогенной энтеральной флорой вследствие бактериально-эндотоксиновой транслокации объясняют неэффективность хирургических санаций брюшной полости при синдроме энтеральной недостаточности вследствие продолжающегося сепсиса кишечного происхождения [5]. Несмотря на разработку различных схем антибактериальной терапии как в монорежиме (карбапенемы), так и в сочетании с антианаэробными препаратами (клиндамицином), различные комбинации фторхинолонов с клиндамицином или производными имидазола (метронидазолом, орнидазолом) все равно при полуоткрытом способе ведения брюшной полости приводят к формированию полирезистентных, панрезистентных форм патогенов, что требует поиска новых путей решения [6].
Цель исследования — установить целесообразность применения адаптированных бактериофагов в комплексном лечении больных с разлитым перитонитом.
Материалы и методы
В основу работы положен анализ результатов лечения 65 больных, оперированных в хирургических отделениях ЛГМБ № 3, ЦГБ г. Рубежное, Луганской областной клинической больнице за период 2013–2015 гг. Мужчин было 54 человека (83 %), женщин — 11 (17 %). Причинами развития перитонита были острые хирургические заболевания и повреждения органов брюшной полости. Причинами перитонита явились: перфорация гастродуоденальной язвы — 31 (47,7 %) пациент, перфорация тонкой кишки — 6 (9 %), острый аппендицит — 17 (26,5 %), абсцесс брюшной полости невыясненной этиологии, вскрывшийся в брюшную полость, — 2 (3 %), острый деструктивный холецистит — 7 (10,8 %), острая кишечная непроходимость с некрозом тонкой кишки — 1 (1,5 %), проникающие колото-резаные ранения живота с повреждением тонкой кишки — 1 (1,5 %). Все больные были прооперированы в ургентном порядке согласно протоколам оказания неотложной и экстренной хирургической помощи. Оперативное лечение больных было направлено на устранение источника перитонита, проводились назоинтестинальная интубация, санация и дренирование брюшной полости. У всех пациентов индекс брюшной полости (Савельев В.С., 2000) составил более 13 баллов, коэффициент энтеральной недостаточности — свыше 90 баллов, что требовало лечения перитонита полуоткрытым методом с программируемыми этапными санациями.
Для сравнительного анализа больные были разделены на 2 группы: 1-я группа (основная) — 33 больных, которым проводили комплексное лечение перитонита полуоткрытым методом с программируемыми этапными санациями согласно разработанному алгоритму селективной деконтаминации тонкого кишечника (патент на полезную модель ua № 76329). Применяли разработанную нами методику: после выполнения основного этапа операции и санации брюшной полости осмосбалансированными растворами в брюшную полость вводилось 200 мл поливалентного бактериофага и накладывалась закрытая лапаростома. В послеоперационном периоде с целью селективной деконтаминации кишечника после санации назоинтестинального зонда физиологическим раствором хлорида натрия вводили по зонду 200 мл бактериофага с экспозицией в течение 30 минут. По истечении этого срока интестинальное дренирование осуществлялось пассивно. Данные манипуляции проводились каждые 6 часов, весь период нахождения интестинального зонда и при повторных релапаротомиях. Удаление интестинального зонда, закрытие лапаротомной раны осуществлялось при достоверном снижении уровня эндогенной интоксикации с использованием коэффициента энтеральной недостаточности.
Вторая группа (контрольная) представлена 32 больными, лечение которых проводили в соответствии с общепринятыми стандартами: антибактериальная терапия проводилась путем комбинации гатифлоксацина с орнидазолом, перитонеальный лаваж осуществлялся декасаном.
Группы не имели существенных различий по клиническим показателям (пол, возраст, общее состояние).
Анализу подверглись такие критерии: бактериальное исследование отделяемого по назоинтестинальному зонду, перитонеальный экссудат. Забор перитонеального экссудата осуществлялся интраоперационно непосредственно из брюшной полости. Исследуемый материал собирали в стерильные емкости, соблюдая правила асептики.
Исследования кишечной микрофлоры проводили унифицированным методом, включающим посев на окружающие среды, выделение чистой культуры, модификацию микроорганизмов, определение чувствительности к бактериофагам.
Как объект исследования в работе использовали культуры гноеобразующих условно-патогенных бактерий родов Staphylococcus, Enterococcus, Escherichia, Proteus, Enterobacter, Moraxella, Acinetobacter, Actinomyces, Peptococcus, Peptostreptococcus, Clostridium, Prevotella, Fusobacterium, Veillonella, выделенных из экссудата брюшной полости у больных перитонитом.
Материал для микробиологического исследования принимали и анализировали в тот же день. Критерием этиологической роли возбудителей гнойно-воспалительных заболеваний были титры колониеобразующих единиц (КОЕ/мл), обозначенных в «Додатку до наказу Міністерства охорони здоров’я України № 4 від 05.01.1996 р.». Для определения количественного состава микрофлоры перитонеального экссудата использовали метод секторальных посевов, основанный на инкубировании разведенных концентраций микроорганизмов. Время определения микробного числа составляло 18–36 ч.
Определение фагочувствительности проводили на 1,5% мясо-пептонном агаре или агаре Хоттингера (для стафилококков и стрептококков в питательный агар добавляют 0,4% глюкозы). Дно чашки Петри с обратной стороны предварительно расчерчивали соответственно используемым фаговым препаратам.
Бактериальную суспензию суточной агаровой культуры (5 ед. по ОСО 42-28-01П) выделенного бактериального штамма равномерно распределяли по поверхности чашки Петри с хорошо подсушенной питательной средой. Излишек жидкости удаляли пастеровской пипеткой и подсушивали в зоне пламени горелки в течение 20–30 с.
На поверхность агара с впитавшейся культурой пастеровской пипеткой с тонко оттянутым концом наносили по 1 капле (0,03 мл) образца препарата бактериофагов. После подсыхания капель фагов чашки инкубировали в термостате при температуре 37 °С в течение 18–20 часов, для бактерий рода Proteus — в течение 4–6 часов.
Учет и регистрация результатов проводились по 4-крестовой схеме:
++++ — сливной лизис;
+++– — полусливной лизис (незначительный рост культуры в зоне лизиса);
++– — наличие в месте нанесения капли фага более 50 колоний фага (пятен лизиса);
+– — от 20 до 50 колоний фага;
–+– — менее 20 колоний фага (полное отсутствие лизиса).
Наличие зон лизиса ++++ и +++ свидетельствовало о высокой чувствительности изучаемого штамма к лечебно-профилактическому фагу, ++ — умеренной, + — слабой чувствительности. Предпочтение должно быть отдано бактериофагам, вызывающим лизис с интенсивностью ++++ и +++. Бактериологический контроль осуществляли во время проведения кишечного лаважа. Оценивали следующие показатели: снижение микробного числа, смена возбудителя, суперинфекция, исчезновение возбудителей.
Результаты и обсуждение
Исходный уровень бактериальной контаминации у больных основной и контрольной групп был одинаковым. Отмечено, что одни и те же виды микроорганизмов встречались в посевах тонкокишечного содержимого из назоинтестинального зонда и экссудата из брюшной полости. Однородность высеваемых культур свидетельствует о бактериальной транслокации. Микробный пейзаж экссудата у большинства больных перитонитом был представлен аэробно-анаэробными ассоциациями и соответствовал таковому в содержимом органа, перфорация (воспаление) которого и являлась причиной перитонита.
В видовом составе тонкокишечного содержимого были определены как типичные представители микрофлоры этой экологической ниши (стафилококки, стрептококки, энтерококки, аэробные бациллы), так и микробы, относящиеся к фекальной микрофлоре (клебсиеллы, клостридии, бактероиды). Количество видов микроорганизмов колебалось от 3 до 9. Таким образом, заселение тонкой кишки происходило из дистальных отделов пищеварительного тракта.
При исследовании в первые сутки в перитонеальном экссудате определялись не только различные аэробные кокки и грибы рода Candida, но и ассоциации грамотрицательных аэробных и анаэробных микроорганизмов, среди которых доминирующее положение занимали представители энтеробактерий (кишечная палочка — 44 %, протеи — 20 %, клебсиеллы — 16 %, псевдомонады — 32 %, бактероиды — 20 %). Среднее количество видов микробов составляло 4–6. Суммарная бактериальная контаминация перитонеального экссудата достигала 1010 КОЕ/мл.
Наиболее высокое содержание микробов в перитонеальном экссудате отмечалось при повреждениях толстой кишки, гангренозно-перфоративном аппендиците, гангренозном холецистите. Следует отметить, что как в тонкокишечном, так и в перитонеальном экссудате ассоциации микробной флоры преобладают над монокультурами. Конкретные варианты участия аэробного и анаэробного компонентов характеризовались изменчивостью, однако сочетание кишечной палочки и В.fragilis встречалось чаще всего из анаэробно-аэробных ассоциаций (30 %).
Микробиологические данные результатов лечения в динамике у больных контрольной и основной групп выявили уменьшение бактериальной обсемененности брюшной полости и нормализацию микрофлоры тонкой кишки. Но сроки были различны. Несмотря на проведение активного лаважа, энтеросорбции, энтерального питания, у больных контрольной группы снижение процентного высевания микробной флоры проходило медленно. Если воспалительный процесс в брюшной полости не удавалось купировать за 1–2 санации брюшной полости, то на 3–4-й санациях инфекция была вызвана только ассоциациями микроорганизмов. Следует отметить, что при этапном хирургическом лечении внебольничного разлитого перитонита микробный пейзаж перитонеального экссудата менялся с каждой последующей программированной санацией. Если в бактериологических посевах перитонеального экссудата на первичной операции или первой санации преобладали E.coli, Enterococcus spp., Proteus spp., то на 3–4-й санациях в посевах преобладали Acinetobacter spp., P.aeruginosa, K.pneumoniae. При этом менялась и антибиотикорезистентность выделенных штаммов микроорганизмов.
Исследование экссудата брюшной полости у больных основной группы показало в динамике, что только у 5 больных изменялись первоначально выделенный вид микробной флоры и ее чувствительность к антибиотикам на 3–4-й день после операции.
Характерными клиническими проявлениями участия анаэробов в патологическом процессе были: более тяжелое течение, лейкоцитарный индекс интоксикации, достигающий 5–8 у.е., экссудат с неприятным ихорозным запахом. Высевание микробной флоры из тонкой кишки и перитонеального экссудата у больных контрольной группы отмечалось вплоть до 6–7-х суток. Escherichia coli высевалась в 4 % случаев, и микробное число составляло 104 КОЕ/мл.
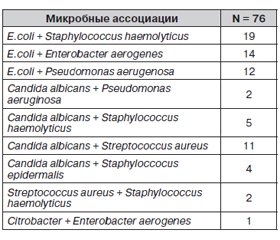
Наиболее часто встречаемые ассоциации бактерий, определенные в отделяемом по назогастральному зонду у больных основной группы, представлены в таблице 1.
Зная характер, индекс встречаемости в исследуемом отделяемом бактерий, подбирался наиболее специфический комплекс адаптированных бактериофагов для проведения селективной деконтаминации кишечника (табл. 2).
При этом использование комбинированных бактериофагов в терапии синдрома энтеральной недостаточности в основной группе оказывало выраженный фаголитический эффект практически на весь спектр микрофлоры, высеваемой из тонкой кишки и брюшной полости. В динамике определялось резкое снижение процента высеваемости микробов. Так, уже к 3-м суткам лечения у 28 (97,5 %) больных роста микрофлоры из брюшной полости не было получено, а кишечная палочка обнаруживалась лишь у 1 (3,5 %) больного.
В основной группе больных, которым применялось внутрикишечное введение адаптированных бактериофагов, отмечено уменьшение бактериальной обсемененности брюшной полости и нормализация микрофлоры тонкой кишки на 4–5-е сутки послеоперационного периода. К 5-м суткам в основной группе у 100 % больных посевы роста патогенных микроорганизмов из тонкой кишки и промывной жидкости из брюшной полости не давали, в контрольной группе при неэффективности предпринятого лечения и этапных санаций на фоне системной антибактериальной терапии у 3 больных отмечали резкое увеличение количества бактерий в перитонеальном экссудате (более 25000/мкл). Исследование микробного спектра брюшной полости у этих больных на этапах санационных вмешательств показало, что к 3–4-му вмешательству происходит полное доминирование высокорезистентных штаммов внутрибольничной инфекции.
Успех этапных санаций брюшной полости и регрессии воспалительного процесса был определен снижением количества бактерий в экссудате — менее 100 единиц в микролитре.
Выводы
При этапном лечении острого разлитого перитонита с каждой последующей операцией происходит смещение микробного пейзажа перитонеального экссудата в сторону микробных ассоциаций и замещение внебольничных штаммов на антибиотикорезистентные госпитальные. При назначении эмпирической антибактериальной терапии распространенного перитонита необходимо учитывать не только его происхождение, но и планируемый метод ведения брюшной полости. При использовании комбинированных адаптированных бактериофагов резистентные устойчивые штаммы микроорганизмов не образуются. Бактериофаги высокоспецифичны, не подавляют нормальную микрофлору и не нарушают естественный баланс внутренней среды организма, бактериофаги не имеют противопоказаний к применению, не обладают токсическим, аллергическим и тератогенным эффектами.

/54.jpg)