Статья опубликована на с. 87-91
Миома матки является наиболее распространенным доброкачественным опухолевым заболеванием репродуктивной системы, которое диагностируется у 20–30 % женщин репродуктивного возраста. К гигантским фибромиомам матки относятся опухоли массой более 11,4 кг [1, 2]. Максимальная масса описанной в литературе гигантской фибромиомы — 40 кг [3, 4]. Фибромиомы гигантских размеров могут быть представлены как одиночной опухолью, так и конгломератом из множества опухолевых узлов.
Типичные клинические проявления роста и развития миомы матки часто сопровождаются увеличением менструальной кровопотери, а иногда и маточными кровотечениями, которые некоторые исследователи считают дисфункциональными и в основном зависящими от нейроэндокринных расстройств [5]. Другие же исследователи связывают происхождение патологической кровопотери прежде всего с ростом и локализацией узлов опухоли, а также с нейроэндокринными и гуморальными сдвигами, вызывающими серьезные метаболические нарушения [6, 7]. Маточные кровотечения, которые не останавливаются после повторных выскабливаний слизистой оболочки матки, гормонотерапии и других консервативных методов лечения, часто создают проблемы как для пациента, так и для врача. Повторные обильные кровопотери часто связаны с субмукозной или интерстициальной миомой и требуют хирургического лечения, несмотря на то, что матка может и не достичь больших размеров. Клиницисты считают это показанием к срочному оперативному лечению [8]. Хроническая постгеморрагическая анемия является показанием к хирургическому лечению более чем у 70 % пациентов, страдающих от миомы [9].
Таким образом, интраоперационная кровопотеря может выступать как отягчающий фактор во время периоперационного периода. Снижение кровопотери является актуальной проблемой у пациентов с миомой матки, которым планируется оперативное лечение.
Материалы и методы
Исследованы результаты хирургического лечения 92 гинекологических больных с диагнозом «гигантская миома матки». Исследования проводились на базе отделений гинекологии и интенсивной терапии КУ «Одесская областная клиническая больница» в 2008–2015 гг.
Средний возраст больных миомой матки составил 48,31 ± 5,65 года. Среди сопутствующей патологии преобладала сердечно-сосудистая, в частности гипертоническая болезнь — 38,04 % (35 женщин), ишемическая болезнь сердца — 34,78 % (32 женщины) и сердечная недостаточность I–II А ст. — 19,57 % (18 женщин). Значительно реже диагностировался гастрит — 5,43 % (5 женщин), ЖКБ — 3,26 % (3 женщины), хронический бронхит — 3,26 % (3 женщины), хронический панкреатит — 2,17 % (2 женщины), язвенная болезнь — 1,08 % (1 женщина). Также были пациентки с ожирением — 3,26 % (3 женщины), сахарным диабетом — 6,52 % (6 женщин).
Систему свертывания крови исследовали при помощи низкочастотной пьезоэлектрической тромбоэластографии (НПТЭГ) на аппаратно-программном комплексе АРП-01М «Меднорд». Мониторировались следующие показатели: начальный показатель агрегатного состояния крови А0, амплитуда контактной фазы коагуляции (А1), показатель времени контактной фазы коагуляции (R (t1)), интенсивность коагуляционного драйва (ИКД), константа тромбиновой активности (КТА), время свертывания крови (ВСК), интенсивность полимеризации сгустка (ИПС), максимальная плотность сгустка (МА), интенсивность ретракции и лизиса сгустка (ИРЛС). Забор крови выполнялся до операции, после начала оперативного вмешательства, после окончания оперативного вмешательства и на 1, 2, 3-и сутки после операции. Исследуемые были распределены на две группы в зависимости от вида коррекции гемокоагуляционных нарушений. 1-ю группу составили 44 пациентки, у которых схема комплексной коррекции включала продленную эпидуральную анестезию на уровне L2-L3 7–12 мл 0,5% бупивакаина и 10 мл 0,5% бупивакаина в течение первых послеоперационных суток дробно. Антикоагулянтная терапия проводилась НМГ бемипарином 2500 МЕ с первых послеоперационных суток и в течение 7 суток. Антифибринолитическая терапия этим больным не проводилась. Вторую группу составили 48 пациенток, у которых схема комплексной коррекции включала продленную эпидуральную анестезию на уровне L2-L3 7–12 мл 0,5% бупивакаина и 10 мл 0,5% бупивакаина в течение первых послеоперационных суток дробно. Антикоагулянтная терапия проводилась НМГ бемипарином 2500 МЕ с первых послеоперационных суток и в течение 7 суток. Больным данной группы была назначена транексамовая кислота за 30 минут до оперативного вмешательства в дозе 20 мг/кг с последующей инфузией 5 мг/кг в час в течение первых послеоперационных суток.
Для статистической обработки использовали методы параметрического и непараметрического анализа (программа Statistica 6.0 (StatSoft Inc., США)). Для суждения о достоверности различий в случае распределения, близком к нормальному, использовали t-критерий Стьюдента; в противном случае использовали непараметрический критерий Манна — Уитни. Различия считались достоверными при р < 0,05. Для сравнения риска развития осложнений использовалось определение относительного риска (RR).
Результаты
В предоперационном периоде у пациенток обеих групп была выявлена активация сосудисто-тромбоцитарного компонента гемостаза. Так, показатель ИКК повышен в 1-й группе на 46,18 % и во 2-й группе — на 42,79 %, показатель А0 повышен в 1-й группе на 39,63 % и во 2-й группе — на 40,54 %, показатель R (t1) сокращен в 1-й группе на 77,38 % и во 2-й группе — на 75,11 % по сравнению с нормой. Также на дооперационном этапе изменены показатели, характеризующие коагуляционное звено гемостаза. По отношению к норме повышенными были следующие показатели: КТА в 1-й группе — на 87,64 % и во 2-й группе — на 82,91 %, ИКД в 1-й группе — на 72,45 % и во 2-й группе — на 70,11 %, ИПС в 1-й группе на — 88,58 % и во 2-й группе — на 72,52 %, МА в 1-й группе — на 44,04 % и во 2-й группе — на 42,65 %. Эти изменения, а также сокращение ВСК в 1-й группе на 49,28 % и во 2-й группе — на 52,49 % и времени формирования фибрин-тромбоцитарной структуры сгустка — Т в 1-й группе — на 49,97 % и во 2-й группе — на 52,73 % по отношению к норме свидетельствуют о гиперкоагуляции. Также выявлена активация фибринолиза — увеличение показателя ИРЛС в 1-й группе на 63,16 % и во 2-й группе — на 67,91 % по отношению к норме (табл. 1).
/88.jpg)
В предоперационном периоде у пациенток с гигантской миомой матки была выявлена активация фибринолиза на фоне усиления агрегации тромбоцитов и гиперкоагуляции. Из полученных данных понятно, что у больных миомой матки на фоне активации сосудисто-тромбоцитарного звена гемостаза отмечается незначительная структурная (увеличение амплитуды показателя МА НПТЭГ) и хронометрическая (сокращение ИКК, ИКД, КТА, R (t1) и ВСК НПТЭГ) гиперкоагуляция с повышенной генерацией тромбина (увеличение показателей А0, ИКК НПТЭГ) и активацией фибринолитической активности крови (ИРЛС).
Развитие эпидурального блока и начало операции активизировали фибринолиз: в 1-й группе ИРЛС увеличился с 26,84 ± 2,14 % до 28,61 ± 1,98 %, что составило 7,14 %. Во 2-й группе показатель ИРЛС до оперативного вмешательства составлял 27,67 ± 2,73 %, а после наступления эпидурального блока и использования транексамовой кислоты — 12,21 ± 2,14 % — снижение активности фибринолиза на 55,87 % по отношению к показателю ИРЛС до оперативного вмешательства (р < 0,05). Эта величина на 42,67 % меньше показателя ИРЛС после наступления эпидурального блока в 1-й группе (р < 0,05) (рис. 1). Это свидетельствовало о снижении активности фибринолиза у больных 2-й группы на фоне применения фибринолитиков, несмотря на активизирующее влияние эпидуральной анестезии.
/89.jpg)
В результате применения предложенной схемы коррекции у больных 2-й группы, имеющих нарушения гемостаза в виде гиперкоагуляции и активации фибринолиза, уже сразу после начала оперативного вмешательства происходило снижение показателя ИРЛС на 55,87 % по отношению к показателю ИРЛС до оперативного вмешательства и уменьшение проявлений структурной гиперкоагуляции в виде положительной динамики показателей по сравнению с дооперационными данными: увеличение КТА на 57,09 %, сокращение ВСК на 38,36 %, увеличение ИКД на 51,82 %, увеличение ИПС на 46,15 %, увеличение МА на 41,39 %.
Сравнительная динамика показателей НПТЭГ у пациентов 1-й и 2-й группы, которые отражают коагуляционное звено, характеризовалась снижением амплитудных и удлинением временных констант гемокоагуляции на третьи сутки по сравнению с нормой. У больных 1-й группы отмечалось увеличение КТА на 18,26 %, ИКД на 8,22 %, ВСК (t3) на 7,24 %, ИРЛС на 27,11 % по сравнению с нормой.
Во 2-й группе на третьи сутки лечения отмечалось снижение КТА на 9,8 %, ИКД на 7,2 %, МА на 11,1 %, ИРЛС на 10,76 % и увеличение ВСК (t3) на 10,1 % по сравнению с нормой.
Приведенные данные свидетельствуют о нормализации коагуляции на третьи сутки лечения больных миомой матки 1-й и 2-й группы. Несмотря на это, оставалась разница в состоянии фибринолитического звена: в 1-й группе сохранялась активация фибринолиза, показатель ИРЛС был увеличенным на 27,11 % по сравнению с нормой, а во 2-й группе отмечалось незначительное угнетение фибринолиза, показатель ИРЛС был уменьшен на 10,76 % по сравнению с нормой.
Клиническим подтверждением полученных лабораторных данных является количество послеоперационных тромбогеморрагических осложнений, уровень гемоглобина и величина кровопотери, а также сроки пребывания больных в ОИТ.
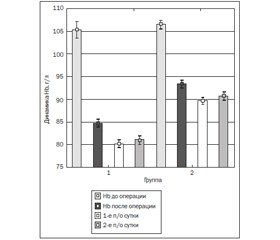
Течение послеоперационного периода у больных 2-й группы по сравнению с больными 1-й группы имеет более благоприятный характер: уровень гемоглобина был достоверно выше (р < 0,05) как сразу после операции (1-я группа — 85,00 ± 3,42 г/л, 2-я группа — 93,00 ± 3,21 г/л), так и на первые (1-я группа — 81,00 ± 3,57 г/л, 2-я группа — 91,00 ± 2,97 г/л) и вторые (1-я группа — 82,00 ± 2,87 г/л, 2-я группа — 91,00 ± 3,02 г/л) сутки послеоперационного периода (рис. 2).
Кровопотеря достоверно ниже у больных 2-й группы по сравнению с 1-й (р < 0,05). Сразу после операции кровопотеря у больных 2-й группы была меньше на 23,37 % по сравнению с 1-й группой, за 1-е сутки послеоперационного периода кровопотеря у больных 2-й группы была меньше на 42,85 % по сравнению с 1-й группой, динамика кровопотери и за вторые сутки кровопотеря во 2-й группе была меньше на 41,66 % по сравнению с 1-й группой (рис. 3).
Необходимость переливания препаратов крови в группе, получавшей в составе комплексной коррекции транексамовую кислоту, была на 9,28 % меньше (р < 0,05), чем в 1-й группе.
Сроки пребывания в отделении интенсивной терапии также во 2-й группе были достоверно меньше, чем в 1-й группе (рис. 4).
Тромбозы глубоких вен нижних конечностей были обнаружены на 3-и — 5-е сутки после оперативного вмешательства у 6 женщин (13,63 %) первой группы. У 4 женщин (8,33 %) второй группы наблюдались тромбозы глубоких вен с клинически бессимптомным течением. Частота тромбозов глубоких вен нижних конечностей имела тенденцию к снижению с 13,63 % до 8,33 %, но это не было статистически достоверным (р < 0,05). При сравнении рисков возникновения тромбозов глубоких вен нижних конечностей было установлено, что в группе больных миомой матки, которые на периоперационном этапе лечения получали антифибринолитическую терапию, риск был ниже (RR = 0,6).
Выводы
1. При изучении состояния системы гемостаза у больных с гигантской миомой матки до начала лечения установлены определенные различия по сравнению с нормой, а именно: гиперагрегация в виде увеличения показателя интенсивности контактной фазы коагуляции на 76 % (p < 0,05), гиперкоагуляция в виде роста показателя интенсивности коагуляционного драйва на 71 % (p < 0,05) и активация фибринолиза, увеличение показателя интенсивности ретракции и лизиса сгустка на 65 % (p < 0,05).
2. Установлено, что у больных с гигантской миомой матки, которые на периоперационном этапе лечения не получали антифибринолитическую терапию, на третий день после оперативного вмешательства показатель интенсивности контактной фазы коагуляции был больше на 24 %, показатель интенсивности коагуляционного драйва был меньше на 8 % по сравнению с нормой, что свидетельствовало о восстановлении состояния коагуляционного звена системы гемостаза. Показатель интенсивности ретракции и лизиса сгустка, характеризующий состояние фибринолиза, не восстанавливался и был выше на 27 % по сравнению с нормой (р < 0,05), что свидетельствовало о сохранении активации фибринолиза.
3. Установлено, что у больных с гигантской миомой матки, которые на периоперационном этапе лечения получали антифибринолитическую терапию, на третий день после оперативного вмешательства показатель интенсивности контактной фазы коагуляции был выше на 19 %, показатель интенсивности коагуляционного драйва был выше на 6 % по сравнению с нормой, что свидетельствовало о восстановлении состояния коагуляционного звена системы гемостаза. Показатель интенсивности ретракции и лизиса сгустка, характеризующий состояние фибринолиза, был выше на 6 % (р < 0,05) по сравнению с 1-й группой, что свидетельствовало о нормализации фибринолиза.
4. Использование продленной эпидуральной анестезии, транексамовой кислоты и бемипарина является наиболее целесообразным для уменьшения кровопотери и восстановления резервных возможностей системы гемостаза. У больных второй группы уровень гемоглобина на вторые послеоперационные сутки был выше на 10 % (р < 0,05), кровопотеря была ниже на 29 % (р < 0,05), необходимость переливания препаратов крови меньше на 9,28 % (р < 0,05), сроки пребывания в отделении интенсивной терапии были меньше на 24 % (р < 0,05).
Список литературы
1. Arleo E.K., Schwartz P.E., Hui P., McCarthy S. Review of Leiomyoma Variants // Am. J. Roentgenol. — 2015. — Vol. 205. — № 4. — Р. 912-921.
2. de Vries H.S., Samlal R.K., Maresch B.J., Hoven-Gondrie M.L. Cecal volvulus caused by a large uterine leiomyoma // Int. J. Surg. Case Rep. — 2015. — № 10. — Р. 97-99.
3. Mas A., Cervello I., Gil-Sanchis C., Simón C. Current understanding of somatic stem cells in leiomyoma formation // Fertil. Ste–ril. — 2014. — Vol.102, № 3. — Р. 613-620.
4. Patel B., Elguero S., Thakore S., Dahoud W., Bedaiwy M., Mesiano S. Role of nuclear progesterone receptor isoforms in uterine pathophysiology // Hum. Reprod. Update. — 2015. — Vol. 21, № 2. — Р. 155-173.
5. Senol T., Kahramanoglu I., Dogan Y., Baktiroglu M., Karateke A., Suer N. Levonorgestrel-releasing intrauterine device use as an alternative to surgical therapy for uterineleiomyoma // Clin. Exp. Obstet. Gynecol. — 2015. — Vol. 42, № 2. — Р. 224-227.
6. Tower A.M., Cronin B. Myomectomy after a vaginal delivery to treat postpartum hemorrhage resulting from an intracavitaryleiomyoma // Obstet Gynecol. — 2015. — Vol. 125, № 5. — Р. 1110-1113.
7. Vasilev N., Nacheva A., Zlatkov B., Kostova P., Netzov V., Nikolov A., Pechlivanov B., Ivanov S., Kornovski J., Kostov I. Ute–rine leiomyoma and fibroleiomyoma: treatment for non-pregnant women // Akush. Ginekol. (Sofiia). — 2015. — № 54, suppl. 1. — Р. 3-18.
8. Wu C.Q., Lefebvre G., Frecker H., Husslein H. Urinary retention and uterine leiomyomas: a case series and systematic review of the literature // Int. Urogynecol. J. — 2015. — Vol. 26, № 9. — Р. 1277-1284.
9. Yin H., Lo J.H., Kim J.Y., Marsh E.E., Kim J.J., Ghosh A.K., Bulun S., Chakravarti D. Expression profiling of nuclear receptors identifies key roles of NR4A subfamily in uterine fibroids // Mol. Endocrinol. — 2013. — Vol. 27, № 5. — Р. 726-740.
/89.jpg)
/90.jpg)

/88.jpg)
/90_2.jpg)