Статья опубликована на с. 8-13
Высокая распространенность инфекции Н.pylori обусловливает актуальность постоянного динамического изучения проблемы и поиск новых эффективных схем антихеликобактерной терапии (АХБТ). В развитых странах Европы число инфицированных Н.pylori достигает 15–20 %, а в некоторых странах Азии и Африки — до 76 % населения [19]. В Украине средний уровень инфицированности Н.pylori среди взрослого населения достаточно высок и составляет около 70 % [10].
Такие высокие показатели инфицированности связаны с факторами вирулентности и патогенности Н.pylori, позволяющими ей существовать и выживать в различных условиях обитания, быстро приспосабливаться и вырабатывать резистентность к различным схемам АХБТ.
Важнейшим фактором вирулентности Н.pylori является бактериальная уреаза, которая находится не только в цитоплазме, но и на поверхности хеликобактера. Существует особый механизм, регулирующий гидролиз мочевины в зависимости от окружающего клетку рН по принципу отрицательной обратной связи. Уреаза Н.pylori, гидролизируя мочевину в микроокружении, нейтрализует пенетрацию ионов водорода через клеточную стенку бактерии, что поддерживает внутриклеточный потенциал рН на уровне, необходимом для жизнедеятельности бактерий [9, 16]. Непосредственная адгезия микроорганизмов к эпителиальным клеткам, аммиак, выделяемый в результате деятельности фермента уреазы, и бактериальные цитотоксины повреждают мембраны эпителиальных клеток. Основными повреждающими факторами Н.pylori являются: нарушение трансмембранного потенциала и стимуляция обратной диффузии ионов водорода, прямое повреждение слизистой оболочки, индукция синтеза провоспалительных цитокинов, снижение синтеза тканевых простагландинов и аденозинтрифосфата, активация тканевых фосфолипаз, нарушение сосудистой проницаемости, снижение кровотока в слизистой оболочке, дестабилизация защитной слизи, нарушение процессов регенерации эпителия слизистой оболочки и активация перекисного окисления липидов [3, 7, 10, 12]. Клинически это проявляется в развитии различных заболеваний гастродуоденальной зоны, основа лечения которых — АХБТ.
По данным IV Маастрихтского консенсуса, показания к проведению эрадикации Н.pylori таковы: пептическая язва желудка и двенадцатиперстной кишки (активная, неактивная, осложненная), MALT-лимфома, атрофический гастрит, резекция желудка по поводу рака в анамнезе, родственники первой линии, страдающие раком желудка. АХБТ может проводиться и по желанию пациента (по согласованию с лечащим врачом).
Одним из наиболее частых и распространенных заболеваний гастродуоденальной зоны, которое связано с Н.pylori и может приводить к инвалидизации трудоспособной части населения, является язвенная болезнь. Эпидемиологические данные свидетельствуют о том, что 100 % язв двенадцатиперстной кишки и 80 % язв желудка связаны с персистенцией Н.pylori [11]. Имеющаяся информация по некоторым странам указывает на высокую частоту заболеваемости: в Японии — 11,2 %, в Швейцарии — до 7,5 %, на Среднем Востоке — до 25 %, а в Соединенных Штатах Америки — до 10 % населения [1–3, 7, 16].
Основная цель терапии пациентов с язвенной болезнью — это излечение больного путем проведения этиологической терапии и устранения основной причины (в первую очередь Н.pylori), а также быстрое купирование симптомов, достижение заживления язвы, предупреждение развития рецидивов и осложнений, хорошая переносимость и безопасность терапии, уменьшение сроков лечения, частоты повторных (контрольных) видеоэзофагогастродуоденоскопий (ВЭГДС) и госпитализаций. Однако это не всегда является возможным, несмотря на наличие широкого выбора схем АХБТ, что и обусловливает актуальность исследования данной проблемы в настоящее время.
Основные факторы, снижающие эффективность АХБТ на современном этапе: нарастающая резистентность Н.pylori к антибактериальным средствам, нерациональное использование антибактериальных препаратов и некорректное их назначение, возникновение побочных эффектов АХБТ с последующей необходимостью назначения дополнительных лекарственных препаратов для их коррекции. Это, в свою очередь, снижает комплайенс пациентов к приему такой терапии. Во всем мире порог эрадикации Н.pylori не достигает необходимого уровня. Существующие схемы тройной АХБТ не гарантируют стабильно максимальный уровень эрадикации Н.pylori. За последние годы эффективность стандартной тройной АХБТ продолжает значительно снижаться и не достигает рекомендованного Маастрихтским соглашением 80% уровня [7, 9, 11].
Неэффективность эрадикационной терапии может быть детерминирована тремя группами факторов: со стороны микроорганизма Н.pylori — резистентностью к антибактериальным средствам, переходом спиралевидных форм бактерий в кокковые, высокой бактериальной нагрузкой, вирулентноcтью штамма, со стороны врача — некорректным назначением АХБТ, использованием многокомпонентных схем терапии с назначением более четырех препаратов и схем, требующих многократного приема в течение суток, а со стороны пациента — низким комплайенсом, гиперсекрецией кислоты в желудке, полиморфизмом генов CYP2C19, MDR1, IL-1β, курением, избыточной массой тела, сахарным диабетом, особенностями изменения слизистой оболочки у людей пожилого возраста.
С учетом резистентности Н.pylori на современном этапе развития медицины подбор антибактериальной терапии среднестатистическим врачом поликлиники или стационара невозможен, поскольку методики определения чувствительности Н.pylori к антибиотикам не входят в его повседневную клиническую практику. Кроме того, отсутствует возможность идентификации индивидуальных генетических детерминант эффективности АХБТ у каждого конкретного больного [1, 19]. Ввиду этого ведется поиск других эффективных возможностей и схем терапии язвенной болезни, ассоциированной с Н.pylori, которые могли бы исключить или значительно уменьшить существующие на сегодняшний день пробелы в АХБТ.
Пути увеличения эффективности АХБТ предложены и рассмотрены в IV Маастрихтском соглашении (2010), основными положениями которого являются: использование двойных доз ингибиторов протонной помпы (ИПП), что повышает эффективность на 6–10 % (рекомендации класса А), увеличение длительности АХБТ до 10–14 дней, вследствие чего эффективность повышается на 5 % (рекомендации класса А), а также применение пробиотиков, что уменьшает частоту нежелательных эффектов (в том числе антибиотикоассоциированной диареи) (рекомендации класса D). За счет отсутствия как первичной, так и вторичной резистентности Н.pylori к препаратам висмута, отсутствия таких побочных эффектов, как антибиотикоассоциированная диарея и дисбиоз кишечника, в ІV Маастрихтском соглашении особое внимание уделено препаратам висмута трикалия дицитрата (ВТД). Рекомендуется использовать препараты висмута в схемах эрадикационной терапии первой и второй линии [2, 4, 7, 9].
Препараты ВТД подавляют жизнедеятельность Н.pylori. Соли висмута субцитрата и субсалицилата были первыми соединениями висмута, показавшими способность ингибировать рост Н.pylori in vitro. ВТД (висмута субцитрат) разрушает бактериальную стенку Н.pylori, ингибирует ферменты бактерий (уреаза, каталаза, липаза, фосфолипаза), предотвращает адгезию к эпителиальным клеткам желудка [1, 7, 16, 19]. При монотерапии антихеликобактерный эффект ВТД составляет до 40 %. Он отличается от реализации такового при приеме антибиотиков и подобен действию антисептиков. Бактерицидное действие развивается быстро путем непосредственного контакта с бактериями. ВТД легко проникает в желудочные ямки и захватывается эпителиоцитами, что позволяет оказывать влияние на кокковые формы и бактерии, находящиеся внутри клеток, которые не доступны для других антибактериальных средств.
Квадротерапия с включением препаратов висмута (ИПП + препарат ВТД + два антибиотика) считается идеальной заменой стандартной тройной терапии и способствует достоверному снижению антибиотикорезистентности Н.pylori.
Препараты ВТД являются единственным антихеликобактерным средством, к которому не было отмечено формирования резистентности у данного микроорганизма [7, 18]. Добавление висмута повышает эффективность эрадикации на 20 %, подчеркивая актуальность данного способа оптимизации АХБТ. При исследовании in vitro наблюдается синергизм действия висмута субцитрата и антибиотиков, в частности, с β-лактамами. Для ВТД также характерен синергизм действия с кларитромицином. Штаммы H.рylori, резистентные к кларитромицину, становятся восприимчивыми при комбинации с висмута цитратом in vitro [19, 20]. В исследовании C.O. Salazaar et al. (2012) классическая квадротерапия с включением ВТД у пациентов, которые не принимали в прошлом лечение, приводила к успешной эрадикации в 97,1 % случаев при длительности АХБТ 14 дней. В проспективном исследовании X. Liang и соавт. (2013) у пациентов с неудачным предыдущим лечением кларитромицином, метронидазолом и фторхинолонами эффективность висмутсодержащих схем квадротерапии составила от 83,8 (с амоксициллином и тетрациклином) до 95,2 % (с амоксициллином и фуразолидоном) [5–7, 13, 19]. Во многом это объясняется многокомпонентным механизмом их воздействия на Н.pylori.
Препараты ВТД обладают многогранным действием, оказывая влияние на различные звенья патогенеза язвенной болезни. Висмута субцитрат характеризуется высокой степенью растворимости, за счет чего препарат способен проникать глубоко в слой слизи, инактивируя микроорганизмы, находящиеся под слизистой оболочкой. Помимо антибактериального к основным фармакологическим эффектам препарата можно отнести также вяжущее и гастроцитопротекторное действие. Таким образом, при применении данных препаратов снижается риск развития рецидива язвенной болезни [6, 8–12].
Кроме того, антибактериальная активность препаратов висмута способствует нормализации микрофлоры кишечника, но в отличие от пробиотиков, при использовании которых увеличение содержания бифидобактерий или лактобактерий является транзиторным, данный эффект остается стабильным в течение 3 месяцев после прекращения лечения [2, 3, 8, 10]. Это, в свою очередь, снижает необходимость дополнительных финансовых затрат на пре- и пробиотические препараты для профилактики антибиотикоассоциированной диареи, а следовательно, повышает комплайенс пациентов к принятию квадротерапии.
В настоящее время арсенал препаратов ВТД (висмута субцитрата) дополнился отечественным препаратом Гастро-Норм® Корпорации ARTERIUM. Препарат является высокоэффективным фармакологическим средством, способствующим восстановлению защитной функции слизистой оболочки верхних отделов пищеварительного тракта, и обладает выраженным бактерицидным действием в отношении Н.pylori. За счет усиления регенерации эпителия и стимуляции кровотока в слизистой оболочке Гастро-Норм® способствует быстрому заживлению ее дефектов, предотвращая рецидивы заболевания.
В клинике ГУ «Национальный институт терапии им. Л.Т. Малой НАМН Украины» проведено открытое сравнительное исследование, целью которого явилось сравнение эффективности препарата Гастро-Норм® и оригинального препарата ВТД у пациентов с язвенной болезнью, ассоциированной с Н.pylori, путем оценки влияния на уменьшение и исчезновение основных клинических признаков заболевания, заживление язвенного дефекта и эрадикацию Н.pylori. Оценочными критериями являлись показатели быстрого уреазного теста и стул-теста на антиген Н.pylori, а также параметры ВЭГДС, отражающие степень выраженности изменений слизистой оболочки гастродуоденальной зоны.
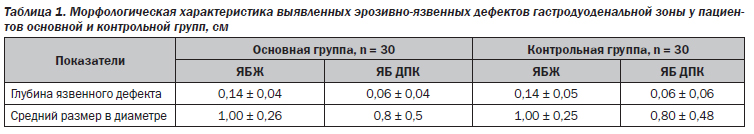
Нами обследовано 60 пациентов с язвенной болезнью, ассоциированной с Н.pylori, средний возраст которых составил 41,2 ± 4,5 года. Среди исследуемых было 35 мужчин и 25 женщин. Все пациенты разделены на 2 группы: основную (30 человек) и группу контроля (30 человек). Среди них 18 пациентов с пептической язвой желудка (ЯБЖ): 9 больных в основной группе и 9 — в контрольной, и 42 пациента с пептической язвой двенадцатиперстной кишки (ЯБ ДПК): по 21 пациенту в каждой группе. Верификация диагноза проводилась с помощью ВЭГДС с биопсией (табл. 1).
Пациенты основной и контрольной групп имели статистически незначимые различия в морфологической характеристике язвенных дефектов слизистой: средний размер (диаметр) язв желудка и двенадцатиперстной кишки в основной группе составлял 1,00 ± 0,26 см и 0,8 ± 0,5 см, в контрольной — 1,00 ± 0,25 см и 0,80 ± 0,48 см соответственно. Не выявлено статистически значимых различий и в глубине язвенных дефектов.
Наличие Н.pylori было подтверждено до начала лечения при помощи уреазного и стул-теста (определение антигена Н.pylori в кале). Также проведены исследования общеклинических показателей.
Все пациенты получали ИПП + амоксициллин в дозе 1000 мг 2 раза в сутки + кларитромицин 500 мг 2 раза в сутки + Гастро-Норм® (по 120 мг 4 раза в день; три раза — за 30 минут до еды и четвертый раз перед сном на протяжении 14 дней) в основной группе и оригинальный препарат ВТД (по 120 мг 4 раза в день; три раза — за 30 минут до еды и четвертый раз перед сном на протяжении 14 дней) — в контрольной.
Оценка клинической эффективности препарата Гастро-Норм® в составе комплексной терапии язвенной болезни, ассоциированной с Н.pylori, в сопоставлении с референтным препаратом ВТД проводилась по единой схеме, состоящей из 5 визитов: 1-й — до лечения; 2-й — на 7-й день от начала лечения; 3-й — на 14-й; 4-й — на 21-е сутки после окончания терапии и 5-й — на 35-е — для выполнения ВЭГДС, уреазного и стул-теста.
Схема обследования пациентов с язвенной болезнью, ассоциированной с Н.pylori, в течение данного исследования включала опрос и осмотр больного с оценкой ведущих клинических синдромов еженедельно. Степень выраженности каждого клинического признака оценивалась по следующей шкале: 0 — отсутствие признака; 1 — слабая степень выраженности; 2 — умеренная; 3 — значительная. Измерение частоты сердечных сокращений и артериального давления, пальпация живота — еженедельно и на 21-й день после окончания лечения; клинико-инструментальное обследование: общеклинические исследования, ВЭГДС (до начала терапии и на 35-й день после ее окончания); степень обсеменения слизистой оболочки желудка и двенадцатиперстной кишки Н.pylori определяли с помощью уреазного и стул-теста (уреазный тест оценивали так: желтое окрашивание среды — результат отрицательный (–), оранжевое — слабо положительный (+), розовое — умеренно положительный (++), красное — резко положительный (+++)) — до начала терапии и на 35-й день после ее окончания.
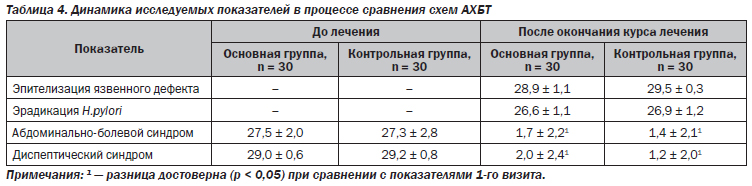
В течение наблюдения на 3–7-й день от начала лечения отмечалась тенденция к улучшению клинической симптоматики (табл. 2).
Купирование болевого синдрома на 2–3-й день от начала терапии наблюдалось у большинства пациентов как основной (96,3 %), так и контрольной групп (98,0 %). Статистически значимых отличий в купировании самостоятельной боли и боли при проведении пальпации живота на фоне проведения сравниваемых схем терапии не выявлено. Длительное сохранение болевого синдрома отмечалось у 26,6 % больных основной группы в сопоставлении с 23,3 % — в контрольной. Болезненность при пальпации живота более 3 дней сохранялась у лишь 14 пациентов в основной и у 11 пациентов в контрольной группе (различия статистически незначимы).
Основным критерием эффективности лечения были результаты эндоскопического контроля в динамике, который проводился на 35-й день после первичной ВЭГДС. У всех больных после окончания курса терапии эндоскопически обнаруживалось рубцевание язвенного дефекта двенадцатиперстной кишки (как в основной, так и в контрольной группах — 100 %). Среди пациентов с ЯБЖ такой результат был достигнут у 8 больных основной и у 9 — контрольной группы. При визуальной оценке состояния слизистой оболочки гастродуоденальной зоны у пациентов обеих групп отсутствовали признаки активного воспаления (отек, гиперемия, контактная кровоточивость). Отмечено также уменьшение воспалительного процесса во время морфологической оценки биоптатов (в 88,2 и 88,9 % случаев в основной и контрольных группах соответственно), о чем свидетельствовало снижение степени инфильтрации эпителия желудка и собственной пластинки плазматическими клетками, что подтверждает выраженные гастроцитопротективные эффекты висмутсодержащих препаратов Гастро-Норм® и референтного препарата ВТД, без значимых статистических отличий. Способность препаратов висмута стимулировать биосинтез простагландина Е2, под действием которого повышается образование муцина и выработка бикарбонат-ионов, образующих защитный мукозно-бикарбонатный барьер, а также улучшение микроциркуляции в оболочке антрального отдела желудка и двенадцатиперстной кишки, что способствует улучшению метаболизма на клеточном уровне, приводила к ускорению регенерации клеток и способствовала восстановлению микроструктуры слизистых оболочек, уменьшению количества соляной кислоты. Кроме того, высокие показатели эпителизации язвенных дефектов при назначении схем АХБТ с включением препарата Гастро-Норм® и референтного препарата ВТД достигнуты благодаря вяжущему действию данных препаратов — способности осаждать белки путем образования с ними хелатных соединений. Таким образом, на поверхности слизистой оболочки желудка и двенадцатиперстной кишки образуется защитная пленка, исключительно на участках с эрозивно-язвенными поражениями, что способствует их скорейшему рубцеванию за счет нейтрализации негативного воздействия кислой среды желудка.
На 35-й день после окончания терапии как в основной, так и в контрольной группах отмечалась положительная динамика показателей эрадикационной способности сравниваемых схем АХБТ по данным уреазного (86,7 и 90 % соответственно) и стул-теста (у 90 и 93,3 % соответственно), без статистически значимой разницы в сравниваемых группах. Из 100 % изначально Н.pylori-позитивных пациентов после проведенного лечения хеликобактериоз выявлен у 13,3 % больных, принимающих в составе АХБТ Гастро-Норм®, и у 10 % — референтный препарат ВТД (табл. 3).
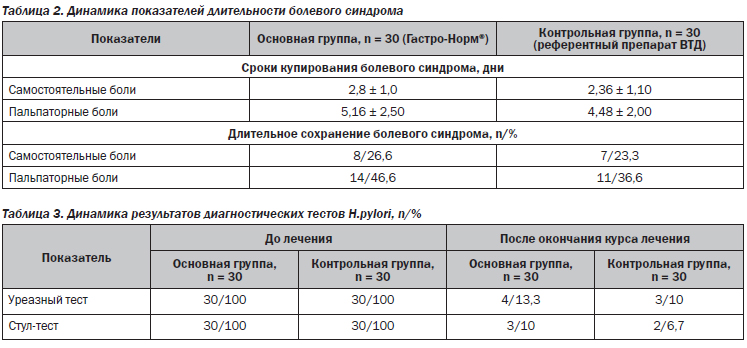
При использовании данных схем АХБТ с включением препаратов висмута отмечаются более высокие показатели эрадикации за счет бактерицидной активности препарата Гастро-Норм® в отношении Н.pylori, которая оказалась сопоставимой с таковой референтного препарата ВТД по результатам данного исследования (статистически значимые различия не выявлены). Несмотря на то, что у некоторых пациентов сохранялись положительные результаты тестов на Н.pylori, рубцевание язвенного дефекта достигнуто в обеих сравниваемых группах (результаты сопоставимы, статистически значимых различий не выявлено), что подтверждает способность препаратов висмута нарушать проницаемость и микроструктуру клеточной мембраны Н.pylori, снижая ее жизнеспособность и способность к дальнейшим адгезии и повреждению слизистой оболочки.
При сравнении двух схем АХБТ в обеих группах отмечается высокая эффективность терапии — клиническая и эндоскопическая ремиссия заболевания (отсутствие клинических симптомов, эпителизация язвенного дефекта, отсутствие гиперемии слизистой оболочки желудка при ВЭГДС) (табл. 4).
Выявлена положительная динамика основных клинических синдромов, проявляющаяся в уменьшении частоты встречаемости, продолжительности и интенсивности основных признаков диспептического и абдоминально-болевого синдромов. Отмечалось регрессирование диспептических явлений на 4–5-й день от начала терапии (у 82,1 % пациентов основной и у 82,8 % — контрольной группы соответственно).
Использование препарата Гастро-Норм® в составе АХБТ способствовало эпителизации язвенного дефекта в короткие сроки, что достоверно подтверждалось при ВЭГДС. Полученные результаты сопоставимы с таковыми в группе контроля при применении референтного препарата ВТД без статистически значимых отличий, что позволяет считать Гастро-Норм® соответствующим по данным параметрам референтному препарату ВТД с преимуществом в стоимости первого.
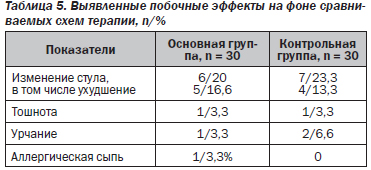
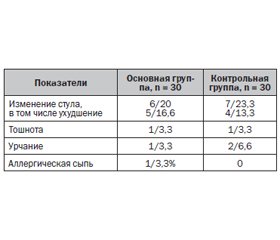
Все больные, принимавшие участие в исследовании препарата Гастро-Норм® в течение 14 дней, отмечали его хорошую переносимость. Переносимость препарата оценивалась по субъективным критериям пациентов и включала наличие или отсутствие неприятных ощущений со стороны различных органов и систем, появление побочных эффектов или аллергических реакций после приема препарата в сопоставлении с референтным препаратом ВТД (табл. 5).
При анализе частоты и выраженности побочных эффектов препарата Гастро-Норм® и референтного препарата ВТД отмечены единичные случаи их возникновения. Наиболее частыми нежелательными реакциями были нарушение стула у пациентов как основной, так и конт–рольной группы. Реже отмечались тошнота и урчание в животе. Аллергическая сыпь наблюдалась у 1 пациента основной группы. Побочные эффекты у больных основной и контрольной группы носили краткосрочный характер, нивелировались самостоятельно в течение 1–2 дней, что не потребовало отмены проводимой терапии.
Комплексное лечение с применением препарата Гастро-Норм® у пациентов с язвенной болезнью, ассоциированной с Н.pylori, на основании субъективных ощущений и динамики объективных клинико-лабораторных и инструментальных критериев всеми пациентами (100 %) оценено как эффективное. Отмечена высокая приверженность пациентов с язвенной болезнью, ассоциированной с Н.pylori, к терапии первой линии в виде квадротерапии с включением препаратов ВТД.
Полученные результаты использования отечественного препарата Гастро-Норм® как компонента современного комплексного лечения язвенной болезни, ассоциированной с Н.pylori, подтверждают высокую клиническую эффективность и положительное влияние на качество жизни пациентов. Этот препарат занял достойное место по сопоставимости эффективности терапии с оригинальным препаратом ВТД.
В данном исследовании подтверждена активность препарата Гастро-Норм® в отношении H.рylori и его способность предотвращать развитие резистентности H.рylori к действию антибиотиков, а также осуществлять эффективную защиту клеток слизистой оболочки от повреждающего действия продуктов воспаления. При применении препарата Гастро-Норм® в комплексной терапии язвенной болезни, ассоциированной с H.рylori, улучшаются показатели эрадикации H.рylori в сравнении с использованием оригинального препарата ВТД.
На основании представленных результатов исследования можно считать препарат Гастро-Норм® эффективным средством, отвечающим современным требованиям, предъявляемым к препаратам с цитотопротективными свойствами, что позволяет рекомендовать его в составе комплексной терапии язвенной болезни, ассоциированной с Н.pylori. Низкая частота побочных эффектов и приемлемая ценовая политика дают основание для его широкого применения в клинической практике. Следовательно, Гастро-Норм® можно рекомендовать как эффективное и доступное лекарственное средство в комплексной терапии первой линии при язвенной болезни, ассоциированной с Н.pylori, с целью оптимизации эффективности АХБТ.
Список литературы
1. Андреев Д.Н., Кучерявый Ю.А. Факторы микро- и макроорганизма, влияющие на эффективность антихеликобактерной терапии // Consilium Medicum. — 2013. — № 8. — С. 5-9.
2. Кучерявый Ю.А., Андреев Д.Н., Баркалова Е.В. Клинико-молекулярные аспекты резистентности Helicobacter pylori к антибактериальным препаратам // Медицинский совет. — 2013. — № 10. — С. 11-15.
3. Маастрихт-4: по материалам XXIV Международного семинара по изучению Helicobacter и родственных бактерий в развитии хронического воспаления пищеварительного тракта и рака желудка (симпозиум «Маастрихт-4». Программа). URL: http://www.helicobacter.org/2011/.
4. Маев И.В., Кучерявый Ю.А., Андреев Д.Н. Причины неэффективности антигеликобактерной терапии // РЖГГК. — 2013. — № 6. — С. 62-72.
5. Маев И.В., Самсонов А.А., Андреев Д.Н., Кочетов С.А. Эволюция представлений о диагностике и лечении инфекции Helicobacter pylori (по материалам консенсуса Маастрихт-IV, Флоренция, 2010) // Вестник практического врача. — 2012. — № 1. — С. 23-30.
6. Маев И.В., Самсонов А.А., Андреев Д.Н. и др. Клиническое значение инфекции Helicobacter pylori // Клиническая медицина. — 2013. — № 8. — С. 4-12.
7. Перфилова К.М., Неумоина Н.В., Неумоина М.В. и др. Изучение резистентности Н.pylori к макролидам у больных с хроническими заболеваниями желудка и двенадцатиперстной кишки // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2012. — № 5 (прил. 40). — С. 37.
8. Скрыпник И.Н. Современная антихеликобактерная терапия: успехи и пути преодоления неудач // Здоров’я Украни. — 2014. — № 3(33). — С. 21.
9. De Francesco V., Ierardi E., Hassan C., Zullo A. Helicobacter pylori therapy: Present and future // World J. Gastrointest. Pharmacol. Ther. — 2012. — Vol. 3 (4). — P. 68-73.
10. Gasparetto M., Pescarin M., Guariso G. Helicobacter pylori Eradication Therapy: Current Availabilities // ISRN Gastroenterol. — 2012. — 2012. — 18673.
11. Kuo C.H., Kuo F.C., Hu H.M. et al. The Optimal First-Line Therapy of Helicobacter pylori Infection in Year 2012 // Gastroenterol. Res. Pract. — 2012. — 2012. — 168361.
12. Malfertheiner P. The intriguing relationship of Н.pylori infection and acid secretion in peptic ulcer disease and gastric cancer // Dig. Dis. — 2011. — Vol. 29. — Р. 459-64.
13. Malfertheiner P., Megraud F., O’Morain C. et al. Management of Helicobacter pylori infection the Maastricht IV. Florence Consensus Report // Gut. — 2012. — Vol. 61, № 5. — P. 646-664.
14. Megraud F., Coenen S., Versporten A. et al. Helicobacter pylori resistance to antibiotics in Europe and its relationship to antibiotic consumption // Gut. — 2013. — Vol. 62 (1). — P. 34-42.
15. Sonnenberg A. Review article: historic changes of Helicobacter pylori-associated diseases // Aliment. Pharmacol. Ther. — 2013. — Vol. 38. — Р. 329-42.
16. Uygun A., Ozel A.M., Sivri B. et al. Efficacy of a modified sequential therapy including bismuth subcitrate as first-line therapy to eradicate Helicobacter pylori in a Turkish population // Helicobacter. — 2012. — Vol. 17 (6). — P. 486-490.
17. Wu W., Yang Y., Sun G. Recent Insights into Antibiotic Resistance in Helicobacter pylori Eradication // Gastroenterol. Res. Pract. — 2012. — 2012. — 723183.
18. Yan T.L., Hu Q.D., Zhang Q., Li Y.M., Liang T.B. National rates of Helicobacter pylori recurrence are significantly and inversely correlated with human development index // Aliment. Pharmacol. Ther. — 2013. — Vol. 37. — Р. 963-8.
19. Yoon J.H., Baik G.H., Kim Y.S. et al. Comparison of the Eradication Rate between 1- аnd 2-Week Bismuth-Containing Quadruple Rescue Therapies for Helicobacter pylori Eradication // Gut Liver. — 2012. — Vol. 6 (4). — P. 434-439.