Статья опубликована на с. 28-32
Актуальность темы
В мире ежедневно от болей страдают более 3,5 млн человек. Из них более 80 % пациентов нуждаются в антиболевой терапии. Это касается и острой физической боли, которая характерна для каждого послеоперационного периода. По данным литературы, от 30 до 50 % всех оперированных больных страдают от сильной боли [1]. Причем наиболее болезненными зонами считаются верхние отделы брюшной полости, где частота сильной или умеренной боли самая высокая и отмечается у более 40 % пациентов. На втором месте по интенсивности и частоте боли находятся операции или повреждения костей (20–25 %), на третьем — ранение мягких тканей, затем операции на грудной клетке и повреждения головы [2].
Операционный стресс служит основой функциональных расстройств, которые продолжают действовать и в послеоперационном периоде [3]. Оптимальная анестезия блокирует передачу и восприятие болевых импульсов, однако по ее окончании возможен «прорыв» боли, влекущий за собой целый ряд неблагоприятных последствий. В связи с этим с первых минут послеоперационного периода должна обеспечиваться мощная антистрессовая защита, включающая адекватную аналгезию, коррекцию объема циркулирующей крови (ОЦК), метаболизма, функции почек и печени, специальные меры респираторной терапии [4]. Некупированная острая боль приводит к повышению ригидности мышц грудной клетки и диафрагмы, гиповентиляции и коллабированию альвеол, гипоксемии [5].
Болевой синдром затрудняет откашливание, нарушает эвакуацию бронхиального секрета, что создает условия для присоединения инфекции.
Острая боль приводит к гиперактивности симпатической нервной системы, что клинически проявляется гипертензией, тахикардией, повышением периферического сосудистого сопротивления. На этом фоне у пациентов высокого риска значительно повышается потребность миокарда в кислороде и, как следствие, вероятность ишемии и инфаркта миокарда [9]. Некупированный болевой синдром приводит к периферической и центральной сенситизации ЦНС, что является причиной формирования хронических нейропатических болевых синдромов [6]. Между тем проблема послеоперационного обезболивания, особенно после обширных травматичных операций, далека от разрешения. По данным литературы, лишь 28–50 % пациентов удовлетворены качеством послеоперационного обезболивания [4].
Проблема эффективности послеоперационной аналгезии не может рассматриваться в отрыве от проблемы ее безопасности, особенно если речь идет о пациенте, перенесшем большое хирургическое вмешательство со всеми его последствиями (травма тканей, кровопотеря, длительная анестезия с искусственной вентиляцией легких (ИВЛ), вынужденное голодание, полимодальная интенсивная терапия и др.). В этих условиях нередко возникают ограничения в применении для послеоперационного обезболивания разных анальгетических средств, способных отрицательно повлиять на состояние оперированного пациента. Опиоидная моноаналгезия в современных хирургических учреждениях фактически не применяется из-за ее многочисленных серьезных побочных эффектов (депрессия сознания, дыхания, гиповентиляция егких, тошнота, рвота, нарушение функции ЖКТ и др.), которые могут приводить к осложнениям. Тем не менее опиоидный анальгетик в безопасной дозе, не приводящей к тяжелым побочным эффектам, является обязательным компонентом всех современных методов системной и регионарной послеоперационной аналгезии [7].
Таким образом, проблема послеоперационного обезболивания должна рассматриваться с позиции не только качества аналгезии, но и безопасности для пациента обеспечивающих ее компонентов [1, 8–10]. По данным Australian and New Zealand College of Anaesthetists (2005), выраженность обезболивающего эффекта парацетамола не отличается от таковой у кеторолака 30 мг, диклофенака 75 мг, метамизола и морфина 10 мг. Это подтверждает, что парацетамол является достаточно эффективным анальгетиком. В отличие от опиоидов и нестероидных противовоспалительных препаратов (НПВП) он не имеет эндогенных рецепторов и практически не подавляет активность циклооксигеназы (ЦОГ). Появляется все больше доказательств центрального антиноцицептивного эффекта парацетамола. Возможно, что он подавляет активность ЦОГ-2 в ЦНС и предупреждает развитие вторичной гипералгезии, повышает активность антиноцицептивной системы, нисходящих тормозных серотонинергических путей. Парацетамол препятствует продукции простагландина на уровне клеточной транскрипции (т.е. независимо от уровня активности ЦОГ).
Появление внутривенной формы существенно повысило ценность препарата и расширило показания к его применению в качестве базисного компонента сочетанной послеоперационной аналгезии. Внутривенная форма по безопасности значительно превосходит таблетированные формы, поскольку отличается лучшей управляемостью плазменной концентрацией препарата в раннем послеоперационном периоде. Это преимущество подтверждается практическими исследованиями, которые обнаружили повышение концентрации парацетамола в плазме в раннем послеоперационном периоде до опасно высоких уровней при пероральном применении по сравнению с внутривенным [12].
Следует соблюдать осторожность при назначении парацетамола больным с тяжелой почечной недостаточностью (клиренс креатинина < 30 мл/мин), с доброкачественными гипербилирубинемиями (в т.ч. синдром Жильбера, вирусный гепатит, алкогольное поражение печени), алкоголизмом, с дефицитом глюкозо-6-фосфатдегидрогеназы, пациентам пожилого возраста. Риск развития повреждений печени возрастает у больных с алкогольным гепатозом. Однако гепатотоксическое действие не является существенной проблемой, так как оно всегда связано с определенным неправильным применением препарата. Токсическая доза парацетамола при однократном приеме составляет 140 мг/кг массы тела, тяжелое поражение печени развивается при разовом приеме 250 мг/кг массы тела. Для групп повышенного риска токсические дозы вдвое меньше [13, 14].
В исследовании F.V. Schiodt et al. (2002) продемонстрировано, что применение парацетамола в терапевтических дозах (4 г в сутки) у больных с хроническими гепатитами и циррозами различной этиологии не приводит к ухудшению функционального состояния печени. По рекомендациям National Kidney Foundation, парацетамол является анальгетиком выбора у пациентов с сопутствующими заболеваниями почек [15–17].
Целью данного исследования стало изучение эффективности, переносимости и безопасности препарата Инфулган («Юрия Фарм») в послеоперационной аналгезии при тотальном эндопротезировании тазобедренного сустава.
Материал и методы исследования
Исследование основано на клинико-лабораторном обследовании и лечении 43 больных коксартрозом 3–4-й степени в возрасте от 42 до 74 лет (женщин — 19, мужчин — 24), поступивших в ОРИТ после проведенной хирургической коррекции коксартроза путем тотального эндопротезирования тазобедренного сустава.
По физическому статусу все больные соответствовали II–III классам ASA. Среди них не было пациентов с анамнезом и клиническими симптомами язвенной болезни, бронхиальной астмы, нарушения функции печени и почек.
Во всех случаях больным проводилось тотальное эндопротезирование тазобедренного сустава. У всех больных применена тактика профилактического введения препарата Инфулган во время вводной анестезии (1 г внутривенно капельно в течение 15 мин) и проведена мультимодальная общая анестезия на основе мидазолама, пропофола, фентанила и кетамина по принятой в клинике методике.
Обезболивание препаратом Инфулган продолжали в послеоперационном периоде в условиях ОРИТ, при необходимости сочетая его с опиоидом средней потенции трамадолом или более мощным опиоидом, в зависимости от травматичности операции. По окончании операций после перевода пациентов в ОРИТ при появлении первых признаков послеоперационной боли осуществляли внутривенную инфузию препарата Инфулган в дозе 1 г. В дальнейшем на фоне базисной аналгезии Инфулганом по показаниям применяли опиоидный анальгетик. Плановая суточная доза препарата Инфулган составляла 4 г. Длительность терапии препаратом Инфулган в подавляющем числе наблюдений не превышала трех дней.
Интенсивность послеоперационной боли оценивали по шкале вербальных оценок — ШВО (0 — боли нет, 1 балл — слабая боль при движении, 2 балла — слабая боль в покое и умеренная при движении, 3 балла — умеренная боль в покое и сильная при движении, 4 балла — сильная боль в покое и очень сильная боль при движении). Учитывали суточную дозу опиоида, необходимую для полноценной аналгезии на фоне плановой терапии препаратом Инфулган. Для объективной оценки качества аналгезии определяли в динамике концентрацию кортизола в плазме крови как показатель стресса. Возможные побочные эффекты анальгетической терапии выявляли путем опроса, клинического исследования пациентов, проведения непрерывного мониторинга АД, ЧСС, SaO2, ЭКГ, динамического наблюдения за показателями билирубина, трансаминаз.
Полученные результаты и их обсуждение
В ОРИТ первые болевые ощущения появлялись у больных не ранее чем через 2 ч от момента окончания операции. На этом этапе, не дожидаясь развития сильной боли, пациентам вводили первую послеоперационную, т.е. вторую по счету дозу препарата Инфулган (1 г). Интенсивность боли у больных перед введением препарата Инфулган была в пределах 2,77–2,8 балла. Спустя 1 ч после инфузии препарата Инфулган (1 г) вновь оценивали интенсивность боли по ШВО и наблюдали за дальнейшей динамикой болевых ощущений. Результаты представлены в табл. 1.
Установлено, что через 1 ч после введения первой послеоперационной дозы препарата Инфулган интенсивность боли снижалась до слабой или незначительной у всех пациентов и применения опиоидного анальгетика не требовалось. Продолжительность анальгетического действия первой послеоперационной дозы препарата Инфулган колебалось от 4 до 8 часов. Плановая терапия препаратом Инфулган позволяла отсрочить введение опиоидного анальгетика в раннем послеоперационном периоде, что важно для полной посленаркозной реабилитации пациента и предотвращения продленной центральной депрессии, неизбежной при рутинной опиоидной послеоперационной аналгезии.
Последующие 2 из 4 разрешенных в течение суток стандартных разовых доз (1 г) препарата Инфулган распределяли по времени до конца первых суток, считая от введения первой предоперационной дозы. Пациенты находились в полном сознании, выполняли все инструкции и рекомендации врача, а при тенденции даже к незначительному усилению боли им вводили опиоидный анальгетик трамадол.
Оценка качества послеоперационного обезболивания наиболее важна на 2-е сутки после операции, когда исключается остаточное действие общей анестезии и послеоперационная боль бывает максимальной.
Поскольку показатели послеоперационной аналгезии (0,4 ± 0,6 балла по ШВО) достигались при минимальной суточной дозе «малого опиоида» трамадола (180 ± 77 мг/сут), то для большинства пациентов было достаточно 2 инъекций по 100 мг и для отдельных пациентов — 1 или 3 инъекций по 100 мг. При этом не выявлялось каких-либо побочных эффектов, которые можно было бы связать с трамадолом.
Показатели послеоперационного обезболивания препаратом Инфулган в сочетании с трамадолом у больных, перенесших травматологические операции, приведены в табл. 2.
Суточная доза трамадола у всех больных составила в среднем от 200 до 300 мг, 2–3 внутримышечные инъекции по 100 мг. Эта доза опиоида в 1,5–2 раза ниже необходимой после подобных операций при монотерапии трамадолом. У всех больных хорошая аналгезия в течение суток (0,60 ± 0,58 балла по ШВО, т.е. отсутствие боли в покое и незначительная боль при движениях и кашле) поддерживалась без каких-либо побочных симптомов анальгетической терапии. Пациенты были контактны, способны глубоко дышать и кашлять, удовлетворены обезболиванием.
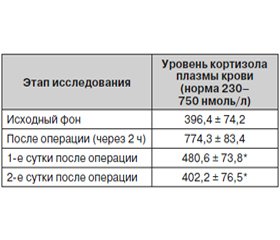
Объективное уточнение благоприятного клинического впечатления от послеоперационного обезболивания препаратом Инфулган в сочетании с трамадолом в травматологии и ортопедии нами проведено у 15 пациентов путем исследования динамики концентрации в плазме крови гормона стресса кортизола (табл. 3).
/30_2.jpg)
Установлено, что исходные уровни гормона были в пределах нормы, составляя в среднем 396,4 ± 74,2 нмоль/л. В пробах крови, взятых у пациентов через 1–2 ч после операции при выраженном болевом синдроме, выявлено достоверное повышение уровня гормона на 95,3 % от исходного, что свидетельствовало о физиологической реакции на внешнее воздействие. Спустя 10–20 мин после внутривенного введения указанных доз препарата Инфулган и трамадола уровень кортизола в крови снизился на 38 %. В течение 2 суток послеоперационного периода содержание кортизола в крови на фоне проводимого обезболивания соответствовало норме, хотя и превышало исходный уровень, что следует расценивать как адекватную, естественную адаптационную реакцию организма оперированных больных.
При установленной в ходе работы хорошей общей и местной переносимости препарата Инфулган и отсутствии клинически выраженных побочных эффектов важным аспектом считали оценку функционального состояния печени на фоне терапии препаратом Инфулган, поэтому у всех пациентов ежедневно выполняли биохимические исследования показателей билирубина и сывороточных трансаминаз — АЛТ и АСТ. Не установлено достоверных изменений этих показателей по сравнению с исходной нормой (табл. 4).
Заключение
Проведенное исследование и новейшие данные специальной литературы указывают на важную роль неопиоидного анальгетика парацетамола в системе мультимодальной защиты пациента от боли в травматологии. Готовая форма парацетамола Инфулган («Юрия Фарм») расширяет возможности обеспечения эффективного и безопасного послеоперационного обезболивания в хирургии при значительном сокращении потребности в опиоидном анальгетике и снижении связанных с ним побочных эффектов, способных осложнить состояние оперированного пациента.
В отличие от традиционного неопиоидного компонента послеоперационного обезболивания, НПВП, Инфулган при аналогичной эффективности не имеет присущего НПВП комплекса побочных свойств, нередко являющегося противопоказанием к их использованию для периоперационной неопиоидной базисной аналгезии. Для парацетамола (препарата Инфулган) существует фактически единственное ограничение — нарушение функции печени, поэтому показания к его назначению оперированным больным с целью обезболивания более широки, чем у НПВП. Таким образом, есть все основания рекомендовать неопиоидный препарат парацетамол для послеоперационного обезболивания, а выбор дозы и сочетания его с другими анальгетиками в каждом конкретном случае следует осуществлять индивидуально в целях безопасности пациента. Такой подход позволяет получить оптимальный результат без побочных эффектов и осложнений.
Список литературы
1. Осипова Н.А., Петрова В.В., Митрофанов С.В., Береснев В.А. и др. Системная и регионарная антиноцицептивная защита пациента в хирургии. Проблема выбора // Анестезиол. и реаниматол. — 2006. — № 4. — С. 12-16.
2. Ермолаев П.М. Анестезиологическое пособие и интенсивная терапия при операциях с микрохирургической аутопластикой в онкологии: Автореф. дис... канд. мед. наук. — М., 2005.
3. Осипова Н.А., Петрова В.В., Митрофанов С.В., Береснев В.А. и др. Средства периферического сегментарного уровня защиты пациента в системе общей анестезии и послеоперационного обезболивания // Анестезиол. и реаниматол. — 2002. — № 4. — С. 14-19.
4. Осипова Н.А., Береснев В.А., Абузарова Г.Р. и др. Нестероидные противовоспалительные препараты (ацелизин) в послеоперационном обезболивании и интенсивной терапии // Анест. и реаниматол. — 1994. — № 4. — С. 41-45.
5. Осипова Н.А., Абузарова Г.Р., Петрова В.В. Принципы клинического применения наркотических и ненаркотических средств при острой и хронической боли: Методические указания. Практическое руководство для врачей. — М.: МНИОИ им. П.А. Герцена, 2004. — 64 с.
6. Овечкин А.М. Адекватность защиты больных от операционной травмы в условиях спинальной анестезии / Овечкин A.M., Гнездилов А.В., Кукушкин М.Л. и др. // Анестезиология и реаниматология. — 2000. — № 3. — С. 4-8.
7. Светлов В.А., Зайцев А.Ю., Козлов С.П. Сбалансированная анестезия на основе регионарных блокад: стратегия и тактика // Анестезиол. и реаниматол. — 2006. — № 4. — С. 4-12.
8. Петрова В.В., Осипова Н.А., Береснев В.А., Долгополова Т.В. Лорноксикам (ксефокам) как средство профилактики и лечения послеоперационного болевого синдрома среди других НПВС // Анестезиол. и реаниматол. — 2005. — № 5. — С. 39-44.
9. Björkman R., Hallman K.M., Hedner Т., Henning M. Acetaminophen blocks spinal hyperalgesia induced by NMDA and substance P // Pain. — 1994. — 57. — 259-264.
10. Breivik H. Postoperative pain: toward optimal pharmacological and epidural analgesia // Pain. — 2002. — Р. 337-349.
11. Осипова Н.А. Антиноцицептивные компоненты общей анестезии и послеоперационной аналгезии // Анестезиол. и реаниматол. — 1998. — № 5. — С. 11-15.
12. Осипова Н.А., Петрова В.В., Митрофанов С.В., Береснев В.А. и др. Средства периферического сегментарного уровня защиты пациента в системе общей анестезии и послеоперационного обезболивания // Анестезиол. и реаниматол. — 2002. — № 4. — С. 14-19.
13. Маркова И.В., Афанасьев В.В., Цыбулькин Э.К., Неженцев М.В. Клиническая токсикология детей и подростков: В 2 т. — СПб.: Интермедика, 1998. — Т. 1. — 302 с.
14. Olson K.R. Poisoning & Drug Overdose. — Stanford, Connecticut: Appleton&Lange, 1999. — 611 p.
15. Whelton A. // Am. J. Therapeut. — 2000. — 7 (2). — 63-74.
16. Henrich W.L. et al. Analgesics and Kidney // AJKD. — 1996. — Vol. 27, № 1. — 162-165.
17. Schiodt F.V., Lee W.M., Bondensen S., Ott P., Christensen E. Influence of acute and chronic alcohol intake on the clinical course and outcome in acetaminophen overdose // Aliment. Pharmacol. Ther. — 2002. — Vol. 16. — P. 707-715.
/30.jpg)
/31.jpg)

/30_2.jpg)