Журнал «Травма» Том 17, №1, 2016
Вернуться к номеру
Эффективность и безопасность лечения больных с остеоартрозом коленных суставов гидролизатом коллагена (FORTIGEL®)
Авторы: Кондратюк В.Е. - Национальный медицинский университет имени А.А. Богомольца, г. Киев, Украина;
Тер-Вартаньян С.Х. - Александровская клиническая больница, г. Киев, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Мета дослідження — оцінити ефективність і безпеку використання проФЛЕКС (Schonen, Швейцарія) — гідролізату колагену (FORTIGEL®) у хворих з остеоартозом колінних суглобів. У відкрите клінічне дослідження включили 30 хворих (8 чоловіків і 22 жінки) віком 45–74 роки (середній вік 59 ± 8 років) з остеоартрозом колінних суглобів, тривалість патології становила в середньому 8,9 ± 6,0 року. Усім хворим на додаток до нестероїдного протизапального препарату було призначено гідролізат колагену (FORTIGEL®) перорально у дозі 10 г на добу. Тривалість лікування — 3 місяці.
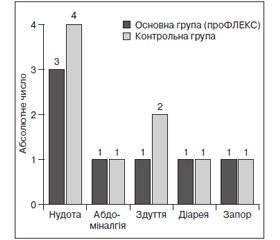
За період спостереження відмічено позитивну динаміку, що підтверджувалася зменшенням суб’єктивного відчуття болю за візуальною аналоговою шкалою наприкінці дослідження на 44 % (р < 0,05) у стані спокою і на 62 % (р < 0,05) при рухах порівняно з контрольною групою. Зниження індексу Лекена було більш виражене — на 48 % (р < 0,05). Більшість пацієнтів відзначали позитивний вплив гідролізату колагену (FORTIGEL®): 10 % — значне покращення, 53 % — помірне поліпшення і 37 % — без змін. В основній групі відзначено більш виражене зниження дози диклофенаку натрію порівняно з контрольною групою в кінці спостереження — на 73 і 47 % відповідно. Суттєвих побічних ефектів, що потребували б відміни питного гідролізату колагену (FORTIGEL®), протягом дослідження не реєструвалося.
проФЛЕКС (гідролізат колагену (FORTIGEL®)) є ефективним та безпечним засобом для комплексного лікування хворих на остеоартроз колінних суглобів.
Цель исследования — оценить эффективность и безопасность применения проФЛЕКС (Schonen, Швейцария) — гидролизата коллагена (FORTIGEL®) у больных с остеоартозом коленных суставов. В открытое клиническое исследование включили 30 больных (8 мужчин и 22 женщины) в возрасте 45–74 года (средний возраст 59 ± 8 лет) с остеоартрозом коленных суставов, продолжительность патологии составляла в среднем 8,9 ± 6,0 года. Всем больным дополнительно к НПВП был назначен гидролизат коллагена (FORTIGEL®) внутрь в дозе 10 г в сутки. Срок лечения — 3 месяца.
За период наблюдения отмечена положительная динамика, что подтверждалось уменьшением субъективного ощущения боли по визуальной аналоговой шкале в конце исследования на 44 % (р < 0,05) в состоянии покоя и на 62 % (р < 0,05) при движениях по сравнению с контрольной группой. Снижение индекса Лекена было более выраженным — на 48 % (р < 0,05). Большинство пациентов отмечали положительное влияние гидролизата коллагена (FORTIGEL®): 10 % — значительное улучшение, 53 % — умеренное улучшение и 37 % — без изменений. В основной группе отмечено более выраженное снижение дозы диклофенака натрия по сравнению с контрольной группой в конце наблюдения — на 73 и 47 % соответственно. Существенных побочных эффектов, требовавших отмены питьевого гидролизата коллагена (FORTIGEL®), в течение исследования не регистрировалось.
проФЛЕКС (гидролизат коллагена (FORTIGEL®)) является эффективным и безопасным для комплексного лечения больных остеоартрозом коленных суставов.
Objective of the study — to assess the efficacy and safety of using рroFLEX (Schonen, Switzerland) — hydrolyzed collagen (FORTIGEL®) in patients with knee osteoarthritis. An open clinical study included 30 patients (8 men and 22 women) aged 45–74 years (mean age 59 ± 8 years) with knee osteoarthritis, the disease duration averaged 8.9 ± 6.0 years. All patients in addition to nonsteroidal anti-inflammatory drug received hydrolyzed collagen (FORTIGEL®)orally at a dose of 10 g per day. Duration of treatment — 3 months.
There was a positive dynamics during treatment period, which was proved by decreasing of patients’ assessment of pain by visual analogue scale at the end of study by 44 % (p < 0.05) at rest, and by 62 % (p < 0.05) on movement compared to the control group. Reduction in Lequesne index was more significant — by 48 % (p < 0.05). Majority of patients reported positive effects of hydrolyzed collagen (FORTIGEL®): 10 % — a significant improvement, 53 % — a moderate improvement and 37 % — unchanged. At the group of observation, there was more pronounced decrease in diclofenac sodium dosage compare to the control group at the end of study — by 73 and 47 %, respectively. No significant side effects requiring discontinuation of hydrolyzed collagen (FORTIGEL®) were recorded during the treatment.
рroFLEX (hydrolyzed collagen (FORTIGEL®)) is an effective and safe preparation for the complex treatment of patients with knee osteoarthritis.
остеоартроз колінних суглобів, гідролізат колагену (FORTIGEL®), ефективність, безпека.
остеоартроз коленных суставов, гидролизат коллагена (FORTIGEL®), эффективность, безопасность.
knee osteoarthritis, hydrolyzed collagen (FORTIGEL®), efficacy, safety.
Статтю опубліковано на с. 35-41
Вступ
Об’єкт та методи дослідження
/36.jpg)
Результати та їх обговорення
/39_2.jpg)
Висновки
1. Bailey A.J., Mansell J.P. Do subchondral bone changes exacerbate or precede articular cartilage destruction in osteoarthritis of the elderly? // Gerontology. — 1997. — Vol. 43. — P. 296-304.
2. Bello A.E., Oesser S. Collagen hydrolysate for the treatment of osteoarthritis and other joint disorders: a review of the literature // Curr. Med. Res. Opin. — 2006. — Vol. 22. — P. 2221-2232.
3. Benito-Ruiz P., Camacho-Zambrano M.M., Carillo-Arcentales J.N. et al. A randomized controlled trial on the efficacy and safety of a food ingredient, collagen hydrolysate, for improving joint comfort // Int. J. Food Sci. Nutr. — 2009. — Vol. 60. — P. 99-113.
4. Bijlsma J.W., Berenbaum F., Lafeber F.P. Osteoarthritis: an update with relevance for clinical practice // Lancet. — 2011. — Vol. 377. — P. 2115-2126.
5. Choi J.A., Gold G.E. MR imaging of articular cartilage physiology // Magn. Reson Imaging Clin. N. Am. — 2011. — Vol. 19. — P. 249-282.
6. Conaghan P.G., Vanharanta H., Dieppe P.A. Is progressive osteoarthritis an atheromatous vascular disease? // Ann. Rheum. Dis. — 2005. — Vol. 64. — P. 1539-1541.
7. Elder S.H., Borazjani A. Effect of collagen hydrolysate on chondrocyte-seeded agarose constructs // Biomed. Mater. Eng. — 2009. — Vol. 19. — P. 409-414.
8. Faria M., da Costa E.L., Gontijo J. et al. Evaluation of the hypotensive potential of bovine and porcine collagen hydrolysates // J. Med. Food. — 2008. — Vol. 11. — P. 560-567.
9. Felson D.T., Lawrence R.C., Dieppe P.A. et al. Osteoarthritis: new insights. Part 1: the disease and its risk factors // Ann. Intern. Med. — 2000. — Vol. 133. — P. 635-646.
10. Henrotin Y., Lambert C., Couchourel D. et al. Nutraceuticals: Do they represent a new era in the management of osteoarthritis? А narrative review from the lessons taken with five products // Osteoarthritis and Cartilage. — 2011. — Vol. 19. — P. 1-21.
11. Hunter D. J., Schofield D., Callander E. The individual and socioeconomic impact of osteoarthritis // Nat. Rev. Rheumatol. — 2014. — Vol. 10. — P. 437–441.
12. Koyama Y., Hirota A.H., Irie S. Ingestion of gelatin has differential effect on bone mineral density and body weight in protein undernutrition // J. Nutr. Sci. Vitaminol. — 2001. — Vol. 47. — P. 84-86.
13. McAlindon T.E., Bannuru R.R., Sullivan M.C. et al. –OARSI guidelines for the non-surgical management of knee osteoarthritis // Osteoarthritis Cartilage. — 2014. — Vol. 22 (3). — P. 363-388.
14. McAlindon T.E., Nuite M., Krishnan N. et al. Change in knee osteoarthritis cartilage detected by delayed gadolinium enhanced magnetic resonance imaging following treatment with collagen hydrolysate: a pilot randomized controlled trial // Osteoarthritis and Cartilage. — 2011. — Vol. 19. — P. 399-405.
15. Moskowitz R.W. Role of collagen hydrolysate in bone and joint disease // Semin. Arthritis Rheum. — 2000. — Vol. 30. — P. 87-99.
16. Ng K.W., Saliman J.D., Lin E.Y. et al. Culture duration modulates collagen hydrolysate-induced tissue remodeling in chondrocyte-seeded agarose hydrogels // Ann. Biomed. Eng. — 2007. — Vol. 35. — P. 1914-1923.
17. Nomura Y., Oohashi K., Watanabe M., Kasugai S. Increase in bone mineral density through oral administration of shark gelatin to ovariectomized rats // Nutrition. — 2005. — Vol. 21. — P. 1120-1126.
18. Oesser S., Adam M., Babel W., Seifert J. Oral administration of (14)C labelled gelatin hydrolysate leads to an accumulation of radioactivity in cartilage of mice (C57/BL) // J. Nutr. — 1999. — Vol. 129. — P.1891-1895.
19. Oesser S., Seifert J. Stimulation of type II collagen biosynthesis and secretion in bovine chondrocytes cultured with degraded collagen // Cell Tissue Res. — 2003. — Vol. 311. — P. 393-399.
20. Pereira D., Peleteiro B.., Araújo J., Branco J. The effect of osteoarthritis definition on prevalence and incidence estimates: a systematic review // Osteoarthritis Cartilage.— 2011. — Vol. 19. — P. 1270–1285.
21. Qvist P., Bay-Jensen A.C., Christiansen C. et al. The disease modifying osteoarthritis drug (DMOAD): is it in the horizon? // Pharmacol. Res. — 2008. — Vol. 58. — P. 1-7.
22. Saiga-Egusa A., Iwai K., Hayakawa T. et al. Antihypertensive effects and endothelial progenitor cell activation by intake of chicken collagen hydrolysate in pre- and mild-hypertension // Biosci. Biotechnol. Biochem. — 2009. — Vol. 73. — P. 422-424.
23. Schunck M., Schulze C.H., Oesser S. Disparate efficacy of collagen hydrolysate and glucosamine on the extracellular matrix metabolism of articular chondrocytes // Osteoarthritis Cartilage. — 2006. — Vol. 14. — S114.
24. Thysen S., Luyten F.P., Lories R.J. Targets, models and challenges in osteoarthritis research // Dis. Model. Mech. — 2015. — Vol. 8 (1). — P. 17-30.
25. Trč T., Bohmova J. Efficacy and tolerance of enzymatic hydrolysed collagen (EHC) vs glucosamine sulphate (GS) in the treatment of knee osteoarthritis (KOA) // Int. Orthop. — 2010. — Vol. 35. — P. 341-348.
26. Zhang Y., Koguchi T., Simizu M. et al. Chicken collagen hydrolysate protects rats from hypertension and cardiovascular damage // J. Med. Food. — 2010. — Vol. 13. — P. 399-405.

/37.jpg)
/38_2.jpg)
/38.jpg)
/39.jpg)
/39_3.jpg)