Статья опубликована на с. 47-54
Остеоартроз (ОА) является предметом пристального внимания специалистов в области ревматологии, внутренней медицины и ортопедии с учетом высокой распространенности данного заболевания в популяции, особенно среди лиц пожилого возраста, и ассоциированной с ним высокой инвалидизации трудоспособного населения. Так, в отчете Всемирной организации здравоохранения о социальных последствиях заболеваний ОА занимает 4-е место среди причин нетрудоспособности у женщин и 8-е — у мужчин [1]. Оценить истинную распространенность ОА достаточно сложно, так как при данном заболевании отсутствует параллелизм между клинической симптоматикой, данными инструментальных методов исследования (рентгенографии суставов, магнитно-резонансной томографии, ультразвуковых методов исследования). Зачастую рентгенологические признаки диагностируются чаще, чем клинические проявления, однако частота и тех, и других увеличивается с возрастом. По литературным данным, среди лиц старше 50 лет клинические или рентгенологические признаки ОА выявляются практически у каждого второго, а в возрастной категории старше 75 лет — у всех без исключения [2]. При этом показано преобладание ОА среди женщин, у которых также отмечается более выраженная клиническая и рентгенологическая симптоматика. Стремительный рост заболеваемости ОА в последние десятилетия можно объяснить увеличением продолжительности жизни и нарастанием доли лиц, имеющих избыточную массу тела [3]. Все чаще в литературе ОА рассматривается как группа патогенетически близких заболеваний, характеризующихся прогрессирующей потерей гиалинового хряща и патологическим ремоделированием субхондральной кости, имеющих различную этиологию, но приводящих, тем не менее, к однотипным биохимическим и клиническим последствиям [4]. Прошедшие десятилетия ознаменовались новым концептуальным подходом в отношении патогенеза ОА, рассматривающим данное заболевание не только как локальную патологию суставов, но и как целостный процесс, затрагивающий многочисленные звенья гомеостаза.
Таким образом, полученные и накопленные на сегодняшний день данные литературы позволяют рассматривать ОА как проблему собственно системной метаболической болезни по сути (R. Apsden, 2008), но в то же время как проблему полиморбидности, приобретающей уже и прогностический характер [5]. Не случайно ОА отнесен к заболеваниям с высоким уровнем коморбидности, характеризующимся, как правило, высоким (6 и более болезней) и средним индексом счета болезней (5–6 болезней) [6]. Так, наряду с ожирением у больных с ОА нередко выявляется патология сердечно-сосудистой системы — артериальная гипертензия и ишемическая болезнь сердца, сахарный диабет.
Взаимосвязь ОА и ожирения, принявшего в последние десятилетия характер эпидемии, не вызывает сомнений. Так, последние исследования по данному вопросу (Richette P., Funk-Brentano T., 2010) продемонстрировали, что превышение индекса массы тела > 27 кг/м2 повышает риск развития ОА на 15 % [7]. Таким образом, не только ожирение, но и избыточную массу тела следует рассматривать как фактор риска ОА. Длительное время в качестве связующего звена между ОА и ожирением рассматривалась механическая связь, обусловливающая быструю изнашиваемость сустава в условиях повышенной нагрузки на суставную поверхность при наличии избыточной массы тела. Вместе с тем имеются данные, свидетельствующие о том, что ожирение нередко ассоциируется с ОА суставов, не испытывающих прямой механической нагрузки, например ОА суставов кисти [8, 9]. В ряде исследований также продемонстрировано, что снижение массы тела способно замедлять прогрессирование ОА, приводя к уменьшению воспаления и болевого синдрома [12]. Таким образом, можно предположить наличие дополнительных механизмов, связанных с ожирением, способных менять метаболизм хрящевой и костной ткани, приводя к развитию ОА [10]. Системное воспаление, характеризующееся гиперпродукцией адипоцитокинов и воспалительных цитокинов, продуцируемых непосредственно жировой тканью, можно рассматривать как альтернативную патогенетическую связь, объединяющую ОА и ожирение.
Современная парадигма лечения ОА направлена на уменьшение воспаления и интенсивности болевого синдрома, замедление прогрессирования заболевания, улучшение суставной функции и, как следствие, повышение качества жизни больных. В соответствии с рекомендациями EULAR (2013) и OARSI (2008) [13, 14], лечение ОА предусматривает использование двух основных классов препаратов:
1. Симптоматических препаратов немедленного действия: нестероидных противовоспалительных препаратов (НПВП), парацетамола, анальгетиков, в том числе опиоидных, а также глюкокортикоидов внутрисуставно.
2. Модифицирующих препаратов замедленного действия (SYSADOA): глюкозамина сульфата, хондроитина сульфата, неомыляемых соединений авокадо и сои, диацереина, препаратов гиалуроновой кислоты для внутрисуставного введения.
В то время как действие симптоматических препаратов направлено на снижение клинических проявлений заболевания и в основном заключается в обезболивающем и противовоспалительном эффектах, препараты замедленного действия оказывают болезнь-модифицирующее действие, предупреждая дальнейшую деградацию хряща за счет противовоспалительного и длительного хондропротективного действия. Более того, показано, что стадийность ОА не влияет на способность хондроцитов синтезировать межклеточный матрикс, которая сохраняется и в далеко зашедших стадиях ОА. Основным направлением хондропротективной терапии являются стимуляция синтеза макромолекул межуточного вещества гиалинового хряща (протеогликанов и коллагеновых волокон) хондробластами и хондроцитами, снижение синтеза и активности провоспалительных цитокинов и металлопротеиназ, что создает предпосылки для активации анаболических процессов в матриксе хряща, увеличивая резистентность хондроцитов к влиянию провоспалительных цитокинов [11]. Преобладание в структуре пациентов с ОА лиц пожилого возраста, наличие коморбидной патологии, необходимость длительного приема препаратов обусловливают высокие требования к безопасности препаратов, используемых при ОА. С учетом прогрессирующей распространенности ожирения и сахарного диабета в популяции особый интерес вызывает вопрос возможности влияния болезнь-модифицирующих препаратов медленного действия на углеводный обмен, индуцируя повышение уровня гликемии и инсулинорезистентности. Так, по мнению некоторых авторов, использование гюкозамина сульфата в терапии ОА способно приводить к нарастанию уровня гликемии и инсулинорезистентности [13, 15–17]. Тем не менее данное утверждение дискутабельно, с учетом отсутствия на сегодняшний день достоверной доказательной базы по данному вопросу, что тем самым подчеркивает актуальность проведения дальнейших исследований в рамках данного вопроса.
Цель исследования: оценить взаимосвязь и динамику показателей инсулинорезистентности и системного воспаления у пациентов с ОА и ожирением, а также эффективность использования симптоматического препарата замедленного действия на основе неомыляемых соединений масел авокадо и сои.
Материалы и методы
На базе отделения ревматологии областной клинической больницы им. И.И. Мечникова нами было проведено открытое когортное клиническое исследование, которое включало 22 пациента (все женщины), средний возраст — 52,60 ± 5,41 года, с установленным диагнозом «остеоартроз» (согласно критериям ACR 1987 г. и приказу Министерства здравоохранения Украины от 12.10.2006 г. № 676 «Клінічний протокол надання медичної допомоги хворим з остеоартрозом»). В исследование включались как стационарные, так и амбулаторные пациенты. Средняя длительность заболевания — 8,90 ± 0,88 года.
Критериями включения выбраны: женщины в возрасте от 40 до 75 лет с ОА коленного сустава I–III ст. (согласно Kellgren-Lawrence) в сочетании с ожирением I–II ст. (ИМТ ≥ 30 кг/м2) при наличии информированного согласия пациента.
Критерии исключения из исследования: ОА ІV ст., воспалительные артропатии, остеопороз I типа, использование симптоматических препаратов замедленного действия в течение последних 6 месяцев, сахарный диабет, другие заболевания, сопровождающиеся костно-хрящевой резорбцией, онкологические заболевания, гемодинамически значимые аритмии и пороки сердца, острая кардиоваскулярная патология, заболевания кишечника (колит, энтерит), скорость клубочковой фильтрации ниже 60 мл/мин/1,73 м2, нарушение функции щитовидной железы (гипо-, гипертиреоз), заболевания крови.
Исследование проводили в соответствии с основными принципами Good Clinical Practice и Хельсинкской декларацией. Все больные подписали добровольное информированное согласие, было принято положительное решение локального этического комитета. Пациенты, принявшие участие в исследовании, случайным образом были разделены на 2 сопоставимые по возрасту и длительности заболевания группы (табл. 1) в зависимости от получаемой терапии. Пациенты 1-й группы (n = 12) получали Пиаскледин в дозе 300 мг (Laboratoires EXPANSCIENCE, Франция) 1 раз в день с дополнительным использованием, при необходимости, НПВС. Пациенты 2-й группы (n = 10) получали НПВС или парацетамол в режиме «по требованию» без применения хондропротекторов в предшествующие 6 месяцев. С учетом того, что максимальный эффект симптоматических препаратов замедленного действия развивается на 8–12-й неделе использования, срок наблюдения составил 3 месяца.
/49.jpg)
Клинический эффект оценивался на основании динамики индексов по ВАШ (визуальная аналоговая шкала) и WOMAC (Western Ontario and McМaster Universities). Активность системного воспаления оценивалась на основании динамики уровня С-реактивного белка (СРБ). Динамика уровня глюкозы в венозной крови, инсулина и инсулинорезистентности оценивалась внутри основной группы. Наличие инсулинорезистентности оценивали путем определения иммунореактивного инсулина в венозной крови натощак с последующим расчетом индекса HOMA-IR по формуле: HOMA-IR = инсулин [сыворотки крови (мкЕД/л) × глюкоза плазмы (ммоль/л)]/22,5. Превышение показателя индекса HOMA-IR > 2,27 расценивалось как наличие инсулинорезистентности. Безопасность использования препарата Пиаскледин оценивалась по наличию жалоб пациентов, связанных с приемом препарата, а также по динамике показателей почечно-печеночного комплекса (аланинаминотрансфераза (АлАТ), аспартатаминотрансфераза (АсАТ), общий билирубин, прямой билирубин, креатинин, мочевина) до начала лечения и через 3 месяца приема препарата.
Оценка клинического эффекта (уменьшение болевого синдрома) и контрольных показателей системного воспаления производилась трижды до начала лечения, на 2-м и на 3-м месяце лечения. Контроль изменения уровня глюкозы, инсулина и инсулинорезистентности внутри основной группы производился двукратно: в начале исследования (до получения терапии) и в конце исследования — на 3-м месяце лечения.
Статистический анализ результатов проводился с помощью Microsoft Excel 2010 (Microsoft), программного продукта STATISTICA 6.1 (StatSoft Inc., лицензионный номер № AGAR909E415822FA) с расчетом средней величины М, среднеквадратичного отклонения, стандартной ошибки средней величины m, значения вероятности (р). Количественные показатели представлены в виде n, M ± m, где n — количество наблюдений, М — среднее, m — стандартная ошибка средней величины. Достоверность различий определяли с помощью t-критерия Стьюдента для непараметрических данных. Критическое значение уровня значимости (p) ≤ 0,05.
Результаты
В обеих группах наблюдения к концу 3-го месяца было продемонстрировано снижение интенсивности боли в коленных суставах согласно ВАШ с достоверным снижением (p < 0,01) среди пациентов основной группы. Максимальный эффект отмечался в отношении уменьшения выраженности боли при нагрузке — снижение на 40,7 % по сравнению с исходным значением, с некоторым отставанием эффекта в отношении боли покоя — снижение на 36,4 % к концу 3-го месяца (рис. 1А). При этом начало анальгетического эффекта среди пациентов основной группы отмечалось уже на 2-м месяце, с преимущественным уменьшением выраженности боли при нагрузке — на 22,2 % по сравнению с исходным уровнем. Несколько иная динамика прослеживалась среди пациентов контрольной группы, где боль при нагрузке уменьшилась на 10,5 %, боль покоя — на 12,1 % по сравнению с исходными величинами (рис. 1Б).
Через 3 месяца от начала исследования отмечены достоверное (р < 0,05) снижение выраженности болевого синдрома и улучшение функционального состояния (затруднение повседневной активности, ограничение подвижности) среди пациентов основной группы наблюдения, без значимой динамики данных показателей в группе контроля (рис. 2). Наиболее ранний эффект, по мнению пациентов, был отмечен в отношении уменьшения выраженности боли и облегчения затруднения повседневной активности к концу 2-го месяца лечения с дальнейшим нарастанием эффекта в ходе исследования. К концу 3-го месяца в основной группе интенсивность болевого синдрома снизилась в 1,5 раза (на 33,1 %), ограничение подвижности и затруднение повседневной активности — на 29,3 и 24,7 % соответственно по сравнению с исходными значениями (рис. 2А). В группе контроля при этом не было выявлено достоверных изменений по изучаемым показателям (рис. 2Б).
/50.jpg)
Анализ показателей липидного спектра продемонстрировал наличие тенденции к высокой встречаемости гипертриглицеридемии и гиперхолестеринемии среди пациентов с ОА и ожирением. Средний уровень холестерина среди пациентов обеих групп в начале исследования составил 5,30 ± 0,17 ммоль/л, триглицеридов — 1,80 ± 0,19 ммоль/л. При этом детальный анализ в группах наблюдения выявил незначительное превышение референтного значения холестерина (≥ 5,2 ммоль/л) у 41,7 % пациентов основной группы (среднее значение — 5,80 ± 0,15 ммоль/л) (p > 0,05) и у 30 % группы контроля (среднее значение 5,70 ± 0,16 ммоль/л) (p > 0,05). Превышение референтной нормы триглицеридов (≥ 1,7 ммоль/л) было выявлено у 33,3 % (среднее значение — 2,10 ± 0,22 ммоль/л) в основной группе и у 30 % контрольной группы (среднее значение — 1,90 ± 0,15 ммоль/л). Изучение данных показателей в ходе исследования не продемонстрировало значимой динамики к концу 3-го месяца исследования (рис. 3).
/51.jpg)
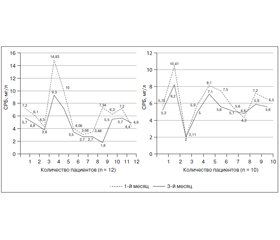
Исходные показатели уровня СРБ продемонстрировали высокую встречаемость превышения референтного значения уровня СРБ (> 6 мг/л) у пациентов с ОА и ожирением как в основной группе, так и в группе контроля (58,3 и 50,0 % соответственно). К концу 3-го месяца наблюдения среди пациентов основной группы было продемонстрировано достоверное снижение уровня СРБ на 25,9 % (p < 0,001) по сравнению с исходными значениями (6,30 ± 0,96 и 4,70 ± 0,65 мг/л соответственно) (p < 0,001) (рис. 4).
Нормализация уровня СРБ была достигнута у 5 из 7 пациентов с исходно повышенным уровнем СРБ. В группе контроля также отмечалась тенденция к уменьшению уровня СРБ к концу исследования, продемонстрировавшая снижение уровня изучаемого показателя на 14 % по сравнению с исходными величинами. Нормативное референтное значение уровня СРБ среди пациентов группы контроля к концу наблюдения было достигнуто у 3 пациентов из 5.
По результатам нашего исследования, наличие ожирения (ИМТ ≥ 30 кг/м2) среди пациентов обеих групп нередко приводило к развитию инсулинорезистентности на фоне тенденции к превышению нормального уровня глюкозы натощак. Среднее значение уровня глюкозы натощак среди пациентов обеих групп в начале исследования составило 5,40 ± 0,14 ммоль/л с превышением порога референтной нормы (3,3–5,5 ммоль/л) у 31,8 % пациентов, принявших участие в исследовании. При этом превышение нормальных значений глюкозы в венозной крови отмечалось у 4 пациентов основной группы (среднее значение 6,00 ± 0,26 ммоль/л) и у 3 — в группе контроля (среднее значение 5,90 ± ± 0,29 ммоль/л). К концу наблюдения значимой динамики по данному показателю в обеих группах не было зарегистрировано, он составил в основной группе 5,30 ± 0,23 ммоль/л, а в контрольной — 5,20 ± 0,22 ммоль/л (p > 0,05).
Для оценки возможного влияния терапии препаратом неомыляемых соединений масел авокадо и сои на углеводный обмен, уровни инсулина и инсулинорезистентности среди пациентов основной группы был проведен анализ динамики данных показателей в начале и конце исследования. Так, в начале исследования средний уровень инсулина составил 12,60 ± 1,52 мкЕд/мл,
что не превышало диапазон нормальных значений (N = 2,6–24,9 мкЕд/мл), в то время как индекс HOMA-IR несколько превышал допустимые значения (N ≥ 2,73), среднее значение — 3,00 ± 0,37. Превышение референтной нормы индекса HOMА-IR приравнивалось к наличию инсулинорезистентности, что было зафиксировано у 7 пациентов основной группы (58,3 %) со средним значением индекса HOMA-IR 3,80 ± 0,36. При этом наличие инсулинорезистентности нередко коррелировало с повышением уровня глюкозы в венозной крови, что было зафиксировано в 57,1 % случаев инсулинорезистентности. Повторное определение уровня инсулина с расчетом индекса HOMA-IR в конце исследования не выявило достоверной динамики данных показателей (табл. 2). Несмотря на то, что средние значения индекса HOMA-IR в начале и конце исследования не имеют достоверных различий, была продемонстрирована нормализация данного показателя у 2 из 7 пациентов основной группы с исходной инсулинорезистентностью.
За период наблюдения в обеих группах не зарегистрировано каких-либо значимых изменений в показателях, оценивающих функцию печени и почек, требующих снижения дозировки препарата или его отмены (табл. 3).
Среди побочных эффектов, ассоциированных с приемом препарата, 2 пациента основной группы отмечали послабление стула, что было связано с нарушением режима приема препарата (прием Пиаскледина на голодный желудок). После коррекции режима приема вышеуказанное побочное действие препарата самостоятельно прошло и не требовало отмены препарата.
Результаты нашего исследования позволяют причислить препарат Пиаскледин к нейтральным препаратам в отношении влияния на углеводный обмен, что может быть рассмотрено как преимущество среди препаратов данного класса при лечении пациентов с остеоартрозом в сочетании с ожирением.
Выводы
1. В ходе исследования продемонстрирован симптом-модифицирующий эффект препарата неомыляемых соединений масел авокадо и соевых бобов, заключающийся в достоверном снижении выраженности боли как при физической нагрузке, так и в покое среди пациентов основной группы на фоне улучшения функционального состояния суставов. При этом наличие ожирения можно рассматривать как фактор, замедляющий развитие анальгетического эффекта, более выраженного в отношении снижения боли покоя.
2. Использование симптоматического препарата замедленного действия Пиаскледин у пациентов с ОА и ожирением продемонстрировало положительное влияние в отношении снижения уровня системного воспаления на фоне уменьшения болевого синдрома со стороны коленных суставов. При этом снижение СРБ как маркера системного воспаления и начальные проявления обезболивающего действия в отношении суставного синдрома зарегистрированы начиная со 2-го месяца лечения с потенцированием действия в ходе дальнейшего лечения.
Список литературы
1. Курята А.В., Черкасова А.В., Гармиш И.П. Эффективность препарата Пиаскледин в комплексной терапии у пациентов с остеоартрозом в условиях коморбидности // Травма. — 2015. — Т. 16, № 4. — С. 15-20.
2. Бадокин В.В. Остеоартроз: современное состояние проблемы и тактика лечения // РМЖ. — 2012. — № 7. — С. 376380.
3. Очертяная Н.С. Хондропротекторы при заболеваниях суставов: здоровье, которое дарит природа / Н.С. Очертяная // Здоров’я України. — Сентябрь 2012. — С. 78.
4. Головач И.Ю. Остеоартрит: перезагрузка взглядов на патогенез заболевания. Что важно для реальной клинической практики? // Здоров’я України. Тематичний номер: Ревматологія: наука — практиці. — Лютий 2014. — С. 66-68.
5. Насонова В.А. Остеоартроз — проблема полиморбидности // Український медичний часопис. — 2009. — № 6(74). — С. 81-83.
6. Курята А.В., Лысунец Т.К., Зайченко А.В., Черкасова А.В. Боль и проблема безопасности НПВС. — Днепропетровск: Герда, 2014. — С. 26-30.
7. Шуба Н.М., Воронова Т.Д., Тарасенко Т.М., Крилова А.С. Нові аспекти патогенезу остеоартрозу та шляхи його корекції // Український медичний часопис. — 2012. — № 2(88). — С. 113-119.
8. Головач І.Ю. Остеоартрит, індукований ожирінням: мультифакторіальні асоціації та провідна роль адипокінів, дисліпідемії й механічного навантаження // Травма. — 2015. — Т. 16, № 4. — С. 70-78.
9. Насонова В.А., Денисов Л.Н. Ожирение и остеоартроз // Здоров’я України. Тематичний номер: Ортопедія. Міждисциплінарні проблеми. — Лютий 2011. — С. 20-21.
10. Полякова Ю.В., Сивордова Л.Е., Ахвердян Ю.Р. и др. Коррекция массы тела как эффективный метод лечения остеоартроза // Лечащий врач. — Апрель 2015. — № 4. — С.32-35.
11. Бадокин В.В. Пиаскледин — хондропротективный препарат с антицитокиновой активностью // Consilium Medicum. — 2007. — № 8.
12. Wluka A.E., Lombard C.B., Cicuttini F.M. Tackling obesity in knee ostheoarthritis // Nat. Rev. Rheumat. — 2013. — № 9. — Р. 225-235. — doi: 10.1038/nrrheum.2012.224
13. Christensen R., Bartels E.M., Astrup A., Bliddal H. Symptomatic efficacy of avocado-soybean unsaponifiables (ASU) in osteoarthritis (OA) patients: a meta-analysis of randomized controlled trials. Osteoarthritis and Cartilage // OARS, Osteoarthritis Research Society. — 2008. — Vol. 16(4). — Р. 399-408.
14. Fernandes L., Hagen K.B., Bijlsma J.W., Andreassen O., Christensen P., Conaghan P.G. et al. EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis // Ann. Rheum. Dis. — 2013. — Vol. 72. — Р. 1125-1135.
15. Dostrovsky N.R., Towheed T.E., Hudson R.W., Anastassiades T.P. The effect of glucosamine on glucose metabolism in humans: a systematic review of the literature // Osteoarthritis Cartilage. — 2011. — Vol. 19, № 4. — P. 375-380.
16. Biggee B.A., Blinn C.M., Nuite M., Silbert J.E., McAlindon T.E. Effects of oral glucosamine sulphate on serum glucose and insulin during an oral glucose tolerance test of subjects with osteoarthritis // Ann. Rheum. Dis. — 2006. — Vol. 66(2). — Р. 260-262.
17. Pham Т., Cornea А., Blick K.E., Jenkins A., Scofield R.H. Oral glucosamine in doses used to treat osteoarthritis worsens insulinresistance // American Journal of the Medical Sciences. — 2007. — Vol. 333, № 6. — Р. 333-339.
/49.jpg)
/51.jpg)

/50.jpg)
/52.jpg)
/52_2.jpg)