Статья опубликована на с. 88-92
Введение
Отморожения наносят немалый медико-социальный ущерб обществу вследствие неподъемных финансовых затрат на лечение такой холодовой травмы, высокого уровня стойких потерь трудоспособности и относительно частой утраты конечностей [6, 7]. Проблемы надежного прогнозирования дальнейшего течения отморожений и эффективности лечебных мероприятий относятся к актуальным в хирургической практике [1, 3, 9]. Лечение криотравмы вызывает трудности и зачастую становится неэффективным [6, 8]. Вместе с тем внедрение новых методов оперативных вмешательств и консервативной терапии отморожений позволило существенно сократить число случаев ампутаций конечностей [11, 12]. Стандарт лечения холодовой травмы базируется на понимании того, что морфофункциональным субстратом отморожений является стойкий спазм артерий на участке охлаждения [2]. Имеет место большое количество способов реконструктивных хирургических операций на отмороженных конечностях [4, 5, 10].
Цель и задачи исследования: оценить эффективность традиционных методов хирургического и консервативного лечения холодовой травмы, установить клинические, инструментальные и лабораторные факторы, ее определяющие, выделить прогностические критерии.
Материалы и методы
Под наблюдением находились 147 больных с холодовой травмой в возрасте от 16 до 79 лет (в среднем 43,6 ± 1,21 года), среди которых было 87 % мужчин и 13 % женщин, в возрасте 43,70 ± 1,25 года и 42,80 ± 4,28 года соответственно. Среди наблюдаемых пострадавших от холодовой травмы лиц различные методы оперативного лечения выполнены у 71 больного (48,3 %), которые составили основную группу. Контрольная группа пациентов (76 человек, или 51,7 % от общего числа) получала только консервативное лечение ран, медикаментозные средства (антиагреганты, антикоагулянты, спазмолитики, вазопростан, тивортин, солкосерил, инфузии глюкозо-новокаиновой смеси, новокаиновые блокады и пр.), ультрафиолетовое облучение крови, гипербарическую оксигенацию или локальную терапию низким давлением (переменный либо постоянный вакуум). Необходимо подчеркнуть, что обе группы обследованных травмированных лиц достоверно не отличались между собой по использованию всех консервативных лечебных мероприятий, что продемонстрировала непараметрическая статистика Макнемара — Фишера. Вместе с тем лица, которым проведены оперативные вмешательства, оказались на 7,5 года старше (соответственно 47,50 ± 1,68 года и 40,00 ± 1,66 года; t = 3,13; p = 0,002). В основной группе число операций составило от 1 до 6 у одного больного (в среднем 2,60 ± 0,14), а количество видов хирургических вмешательств — от 1 до 4 (в среднем 1,80 ± 0,09). Интегральная степень тяжести холодовой травмы (Ω) составила 3,300 ± 0,401 ± 0,033 о.е., которую определяли по формуле: Ω = ln (a2 + b2 + 2c + d), где ln — десятичный логарифм, a — максимальная степень отморожения, b — распространенность площади поражения сегментов тела, c — дистально-проксимальная распространенность поражения конечностей, d — анатомическая тяжесть поражения.
Результаты лечебных мероприятий оценивали по 4-балльной системе: 1 балл — высокая ампутация конечности, 2 балла — умеренная ампутация конечности, 3 балла — ампутация пальцев, 4 балла — полное сохранение анатомической функции. Интегральную эффективность лечения (Ξ, о.е.) определяли по формуле: Ξ = {Q × [(S1 – S2) : S] × 100} : J, где Q — количество баллов по результатам лечения, S — относительная площадь приживления трансплантата, S1 — первичная величина площади трансплантата, S2 — площадь трансплантата через неделю после трансплантации, J — обратный логарифм (1/ln) количества дней пребывания в стационаре.
Для оценки состояния периферического кровотока и микроциркуляции у пострадавших с холодовой травмой использовали ультразвуковую допплерографию (аппарат Logidop-4, Kranzbuhler, Германия) и лазерную допплеровскую флоуметрию («ЛАКК-02, «Лазма», Россия). Используя биохимические анализаторы BS200 (Китай) и Olympus-AU640 (Япония), в сыворотке крови исследовали уровни общего белка, альбуминов, С-реактивного протеина, фибриногена, креатинина, мочевины, протромбинового индекса, времени рекальцификации, толерантности плазмы к гепарину и активности креатинкиназы. Интегральную степень изменения лабораторных показателей (Ψ) определяли по формуле:
где М1 — конкретный показатель у больного, М2 — средний показатель у больных, SD — стандартное отклонение показателя. Измененным значением считали Ψ > 2 о.е.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, непараметрического, корреляционного, регрессионного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica StatSoft, США). Оценивали средние значения (M), их стандартные ошибки (m), стандартные отклонения (SD), коэффициенты корреляции (r), критерии множественной регрессии (R), дисперсии (D), Стьюдента (t), Уилкоксона — Рао (WR), Макнемара — Фишера (χ2) и достоверность статистических показателей (р).
Результаты и их обсуждение
По всем изученным параметрам представители основной группы отличались от контрольной более выраженными изменениями. Так, в основной группе пострадавших от криотравмы лиц констатированы достоверно большие на 29 % (t = 2,09; p = 0,038) показатели анатомической тяжести холодовой травмы (WA), на 25 % (t = 3,44; p = 0,001) — распространенности поражений по длине конечности (PL), на 16 % (t = 2,12; p = 0,036) — распространенности по площади отморожений (PA), на 38 % — Ψ (t = 2,49; p = 0,014), на 56 % (t = 3,57; p = 0,001) — индекса пульсации сосудов (PI), на 33 % (t = 3,32; p = 0,002) — индекса сосудистой резистентности (RI), на 11 % (t = 3,34; p = 0,002) — критерия микроциркуляции (CmC), но на 23 % (t = 3,34; p = 0,002) оказались меньшими значения параметра вариации сосудов (CV) и на 60 % (t = 3,98; p < 0,001) — лодыжечно-плечевого индекса (SI).
Ампутации конечностей выполнены 26 (17,7 %) больным, ампутации пальцев — 35 (23,8 %), а полное сохранение анатомической функции отмечено в 86 (58,5 %) случаях. У мужчин результаты лечения оказались более травматичными (χ2 = 96,93; p < 0,001). В основной группе пациентов травматизация конечностей к концу лечения была большей, но и тяжесть патологического процесса у них явно превалировала (Ω составила 3,50 ± 0,04 о.е. и 3,10 ± 0,04 о.е. соответственно; t = 6,17; p < 0,001).
Частота отдельных видов оперативного лечения холодовой травмы в убывающем порядке была следующей: ампутация пальцев ног выполнена в 42,3 % случаев, пальцев рук — в 33,8 %, дермопластика — в 28,2 %, некротомия — в 23,9 %, некрэктомия — в 18,3 %, ампутация стоп — в 15,5 %, реампутация конечностей — в 5,6 %, ампутация ног — в 4,2 %, ампутация кистей — в 2,8 %.
По данным дисперсионного анализа, возраст пострадавших от холодовой травмы оказывает влияние на результаты лечебных мероприятий (D = 2,94; p = 0,035), а корреляционный анализ при этом показывает обратную связь (r = –0,234; p = 0,004). В группе больных до 20 лет наблюдались относительно неплохие результаты, причем полное восстановление функции конечностей имело место вдвое чаще, чем у пациентов в возрасте после 50 лет. На параметры Ξ влияют возраст больных, сопутствующая сердечно-сосудистая и дыхательная патология (соответственно D = 4,87, p = 0,003, и D = 3,26, p = 0,023). Результаты лечебных мероприятий не связаны с исходными значениями РА, но высокодостоверно (p < 0,001) определяются параметрами PL (D = 14,55), WA (D = 11,50) и Ω (D = 17,40), от которых существует обратная зависимость (p < 0,001) уровня Ξ (соответственно R = –5,69, R = –4,96, R = –6,83). В целом, по данным анализа множественной регрессии, Ξ отрицательно связана с характером холодовой травмы (R = –9,87; p < 0,001).
Ξ разнонаправленно регрессионно зависит от кардиоваскулярных (R = –40,92; p < 0,001) и допплерографических сосудистых параметров (R = +9,89; p = 0,001). Как показал ANOVA, на Ξ влияют уровни PI, RI, SI и CmC, а по данным регрессионного анализа Ξ зависит от показателей PI, RI, CmC и CV, что представлено в табл. 1. C учетом дисперсионно-регрессионного анализа мы считаем, что прогнозпозитивными показателями в отношении эффективности дальнейшего лечения отморожений являются PI < 1,7 o.e., RI < 0,4 o.e., CmC < 2,3 o.e. (< M-SD больных).
/90.jpg)
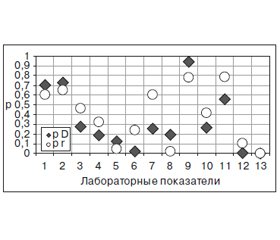
На Ξ оказывает дисперсионное воздействие интегральный показатель Ψ (D = 3,98; p = 0,009), с которым существует также негативная регрессионная связь (R = –3,42; p = 0,001). При этом, как свидетельствует многофакторный анализ Уилкоксона — Рао, Ξ влияет на интегральную динамику лабораторных параметров (WR = 4,13; p < 0,001). На значения Ξ оказывают воздействие исходные показатели скорости оседания эритроцитов (D = 8,67; p < 0,001), уровни в крови С-реактивного протеина (D = 9,36; p < 0,001), фибриногена (D = 3,95; p = 0,010), креатинина (D = 3,00; p = 0,033), толерантности плазмы к гепарину (D = 21,62; p < 0,001) и активность креатинкиназы (D = 24,04; p < 0,001). Существуют прямые корреляционные связи Ξ с концентрацией креатининемии (r = +0,211; p = 0,010), параметрами протромбинового индекса (r = +0,198; p = 0,016) и толерантности плазмы к гепарину (r = +0,545; p < 0,001), а обратные — со скоростью оседания эритроцитов (r = –0,379; p < 0,001), с содержанием С-реактивного белка (r = –0,403; p < 0,001), фибриногена (r = –0,276; p = 0,001) и с активностью креатинкиназы (r = –0,574; p < 0,001) (рис. 1).
Регрессионный анализ показал обратные связи Ξ с динамикой уровня фибриногенемии и активности креатинкиназы. Необходимо отметить, что если концентрация фибриногена в крови больных криотравмой до лечения составляла 2,930 ± 0,107 г/л, то к моменту выписки из стационара она была равна 2,880 ± 0,101 г/л (t = 2,34; p = 0,021), а активность креатинкиназы — соответственно 147,70 ± 1,39 Е/л и 146,70 ± 1,27 Е/л (t = 2,77; p = 0,007 с учетом равного количества наблюдений в вариационных рядах). Таким образом, как продемонстрировали выполненные вариационный, дисперсионный, регрессионный и корреляционный анализы, прогностическими факторами могут обладать исходные показатели фибриногена и креатининкиназы, а соответствующими позитивными критериями в отношении дальнейших лечебных мероприятий будут значения фибриногена < 1,6 г/л и креатининкиназы < 130 Е/л (< M-SD больных).
Следующим этапом нашей работы стала оценка эффективности хирургических мероприятий при холодовой травме (ΞХ). На ΞХ влияет количество видов оперативных вмешательств (D = 4,99; p = 0,004), и данный показатель обратно коррелирует со средним числом выполненных операций у одного больного (r = –0,303; p = 0,011). Как и предполагалось, наблюдается позитивная зависимость ΞХ от проведенных дермопластик (R = +5,14; p < 0,001) и негативная — от числа крупных ампутаций конечностей (R = –3,23; p = 0,002).
Анализ множественной регрессии демонстрирует высокодостоверную (p < 0,001) отрицательную зависимость ΞХ от интегральной характеристики холодовой травмы (R = –7,35) и сосудистой патологии (R = –25,18). Дисперсионно-регрессионные связи ΞХ касаются значений PL (D = 8,78; p < 0,001; R = –3,60; p = 0,001), WA (D = 5,17; p = 0,003; R = –3,36; p = 0,002) и Ω (D = 7,27; p < 0,001; R = –3,59; p = 0,001). Существуют обратные корреляционные связи ΞХ с параметрами вегетативного индекса (r = –0,373; p = 0,048) и PI (r = –0,390; p = 0,046).
ΞХ зависит от Ψ (R = –2,19; p = 0,032). Среди отдельных лабораторных показателей негативно влияют на Ξ исходные значения С-реактивного протеина и активности креатининкиназы, а позитивно — состояние толерантности плазмы к гепарину, что отражено на рис. 2. Уровень Ξ прямо коррелирует с параметрами альбуминемии (r = +0,316; p = 0,048) и креатининемии (r = +0,316; p = 0,048), а обратно — с активностью креатинкиназы (r = –0,497; p = 0,001).
Выводы
1. Ампутации конечностей проведены 18 % от числа больных с холодовой травмой, ампутации пальцев — 24 %, а полное сохранение анатомической функции рук и ног констатировано у 59 % пострадавших.
2. Эффективность лечения женщин с отморожениями лучше, чем мужчин, а с повышением возраста больных результаты лечебных мероприятий ухудшаются, негативно зависят от параметров тяжести отморожений, наличия сопутствующей сердечно-сосудистой и дыхательной патологии, степени нарушений кровотока в сосудах.
3. Результаты лечения пострадавших от криотравмы тесно связаны с интегральными изменениями исходных лабораторных показателей (уровней белков, небелковых азотистых продуктов, параметров коагуляции крови, активности в ней креатинкиназы), которые могут обладать прогностической значимостью в отношении дальнейших оперативных вмешательств.
Список литературы
1. Banzon T.M. Frostbite and chilblains in upton sinclair’s the jungle / T.M. Banzon, S.A. Norton // JAMA Dermatol. — 2015. — Vol. 151, № 4. — P. 421-426.
2. Chen X.J., Xing J.P., Yao X.W. The reverse flow island flap nourished by sural nerve nutrition blood vessel for repair of severe frostbite of feet / X.J. Chen, J.P. Xing, X.W. Yao // Zhonghua Zheng Xing Wai Ke Za Zhi. — 2015. — Vol. 21, № 4. — P. 269-271.
3. Ezquerra-Herrando L. Amputation level after frostbite: role of bone scan. A case report / L. Ezquerra-Herrando, E. Corella-Abenia, J.M. Zamora-Rodríguez [et al.] // Cir. — 2013. — Vol. 81, № 4. — P. 353-356.
4. Fodor M. Simultaneous extended ALT flaps for foot salvage after severe frostbite / M. Fodor, O. Bota, L. Fodor // J. Burn Care Res. — 2015. — Vol. 17, № 8. — P. 173-178.
5. Grasu B.L. Use of diagnostic modalities for assessing upper extremity vascular pathology / B.L. Grasu, C.M. Jones, M.C. Murphy // Hand Clin. — 2015. — Vol. 31, № 1. — P. 1-12.
6. McIntosh S.E. Wilderness medical society practice guidelines for the prevention and treatment of frostbite: 2014 update / S.E. McIntosh, M. Opacic, L. Freer [et al.] // Wilderness Environ. Med. — 2014. — Vol. 25, № 4. — P. 43-54.
7. Nygaard R.M. The Hennepin score: Quantification of frostbite management efficacy / R.M. Nygaard, A.B. Whitley, R.M. Fey, A.I. Wagner // J. Burn. Care Res. — 2015. — Vol. 3, № 11. — P. 150-156.
8. Petrone P. In brief: Hypothermia / P. Petrone, J.A. Asensio, C.P. Marini // Curr. Probl. Surg. — 2014. — Vol. 51, № 10. — P. 414-415.
9. Roussel L.O. Tweens feel the burn: «salt and ice challenge» burns / L.O. Roussel, D.E. Bell // Int. J. Adolesc. Med. Health. — 2015. — Vol. 22, № 4. — P. 141-147.
10. Snoap T., Gallagher E., Snoap A., Ruiter T. Bilateral frostbite of the hands / T. Snoap, E. Gallagher, A. Snoap, T. Ruiter // Eplasty. — 2015. — Vol. 15, № 7. — P. 37-47.
11. Taves J. Reducing amputation rates after severe frostbite / J. Taves, T. Satre // Am. Fam. Physician. — 2015. — Vol. 92, № 8. — P. 716-726.
12. Woo E. K. Proposed treatment protocol for frostbite: a retrospective analysis of 17 cases based on a 3-year single-institution experience / E.K. Woo, J.W. Lee, G.H. Hur [et al.] // Arch. Plast. Surg. — 2013. — Vol. 40, № 5. — P. 510-516.
/89.jpg)

/90.jpg)
/92.jpg)