Статтю опубліковано на с. 75-78
Відомо, що анестетики, які застосовуються під час загальної анестезії, можуть виступати одним з етіологічних чинників порушень когнітивного стану пацієнтів після операції. Приблизно третина пацієнтів, які побували під впливом загальної анестезії, спостерігають у себе певні когнітивні порушення. В основному така дисфункція мозку триває близько трьох днів після проведеної операції. У більшості випадків такі пацієнти скаржаться на сплутаність свідомості та погане функціонування мозку в цілому. Однак для переважної більшості пацієнтів післяопераційна когнітивна дисфункція (ПОКД) в результаті застосування загальної анестезії є короткочасною [1–5]. Одне з останніх проведених досліджень ПОКД виявило механізм мозкової дисфункції, у якій беруть участь рецептори пам’яті. Цей механізм запускається від використання анестезіологічних препаратів, що застосовуються для того, щоб усунути травматичні спогади пацієнта про проведену операцію. Як стверджують канадські вчені, деякі препарати, що використовують під час загальної анестезії, можуть мати досить тривалі негативні наслідки для пам’яті, через що її стан може погіршуватися протягом довгого часу навіть після повного виведення анестетика з організму [3, 9, 11].
ПОКД — це когнітивний розлад, що розвивається в ранньому й зберігається в пізньому післяопераційному періоді, клінічно проявляється у вигляді порушень пам’яті, труднощів концентрації уваги й порушень інших вищих функцій кори головного мозку (мислення, мовлення тощо) [1–3]. В післяопераційному періоді ускладнення загальної анестезії, пов’язані з пошкодженням центральної нервової системи (ЦНС), становлять близько 10 %. Варто звернути увагу, що ранні ПОКД є головним предиктором розвитку стійких ПОКД у віддаленому післяопераційному періоді, неврологічна дисфункція часто буває оборотна лише на початку свого розвитку, тому так важливо корегувати ці порушення на початкових етапах [7, 8]. Для діагностики ПОКД стандартно рекомендують тестування когнітивних функцій за шкалою Mini-Mental State Examination (MMSE), тест Лурія, тест малювання годинника тощо [2, 10].
За даними деяких публікацій, розвиток ПОКД асоціюється зі збільшенням тривалості госпіталізації, погіршенням якості життя і задоволеності пацієнтів, а також із підвищенням летальності в людей похилого віку [3, 4].
Метою нашого дослідження було визначити актуальність проблеми ПОКД під час загальної анестезії для урологічних пацієнтів, які перенесли оперативне втручання на нирці, дослідити ефективність профілактики ПОКД шляхом призначення препарату Гліятон®, що є донатором ацетилхоліну. Відомо, що ацетилхолін бере безпосередню участь у процесах навчання, запам’ятовування, мислення тощо [6]. На сучасному фармакологічному ринку існує багато нейропротекторних засобів, що тією чи іншою мірою впливають на кількість ацетилхоліну в мозку людини. Але одним із найбільш ефективних препаратів на сьогодні є похідний екзогенного холіну GPS — холіну альфосцерат. На сьогодні на вітчизняному фармацевтичному ринку є декілька лікарських препаратів холіну альфосцерату, але вони здебільшого закордонного виробництва і, на жаль, важкодоступні в економічному плані для пацієнта. Одним з основних завдань нашого дослідження було знайти доступний в економічному плані холіну альфосцерат та дослідити ефективність його впливу на ПОКД у пацієнтів після загальної анестезії. Гліятон® — вітчизняний препарат холіну альфосцерату, що був використаний у нашому дослідженні.
Матеріали та методи
На базі міської клінічної лікарні швидкої медичної допомоги (МКЛ ШМД) м. Вінниці проведене проспективне контрольоване дослідження, метою якого було визначити, чи зустрічаються ПОКД у пацієнтів після планових урологічних оперативних втручань на нирці, а також визначити ефективність та безпечність препарату Гліятон® щодо нівелювання розвитку ПОКД та скорочення часу перебування хворого на штучній вентиляції легенів (ШВЛ) після операції. У дослідження були включені 35 пацієнтів, які готувались до планових оперативних втручань на нирці в умовах урологічного відділення та відділення анестезіології й реанімації № 1 МКЛ ШМД м. Вінниці.
Критеріями включення пацієнтів у дослідження були: згода пацієнта, вік 30–80 років, заплановане оперативне втручання під загальною анестезією тривалістю 1 година або більше, анестезіологічний ризик за ASA ІІ–III, відсутність у пацієнта супутніх вад слуху, зору. Критеріями виключення були: відмова пацієнта, вік менше від 30 років або понад 80 років, вихідна оцінка за шкалою MMSE менше від 23 балів, виражена супутня патологія серцево-судинної, дихальної систем, цукровий діабет, захворювання нервової системи (деменція, дисциркуляторна енцефалопатія, гостре порушення мозкового кровообігу в анамнезі тощо), психічні захворювання, прийом антидепресантів або седативних препаратів, алкоголізм.
Пацієнтів розподілили на 2 групи. 1-ша група (контроль) — пацієнти без призначення препарату Гліятон®. 2-га група — пацієнти, яким призначали препарат Гліятон® у дозі 1 г внутрішньовенно на початку накладання швів на шкіру та при завершенні введення будь-яких анестетиків. За віком, окремими антропометричними показниками, обсягом, характером і тривалістю оперативного втручання, ступенем операційного ризику групи між собою були порівнянні та статистично не відрізнялись. Згідно з даними наркозних карт прооперованих пацієнтів для анестезіологічної допомоги використовувалися однакові препарати для анестезії в середніх дозах.
Після отримання інформованої згоди пацієнтів за день до операції проводили тестування когнітивних функцій за шкалою MMSE, тест малювання годинника та тест Лурія. Повторну оцінку когнітивних функцій здійснювали на 2-й день після операції. Критерієм ПОКД було статистично вірогідне зменшення показників за тестом малювання годинника, тестом Лурія та шкалою MMSE.
Одним з основних критеріїв оцінки між групами був час пробудження пацієнтів, що визначали як час від останнього введення анестетиків до екстубації трахеї (виконання елементарних команд, відновленням м’язового тонусу, адекватного самостійного дихання тощо) та відновлення після операції показника BIS-моніторингу понад 90.
Cтатистична обробка отриманих результатів проведена в пакеті Statistica 5.5 з використанням непараметричних методів оцінки отриманих результатів. Вірогідність різниці значень між незалежними кількісними величинами визначали за допомогою U-критерію Манна — Уїтні та Вілкоксона.
Результати та їх обговорення
У дослідження були включені 35 пацієнтів –(1-ша група — 15, 2-га група – 20). Групи статистично не відрізнялися за віком та відповідали критеріям включення в дослідження.
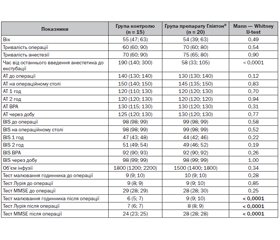
При проведенні оцінки когнітивних функцій перед операцією за допомогою тесту малювання годинника, тесту Лурія, шкали MMSE було показано, що 1-ша та 2-га досліджувані групи є статистично однорідними за цими обстеженнями (табл. 1). Так, при оцінці шкали MMSE середній показник у групі 1 становив 29 (28; 29); у групі 2 — 28 (28; 30) (р = 0,25); при оцінці тесту малювання годинника середній показник 1-ї групи становив 9 (9; 10), 2-ї — 10 (9; 10) (р = 0,28); за тестом Лурія середній показник у 1-й групі становив 9 (8; 9) у 2-й групі — 9 (9; 10) (р = 0,85).
Після проведення статистичного аналізу за тривалістю оперативного втручання у двох групах вірогідної статистичної розбіжності не було (р = 0,54), як і за тривалістю самої загальної анестезії (р = 0,90).
Як свідчать дані літератури [2, 11], поглиблення анестезії є фактором ризику виникнення ПОКД. На сьогодні одним з можливих способів визначення та контролю глибини анестезії є BIS-моніторинг. Міжгрупова різниця показника BIS до оперативного втручання на 1-шу та 2-гу годину операції вірогідно не відрізнялась і становила в 1-й групі 98 (98; 99); 47 (43; 48); 51 (49; 54); у 2-й групі — 99 (98; 99); 44 (42; 46); 49 (46; 52) (р = 0,52; р = 0,22; р = 0,19). З огляду на це можна сказати, що дані BIS-моніторингу під час оперативного втручання були в допустимих межах від 40 до 60 і зниження показника менше від 40 не відмічалось ні в 1-й, ні в 2-й групі, що могло б бути фактором ризику виникнення ПОКД.
В результаті дослідження було виявлено: аналіз часу від останнього введення анестетика до екстубації трахеї (перебування хворого на ШВЛ) показав статистично значну різницю (р < 0,0001) між контролем (190 (140; 300)) та групою з препаратом Гліятон® (58 (33; 105)), що свідчить про вірогідно кращий результат у групі з препаратом Гліятон® — у 3,2 раза.
Схожа тенденція щодо міжгрупової статистично вірогідної різниці проявилась у пацієнтів через добу після оперативного втручання при проведенні повторної оцінки когнітивних функцій (табл. 1, 2). Так, при проведенні одного з найпростіших тестів, що може вказувати на порушення пам’яті — тесту малювання годинника в 1-й групі спостереження (контроль) середній показник становив 6 (5; 7), а у 2-й групі (препарат Гліятон®) — 9 (9; 10), що свідчить про вірогідно кращий результат у групі з препаратом Гліятон® (р < 0,0001).
Оцінка стану пам’яті, стомлюваності, активності уваги проводилась за допомогою тесту Лурія. У нашому дослідженні було виявлено значну міжгрупову різницю та кращу картину у 2-й групі на фоні препарату Гліятон® після оперативного втручання. Так, середній показник групи контролю становив 7 (6; 7), а групи з препаратом Гліятон® — 8 (8; 9), що є статистично вірогідним (р < 0,0001).
Шкала MMSE є досить надійним інструментом для первинного скринінгу когнітивних порушень, у тому числі деменцій. Так, середній показник після операції в 1-ї групі становив 24 (23; 25), а у 2-й — 28 (28; 28), що свідчить про статистично вірогідне погіршення даного показника в контрольній групі (р < 0,0001).
При проведенні внутрішньогрупового аналізу у 1-й (контрольній) групі відмічалось статистично вірогідне погіршення показників усіх трьох тестів (табл. 2). Так, показники тесту малювання годинника до операції становили 9 (9; 10); після операції — 6 (5; 7), що вказує на вірогідне погіршення результату після оперативного втручання (р = 0,0006). Схожа динаміка відмічалась при аналізі тесту Лурія та показників шкали MMSE: до операції 9 (8; 9) та 29 (28; 29); після операції 7 (6; 7) та 24 (23; 25), що теж свідчить про вірогідне погіршення після оперативного втручання під загальною анестезією (р = 0,001 та р = 0,0006).
/78.jpg)
На відміну від контрольної групи у другій групі, у якій використовувався препарат Гліятон®, не було вірогідних внутрішньогрупових погіршень показників тесту малювання годинника та тесту Лурія. Так, до операції ці показники становили 10 (9; 10) та 9 (9; 10); після операції — 9 (9; 10) та 8 (8; 9), тобто відмінності є статистично незначними (р = 0,11 та р = 0,10). Лише показники шкали MMSE (до операції — 29 (28; 30) та після операції — 27 (27; 28)) засвідчили статистично вірогідні внутрішньогрупові зміни (р = 0,01), але не настільки виражені, як у групі контролю.
Отже, аналізуючи отримані дані, можна зробити висновок, що загальна анестезія негативно впливає на стан когнітивних функцій у пацієнтів з вихідною відсутністю когнітивних порушень. Одним із методів запобігання розвитку ПОКД є застосування препарату Гліятон® в періопераційному періоді. Оцінка отриманих даних проведеного дослідження вказує на те, що застосування препарату Гліятон® супроводжувалось вірогідним зниженням виникнення ПОКД, скороченням часу пробудження та часу перебування хворого на ШВЛ (екстубація пацієнта). Клінічна картина ПОКД, що спостерігалась у наших пацієнтів, проявлялась зниженням розумової працездатності, стійкості уваги, темпів та обсягу короткострокової пам’яті. Тому застосування препарату Гліятон® є способом нівелювання вказаних порушень ПОКД у післяопераційному періоді.
Список литературы
1. Черний Т.В., Андронова И.А., Черний В.И. Предикторы и фармакологическая коррекция недостаточности модулирующих систем мозга при мозговом инсульте и тяжелой черепно-мозговой травме // Международный неврологический журнал. — 2011. — № 2. — С. 40.
2. Шнайдер Н.А., Шпрах В.В., Салмина А.Б. Послеоперационная когнитивная дисфункция: профилактика, диагностика, лечение. Методическое пособие для врачей. — Красноярск: Оперативная полиграфия, 2005. — 95 с.
3. Abildstrom H., Rasmussen L.S., Rentowl P. et al. Cognitive dysfunction 1–2 years after non-cardiac surgery in the elderly // Acta Anaesthesiol. Scand. — 2000. — 44. — 1246-51.
4. Ancelin M.L., De Roquefeuil G., Ritchie K. Anesthesia and postoperative cognitive dysfunction in the elderly: a review of clinical and epidemiological observations // Rev. Epidemiol. Sante Publique. — 2000. — Vol. 48, № 5. — P. 459-472.
5. Bhutta AT. Ketamine: a controversial drug for neonates // Semin. Perinatol. — 2007. — Vol. 31, № 5. — P. 303-308.
6. Fallbrook A., Turenne S.D., Mamalias N., Kish S.J., Ross B.M. Phosphatidylcholine and phosphatidylethanolamine metabolites may regulate brain phospholipid catabolism via inhibition of lysophospholipase activity // Brain. Res. — 1999. — Vol. 10. — P. 207-210.
7. Fodale V., Santaria L.B., Schifilliti D., Mandel P.K. Anesthetics and postoperative cognitive dysfunction: a pathological mechanism mimicking Alzheimer’s disease // Anesthesia. — 2010. — V. 65(4). — P. 388-395.
8. Landa K.M., Levine D.A. The Diagnosis and Management of Mild Cognitive impairment: A Clinical Review // JAMA. — 2014. — № 312(23). — Р. 2551-2561.
9. Postoperative cognition disorders in elderly patients. The results of the «International study of postoperative cognitive dysfunction» / Biedler A., Juckenhöfel S., Larsen R. et al. // Anaesthesist. — 1999. — Vol. 48, № 12. — P. 884-895.
10. Predictors of cognitive dysfunction after major noncardiac surgery / Monk T.G., Weldon B.C., Garvan C.W. et al. // Anesthesio–logy. — 2008. — Vol. 108. — P. 18-30.
11. Wang C., Slikker W. Jr. Strategies and experimental models for evaluating anesthetics: effects on the developing nervous system // Anesth. Analg. — 2008. — Vol. 106, № 6. — P. 1643-1658.

/77.jpg)
/78.jpg)