Статтю опубліковано на с. 21-25
Вступ
Інфекції сечової системи (ІСС) у педіатричній практиці є актуальною проблемою, по-перше, через свою поширеність — 56 : 1000 дитячого населення [1, 10], по-друге, через необхідність емпіричного вибору антибіотика чи протимікробного засобу з гарантованою бактерицидною дією відносно збудника захворювання. На сьогодні такий вибір для лікаря-практика на території України стає непростим, бо в умовах зростаючої кількості стійких штамів уропатогенів до терапії антибіотиками немає моніторингу їх резистентності до найбільш вживаних класів антибіотиків.
Головною задачею при лікуванні ІСС у дітей, чи то циститу, чи то пієлонефриту, залишається ліквідація мікробно-запального процесу в сечових шляхах та нирковій паренхімі. Недостатня ефективність антибактеріальної (АБ) терапії може призвести до персистуючого перебігу інфекційного процесу з подальшими несприятливими наслідками у вигляді формування ниркових рубців і навіть хронічної ниркової недостатності, у тому числі в дорослому віці.
Отже, стає нагальним створення територіальної системи моніторингу мікробіологічного портрета патологічних збудників із визначенням їх чутливості та резистентності до антибактеріальних препаратів різних класів, а також перегляд терапевтичних схем ІСС з урахуванням напрацьованих даних.
У даний час встановлено, що за наявності певних чинників розвиток пієлонефриту в дітей обумовлений насамперед кишковою паличкою; рідше — клебсієлою, синьогнійною паличкою, протеєм, цитробактерами та іншими мікробами; значно рідше інфекція сечової системи викликається стафілококом і стрептококом (Ігнатова М.С., Коровіна Н.А., 1989; Маркова І.В. зі співавт, 1994; Мултих І.Г., 1994) [4]. За даними P. Stroppini et al. (1989), у дітей з інфекцією сечової системи грамнегативна флора висівається в 91,6 % випадків, а грампозитивні мікроорганізми є етіологічним фактором у 8,4 % хворих. Begue et al. (1988), вивчаючи мікробний пейзаж сечі в 106 дітей віком від одного місяця до 14 років з гострим пієлонефритом, показали, що Е.coli висівається у 86,6 % хворих, Proteus spp. — у 8 % випадків, Klebsiella pneumoniae — менше ніж у 2 % пацієнтів. Грампозитивні коки виявляються тільки в 3,6 % хворих на гострий пієлонефрит. За даними П.К. Яцика (1988), у хворих з хронічним обструктивним пієлонефритом значно частіше, ніж у хворих на гострий пієлонефрит, зустрічається Klebsiella pneumoniae (у 18,7 % хворих), Str.faecalis (у 12,5 % пацієнтів), Pseudomonas aerиginosa (в 6,2 %) [6].
Однак позитивні результати бактеріологічного дослідження сечі, навіть у пік активності ІСС, вдається отримати не завжди. Так, за даними А.В. Терещенко (1991), О.Л. Тиктинського (1984), тільки в 75,7 % хворих на пієлонефрит при посіві сечі виявлявся причинний мікроорганізм, а за даними Г.В. Калугіної (1993), лише у 42 % хворих ідентифікується збудник. Відсутність висіву мікробів може бути пов’язана з переходом бактерій у L-форми й протопласти, які при пієлонефриті у дітей зустрічаються в 17 % випадків (Ігнатова М.С., Коровіна Н.А., 1982) [5].
Крім того, на сьогодні в реалізації ІСС є актуальними мікст-збудники, у тому числі й у дітей. Найчастіше мають місце асоціації E.сoli з внутрішньоклітинними урогенітальними організмами (M.hominis, U.urealiticum, Chl.trachomatis) чи асоціації урогенітальних збудників [3]. Не слід також забувати й про найпростіших, вони можуть стати причиною ІСС у підлітків, які ведуть статеве життя. Для ідентифікації згаданих збудників необхідне проведення дослідження імуноферментним методом (ІФА) та/чи за допомогою полімеразно-ланцюгової реакції (ПЛР).
Отже, сьогодні важче, ніж будь-коли раніше, елімінувати інфекцію, викликану супермікроорганізмами чи мікст-асоціаціями різних класів збудників. Ця проблема посилюється тим, що розробки нових антимікробних препаратів мінімальні. В емпіричному виборі антибактеріального лікування ІСС українські лікарі можуть поки що орієнтуватися на результати масштабних міжнародних епідеміологічних досліджень, таких як SMART 2009–2010 рр., ARESC 2005–2006 рр., ДАРМІС 2010–2011 рр. та ін. [2]. За критеріями, прийнятими міжнародними співтовариствами (IDSA, EAU, AUA), антибіотики та антимікробні препарати, рівень резистентності уропатогенів до яких перевищив 10–20 %, не можуть розглядатися як засоби емпіричного вибору для терапії ІСС [12].
Метою нашого дослідження було вивчення видового спектра збудників ІСС у дітей, їх чутливості до широко вживаних антибіотиків та поширення резистентних штамів.
Матеріали і методи
До дослідження було залучено штами бактерій, висіяні в активну стадію захворювання в клінічно значимому титрі, відповідно до рекомендацій EAU, > 105 КУО/мл із сечі хворих на хронічний цистит, гострий та хронічний пієлонефрит, які перебували на стаціонарному лікуванні в нефрологічному відділенні ДМЛ № 1 м. Києва упродовж 2009–2014 рр. Вік дітей, які увійшли до дослідження, становив від 1 міс. до 17 років.
Ідентифікація збудників відбувалася в бактеріологічному відділі лабораторії дитячої міської лікарні № 1 м. Києва із застосуванням загальноприйнятих методів посіву сечі на живильні середовища. Оцінка чутливості культури до антибіотиків та протимікробних засобів проводилася шляхом серійного розведення в бульйоні Мюллера — Хінтона (BBL, США) [8]. Для контролю якості було використано культури E.coli АТСС 25922, Ent.faecalis АТСС 29212, Kl.рneumoniaе АТСС 13883, Acinetobacter anitratus АТСС 43498, Enterobacter cloacae АТСС 13047, Proteus mirabilis АТСС 29245. Чутливість виділеної флори оцінювали до ампіциліну, амоксициліну, цефуроксиму, цефтазидиму, ципрофлоксацину та фуразидину К (Фурамагу).
Результати дослідження було проаналізовано з використанням методу варіаційної статистики з розрахунком частотних характеристик досліджуваних параметрів (у відсотках). Первинна база опрацьована в Excel, статистична обробка отриманих результатів здійснювалась за допомогою ліцензійного пакета Statistiсa 6.0.
Результати та їх обговорення
Вивченню підлягли 2211 штамів, які було виділено від 91 хлопчика (4,1 %) та 2120 дівчаток (95,9 %). Серед хлопчиків до 7 років найбільш поширеним був гострий пієлонефрит, а в абсолютної більшості хлопців старшого віку мав місце хронічний пієлонефрит в активній стадії захворювання на тлі уродженої аномалії розвитку сечової системи. У дівчаток превалював гострий неускладнений пієлонефрит в активній стадії захворювання .
Розподіл хворих за нозологією був таким: хворі із хронічним циститом становили 13,4 % (192), із гострим пієлонефритом — 61 % (1380), із хронічним пієлонефритом — 12,4 % (332), з ІСС без визначення локалізації запалення — 13,2 % (307) (рис. 1).
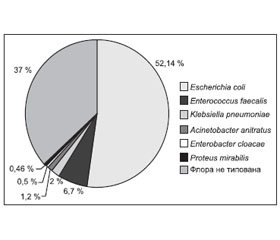
Escherichia coli була виділена у 1153 (52,14 %) хворих контингенту спостереження, Enterococcus faecalis — у 147 (6,7 %), Klebsiella pneumoniaе — у 44 (2 %), Acinetobacter anitratus — у 27 (1,2 %), Enterobacter cloacae — у 12 (0,5 %), Proteus mirabilis — у 10 (0,46 %), а у 818 (37 %) дітей бактеріальна флора взагалі не була типована (рис. 2).
За літературними даними, в останні роки намітилася тенденція до зниження відсотка мікроорганізмів, типованих із сечі хворих на ІСС. Позитивні результати бактеріологічного дослідження сечі не завжди вдавалося отримати й раніше (Терещенко А.В., 1991; Тиктинський О.Л., 1984 [6]; Калугіна Г.В., 1993). Відсутність висіву мікробів може бути пов’язана з переходом бактерій в L-форми та протопласти (Ігнатова М.С., Коровіна Н.А., 1982 [5, 7]). У наш час така тенденція може бути пояснена, зокрема, іншим етіологічним чинником у реалізації ІСС, таким як урогенітальний збудник, що ідентифікується ІФА-дослідженням та ПЛР.
Та на сьогодні більшість авторів пояснюють факт відсутності бактеріальної ідентифікації ІСС перебуванням уропатогенів у стані біоплівки [11]. Отже, з’являється все більше даних щодо такої форми життєдіяльності мікроорганізмів, й те, що більшу частину часу патогени перебувають саме в стані біоплівки, унеможливлює їх бактеріальну ідентифікацію шляхом посіву сечі на стандартні живильні середовища.
Найбільший практичний інтерес має оцінка чутливості та резистентності Escherichia coli до традиційно вживаних антибактеріальних препаратів, бо саме Escherichia coli домінує в етіологічній структурі ІСС (табл. 1).
Високочутливими вважалися штами культури, якщо діаметр відсутності зони росту становив ≥ 20 мм, помірно чутливими — 16–18 мм та стійкими до впливу антибактеріального препарату — із зоною без росту ≤ 15 мм.
Як бачимо з табл. 1, більшість штамів E.сoli були високочутливими до фуразидину К — 94,1 % (1084), далі за чутливістю по спадній: ципрофлоксацин — 89 % (1027), цефтазидим — 64,8 % (747), цефуроксим — 57 % (657), найменшою була кількість штамів E.сoli, високочутливих до амоксициліну — 30,1 %.
Мінімальною була кількість штамів E.сoli, резистентних до фуразидину К — 3,2 % (37), далі по зростаючій: ципрофлоксацин — 7,1 % (81), цефтазидим — 30 % (346), цефуроксим — 33,7 % (388), максимальна — до амоксициліну 59,7 % (688).
Динаміка чутливості кишкової палички до фуразидину К в дітей з інфекцією сечової системи у нашому дослідженні виявилася майже сталою протягом 6 років, тобто практично незмінною, вона перебувала в діапазоні 93,2–94,6 % (рис. 3).
Резистентність же штамів кишкової палички до фуразидину К (Фурамаг) у цих пацієнтів була в діапазоні 2,59–2,8 %, тобто була визначена як низька, що дозволяє рекомендувати препарат як засіб емпіричного вибору в монотерапії циститу та в складі комплексної терапії інфекції сечових шляхів і пієлонефриту для підсилення етіотропної бактерицидної дії.
За критеріями, прийнятими міжнародними співтовариствами (IDSA, EAU, AUA), антибіотики та антимікробні препарати, рівень резистентності уропатогенів до яких перевищив 10–20 %, не можуть розглядатися як засоби емпіричного вибору для терапії інфекцій сечовивідних шляхів.
З вищенаведеного ми розуміємо, що антибактеріальні препарати групи амоксициліну не можуть розглядатися як засоби емпіричного вибору для антибактеріальної терапії ІСС. А також має місце тенденція росту числа антибіотикорезистентних штамів до цефалоспоринів як 2-ї, так і 3-ї генерації.
До фторхінолонів зберігають високу чутливість більшість уропатогенів, але дитячий вік (до 18 років) є офіційним протипоказанням до застосування фторхінолонів. Це протипоказання засноване на результатах експериментальних досліджень, у яких хінолони (не тільки фторовані) викликали артропатію в молодих тварин. Припускають, що вона може бути пов’язана як з порушеннями відкладення колагену, так і зі змінами функції хондроцитів [9].
До самих фторхінолонів стійкість розвивається відносно повільно, бо для її виникнення необхідні множинні мутації в декількох генах [12]. Проте поширення використання цих препаратів, так само як і антибіотиків інших груп, асоціюється зі зростанням рівня резистентності до них.
Не бажаючи стимулювати використання фторхінолонів у педіатрії і разом з тим усвідомлюючи необхідність їх призначення в певних ситуаціях, Міжнародне товариство хіміотерапії розробило в 1993 р. рекомендації, згідно з якими фторхінолони можуть бути застосовані в окремих випадках, коли неефективні дозволені до застосування в педіатрії антибіотики. Такими ситуаціями можуть бути також випадки ІСС з ускладненим перебігом чи резистентності патогенних штамів до цефалоспоринів.
Отже, як за літературними даними, так і за напрацьованими нами у практиці результатами, використання нітрофуранових препартів як засобів емпіричної терапії неускладненої ІСС та профілактичної терапії пієлонефритів на сьогодні є раціональним та максимально ефективним, оскільки забезпечує бактеріальну санацію більшості збудників.
Вони ефективні щодо грампозитивних і грамнегативних мікробів, у ряді випадків затримують ріст мікроорганізмів, стійких до антибіотиків і сульфаніламідів. Препарати цієї групи прямо діють на цитоплазматичну мембрану, а також порушують синтез рибосомних білків мікробів. Рідкісний розвиток резистентності до нітрофуранів мікробної флори, низька токсичність зробили їх незамінними для лікування інфекцій сечової системи в дітей.
В Україні представником сучасного покоління нітрофуранів є Фурамаг® (OlainFarm). Цей препарат був розроблений майже 20 років тому в Інституті органічного синтезу АН Латвії на основі калієвої солі фурагіну в поєднанні з магнію карбонатом основним у співвідношенні 1 : 1. У Латвії офіційно Фурамаг зареєстрований до використання у 1998 році, в Україні — у 2001 р.
Магнію карбонат основний, що входить до складу препарату, перешкоджає перетворенню в кислому середовищі шлунка фурагіну розчинного у фурагін погано розчинний. Оптимізована таким чином лікарська форма набула властивостей більш повного всмоктування препарату в тонкій кишці й підвищення біодоступності Фурамагу в 3 рази порівняно із фурагіном. Це дозволяє отримувати лікувальний ефект, використовуючи менші дози, і в результаті різко скоротити число побічних ефектів. Фурамаг виводиться нирками, у сечі створюються високі концентрації діючої речовини, що перевищують бактеріостатичні концентрації більше ніж в 50 разів. У крові та тканинах концентрація препарату порівняно невелика, що пов’язано зі швидким виділенням. Максимальна концентрація в крові зберігається від 3 до 8 годин, у сечі виявляється за 3–4 години. На сьогодні показано, що Фурамаг діє бактерицидно, а також має антитоксичний ефект, стимулює імунітет, активуючи систему комплементу й фагоцитарну активність лейкоцитів, не діє на сапрофітну флору в шлунково-кишковому тракті і не викликає дисбіозу [13, 14]. На відміну від фурагіну Фурамаг випускається в капсулах, що дозволяє усунути гіркий смак препарату, уникнути забарвлення порожнини рота.
Висновки
1. За результатами нашого дослідження, у більшості випадків ІСС серед дітей Києва та області зберігається висока чутливість штамів E.сoli до фуразидину К (Фурамаг) — 94,1 % та до ципрофлоксацину — 89 % випадків.
2. Частота стійкості провідного уропатогену (E.сoli) залишається на невисокому рівні до фуразидину К (Фурамаг) — 3,2 % та ципрофлоксацину — 7,1 %. Оскільки фторхінолони можуть бути застосовані в дітей лише в окремих випадках, коли неефективні дозволені до застосування в педіатрії інші антибіотики чи протимікробні засоби, Фурамаг залишається оптимальною рекомендацією для емпіричної терапії неускладнених інфекцій сечовивідних шляхів у дітей.
3. Ми також рекомендуємо призначення Фурамагу в складі етіотропної комбінованої антибактеріальної терапії пієлонефритів з ускладненим чи тяжким перебігом для забезпечення вірогідного бактерицидного ефекту та розширення спектра дії.
4. Високий профіль безпеки та хороша переносимість препарату Фурамаг дозволяють використовувати його для курсів протирецидивної терапії, у тому числі тривалих, за необхідності, а також у дітей.
Конфлікт інтересів: не заявлений.
Рецензенти: Багдасарова Інгрета Вартанівна, д.м.н., професор, керівник відділу дитячої нефрології ДУ «Інститут нефрології НАМН України», Маменко Марина Євгеніївна, д.м.н., проф. каф. педіатрії НМАПО ім. П.Л. Шупика.
/22.jpg)
/23.jpg)

/23_2.jpg)
/23_3.jpg)