Резюме
У статті повідомляється про результати остеосинтезу у 65 хворих із патологічними переломами на фоні метастатичного ураження кістки. Застосовані методики остеосинтезу: черезкістковий остеосинтез апаратом зовнішньої фіксації — у 33 (50,8 %) хворих, армований остеосинтез — у 32 (49,2 %). Остеосинтез застосований у схемах комплексного лікування з використанням поліхіміотерапії, променевої терапії, гормонотерапії, імунотерапії і бісфосфонатів. Внаслідок застосування методик остеосинтезу в схемах комплексного лікування ускладнення спостерігалися у 2 (3,1 %) пацієнтів, рецидиви метастатичної пухлини — у 3 (4,6 %) пацієнтів, нові вогнища метастатичного ураження в кістках і вісцеральних органах у процесі лікування виявлені у 35 (53,8 %) хворих. Трирічна загальна виживаність пацієнтів становила 28,6 ± 1,32 %, п’ятирічна — 14,4 ± 1,96 %. Застосування методик остеосинтезу в комплексному лікуванні хворих із метастатичним ураженням довгих трубчастих кісток дозволяє відновити функцію й опороспроможність кінцівки, зменшити больовий синдром і у зв’язку з цим поліпшити якість життя даної категорії хворих.
В статье сообщается о результатах остеосинтеза у 65 больных с патологическими переломами на фоне метастатического поражения кости. Применены методики остеосинтеза: чрескостный остеосинтез аппаратом внешней фиксации — у 33 (50,8 %) больных, армированный остеосинтез — 32 (49,2 %). Остеосинтез применен в схемах комплексного лечения с использованием полихимиотерапии, лучевой терапии, гормонотерапии, иммунотерапии и бисфосфонатов. В результате применения методик остеосинтеза в схемах комплексного лечения осложнения наблюдались у 2 (3,1 %) пациентов, рецидивы метастатической опухоли — у 3 (4,6 %) пациентов, новые очаги метастатического поражения в костях и висцеральных органах в процессе лечения выявлены у 35 (53,8 %) больных. Трехлетняя общая выживаемость пациентов составила 28,6 ± 1,32 %, пятилетняя — 14,4 ± 1,96 %. Применение методик остеосинтеза в комплексном лечении больных с метастатическим поражением длинных трубчатых костей позволяет восстановить функцию и опороспособность конечности, уменьшить болевой синдром и в связи с этим улучшить качество жизни данной категории больных.
The article reported the results of osteosynthesis in 65 patients with pathological fractures on the background of metastatic bone lesions. We have applied such methods of osteosynthesis: perosseous osteosynthesis with external fixation device — in 33 (50.8 %) patients, reinforced osteosynthesis — in 32 (49.2 %). Osteosynthesis has been applied in comprehensive treatment using polychemotherapy, radiation therapy, hormone therapy, immunotherapy and bisphosphonates. Due to the use of osteosynthesis techniques in complex treatment regimens, complications occurred in 2 (3.1 %) patients, recurrences of metastatic tumors — in 3 (4.6 %) patients, new foci of metastatic lesions in bones and visceral organs during the treatment were detected in 35 ( 53.8 %) patients. The three-year overall survival rate of patients was 28.60 ± 1.32 %, five-year — 14.40 ± 1.96 %. The use of osteosynthesis techniques in the comprehensive treatment in patients with metastatic lesions of long bones helps to restore the function and support ability of the limb, to reduce pain and therefore to improve the quality of life of these patients.
Статтю опубліковано на с. 64-68
Вступ
Метастатичні пухлини кісток, за даними літератури, спостерігаються у 2–4 рази частіше, ніж первинні пухлини, та посідають третє місце за частотою ураження метастазами після легенів і печінки [2]. Основними клінічними проявами метастазів у кістки є біль, гіперкальціємія, деформація кісток та патологічні переломи. Біль є одним із найбільш значущих ознак метастатичного ураження кісток і має місце у 70 % хворих із метастазами в кістки протягом життя [5]. Гіперкальціємія є другим найважливішим ускладненням метастазів у кістки, характерним переважно для остеолітичного варіанта метастатичного ураження, та спостерігається у 10–15 % хворих на злоякісні пухлини, частіше буває при раку молочної залози (30–40 %) та раку легені (20 %) [7, 8]. Ризик виникнення патологічних переломів у довгих трубчастих кістках корелює зі ступенем деструкції кортикального шару, перелом стає можливим при руйнуванні кортикального шару більше ніж на 50 % [6]. Метастази в кістки, ускладнені патологічними переломами, потребують хірургічного лікування лише у 5–9 % пацієнтів [11]. Проблема пошуку малотравматичних і надійних методів фіксації патологічних переломів кісток метастатичної природи дотепер залишається актуальною. Сьогодні при лікуванні метастатичного ураження довгих трубчастих кісток застосовують сегментарні резекції з ендопротезуванням, інтрамедулярний остеосинтез, накістний остеосинтез, позавогнищевий черезкістковий остеосинтез, кюретаж пухлини із заміщенням дефекту кістковим цементом [1, 2, 9, 10]. При патологічних переломах на фоні метастазів у кістки хірургічне лікування є паліативним методом у комбінованій та комплексній терапії пацієнтів із метастазами в кістки і відіграє важливу роль в адаптації хворих та полегшує проведення лікувальних маніпуляцій [3, 4]. Отже, при патологічних переломах довгих кісток своєчасне адекватне хірургічне лікування дозволяє послабити або ліквідувати больовий синдром, відновити втрачену функцію кінцівки та своєчасно продовжити протипухлинну терапію з метою поліпшення якості та подовження життя в онкологічних хворих.
Матеріали та методи
У клінічному відділі ДУ «Інститут травматології та ортопедії НАМН України» за період 2009–2015 рр. остеосинтез із приводу метастазів у довгі кістки із загрозою або патологічним переломом було проведено у 65 хворих (38 жінок і 27 чоловіків, середній вік хворих становив 59,2 року). Розподіл хворих із метастатичним ураженням кісток згідно з локалізацією первинної пухлини був такий: рак нирки — 19 (29,2 %) хворих, рак молочної залози — 17 (26,2 %), множинна мієлома — 11 (16,9 %), рак легені — 8 (12,3 %), рак кишечника — 3 (4,6 %), саркома тіла матки — 2 (3,1 %), анонімний рак — 1 (1,5 %), рак передміхурової залози — 1 (1,5 %), рак шийки матки — 1 (1,5 %), рак наднирника — 1 (1,5 %), рак печінки — 1 (1,5 %). Хворим у передопераційному періоді обов’язково проводилось комплексне обстеження: сцинтиграфія кісток скелета, комп’ютерна або магнітно-резонансна томографія органів грудної та черевної порожнини і порожнини таза, а також біопсія вогнища ураження у кістці. При обстеженні хворих у передопераційному періоді встановлено, що множинне ураження кісток спостерігалося у 45 (69,2 %) пацієнтів, солітарне ураження кісток — у 13 (20 %) пацієнтів, множинне ураження кісток і внутрішніх органів — у 7 (10,8 %) пацієнтів. Вибір оптимального об’єму хірургічного втручання у хворих із метастазами в кістках, у тому числі ускладненими патологічними переломами, залежав від локалізації та протяжності ураження, давності перелому, морфологічної будови первинної пухлини, наявності м’якотканинного компоненту, чутливості до поліхіміотерапії, променевої терапії та гормонотерапії. У хворих застосовані такі методики остеосинтезу: армований металоостеосинтез (накісткова пластина або інтрамедулярний штифт і кістковий цемент) або черезкістковий позавогнищевий остеосинтез стрижневими апаратами зовнішньої фіксації. Армований металоостеосинтез (накісткова пластина та кістковий цемент) застосований у 23 (35,4 %) пацієнтів. У всіх цих хворих був патологічний перелом кістки. Локалізація метастатичного процесу в проксимальному відділі стегнової кістки спостерігалася у 6 хворих, діафізі стегнової кістки — 5, діафізі плечової кістки — 3, дистальному відділі стегнової кістки — 3, проксимальному відділі плечової кістки — 1, дистальному відділі плечової кістки — 1, діафізі променевої кістки — 1, проксимальному відділі великогомілкової кістки — 1, діафізі великогомілкової кістки — 1, п’ятковій кістці — 1. Армований металоостеосинтез (інтрамедулярний штифт і кістковий цемент) застосований у 9 (13,8 %) пацієнтів. Локалізація метастатичного процесу в діафізі плечової кістки спостерігалася у 5 хворих, в проксимальному відділі стегнової кістки — 2, діафізі стегнової кістки — 2. Черезкістковий позавогнищевий остеосинтез стрижневими апаратами зовнішньої фіксації Костюка застосований у 33 (50,8 %) пацієнтів. У всіх цих хворих мав місце патологічний перелом. Локалізація метастатичного процесу була в проксимальному відділі стегнової кістки у 15 хворих, діафізі плечової кістки — 7, діафізі стегнової кістки — 3, діафізі великогомілкової кістки — 3, дистальному відділі плечової кістки — 3, дистальному відділі стегнової кістки — 2. У перед- та післяопераційному періоді хворі отримували специфічне лікування (поліхіміотерапію, променеву терапію, гормонотерапію, імунотерапію, бісфосфонати) залежно від морфологічної форми первинної пухлини та проведеного хірургічного втручання. Результати функціональної активності прооперованого відділу скелета визначались нами у відсотках (за шкалою MSTS). Оцінка болю та функціонального стану хворого при хронічних болях у місці метастатичного ураження до і після лікування проводилась нами згідно з опитувальником (за R.G. Watkins) і визначалась у балах. Для оцінювання якості життя хворих із метастатичним ураженням кісток ми використовували опитувальник EORTC QLQ-C30, результати визначались у балах.
Результати та їх обговорення
При застосуванні методик остеосинтезу в схемах комплексного лікування хворих із метастатичним ураженням довгих трубчастих кісток отримано такі результати: ускладнення в післяопераційному періоді спостерігалися у 2 (3,1 %) хворих (після армованого металоостеосинтезу інтрамедулярним штифтом у 1 пацієнта спостерігався перелом штифта; після застосування черезкісткового остеосинтезу в 1 пацієнта спостерігалося нагноєння кістки в місці введення стрижнів). Рецидиви метастатичної пухлини виявлені у 3 (4,6 %) хворих (після армованого металоостеосинтезу). Нові вогнища метастатичного ураження в кістках і вісцеральних органах у процесі лікування виявлені у 35 (53,8 %) хворих. Усі прооперовані пацієнти були активізовані на 3-тю — 10-ту добу післяопераційного періоду і могли самостійно обслуговувати себе. Функціональні результати прооперованої кінцівки (за шкалою MSTS):
— після застосування черезкісткового остеосинтезу стрижневими апаратами зовнішньої фіксації: у проксимальному відділі стегнової кістки — 60,2 %, діафізі стегнової кістки — 76,8 %, дистальному відділі стегнової кістки — 62,2 %, діафізі плечової кістки — 88,8 %, діафізі великогомілкової кістки — 74,6 %, дистальному відділі плечової кістки — 50,6 %, дистальному відділі стегнової кістки — 54,8 %;
— після застосування армованого металоостеосинтезу: у проксимальному відділі стегнової кістки — 68,8 %, діафізі стегнової кістки — 76,8 %, діафізі плечової кістки — 86,4 %, дистальному відділі стегнової кістки — 72,6 %, проксимальному відділі плечової кістки — 82,2 %, дистальному відділі плечової кістки — 70,4 %, діафізі променевої кістки — 92,2 %, проксимальному відділі великогомілкової кістки — 88,4 %, діафізі великогомілкової кістки — 90,4, п’ятковій кістці — 58,8 %.
Наводимо клінічні приклади
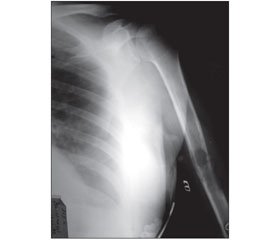
Клінічний приклад 1. Хвора М., 50 років, діагноз: рак молочної залози, метастаз у ліву плечову кістку, патологічний перелом, больовий синдром. Хворій виконано остеосинтез стрижневим апаратом зовнішньої фіксації. В післяопераційному періоді проведено курс променевої терапії на вогнище ураження в кістці — 40 Грей, курси поліхіміотерапії та бісфосфонатів. На рис. 1 подано фотовідбитки рентгенограми хворої М.: метастаз раку молочної залози в ліву плечову кістку. На рис. 2 (а — пряма проекція, б — бокова проекція) подані фотовідбитки рентгенограм хворої М.: стан після остеосинтезу лівої плечової кістки стрижневим апаратом зовнішньої фіксації.
/66.jpg)
Клінічний приклад 2. Хворий Ш., 49 років, діагноз: рак легені, метастаз у праву плечову кістку, патологічний перелом, больовий синдром. Хворому проведено остеосинтез патологічного перелому плечової кістки блокуючим інтрамедулярним стрижнем. У післяопераційному періоді хворому проведені курси поліхіміотерапії та бісфосфонатів. На рис. 3 подано фотовідбитки рентгенограми хворого Ш.: метастаз раку легені в праву плечову кістку. На рис. 4 представлено фотовідбитки рентгенограми хворого Ш.: стан після остеосинтезу плечової кістки блокуючим інтрамедулярним стрижнем.
/67.jpg)
Оцінювання болю та функціонального стану у 33 пацієнтів (за R.G. Watkins) при застосуванні черезкісткового позавогнищевого остеосинтезу апаратами зовнішньої фіксації: 23 (69,7 %) хворі до остеосинтезу мали больовий синдром середньої тяжкості (2–3 бали за R.G. Watkins), у 10 (30,3 %) хворих мав місце виражений больовий синдром (4 бали за R.G. Watkins). У післяопераційному періоді у 13 (39,4 %) хворих больовий синдром був відсутнім (0 балів за R.G. Watkins), у 20 (60,6 %) хворих больовий синдром був незначним (1–2 бали за R.G. Watkins).
Порівняльна оцінка больового синдрому у 32 пацієнтів при застосуванні армованого металоостеосинтезу: 21 (65,6 %) хворий до остеосинтезу мав больовий синдром середньої тяжкості (2–3 бали за R.G. Watkins), у 11 (34,4 %) хворих зберігався постійний сильний больовий синдром (4 бали за R.G. Watkins). У післяопераційному періоді у 27 (84,4 %) хворих зберігався мінімальний больовий синдром (1 бал за R.G. Watkins), у 5 (15,6 %) пацієнтів больовий синдром був відсутнім.
Згідно з опитувальником EORTC QLQ-C30, якість життя хворих із метастатичним ураженням кісток після застосування стрижневих апаратів зовнішньої фіксації поліпшилась з 30 до 70 балів, після армованого металоостеосинтезу — з 45 до 85 балів.
Трирічна загальна виживаність хворих після застосування методик остеосинтезу в схемах комплексного лікування становила 28,6 ± 1,32 %, п’ятирічна — 14,4 ± 1,96 %.
Отже, застосування методик остеосинтезу при метастатичному ураженні трубчастих кісток дозволяє відновити функцію та опороспроможність кінцівки, зменшити больовий синдром та покращити якість життя пацієнтів, а проведення специфічного комплексного лікування дозволяє подовжити життя онкологічних хворих. Отримані результати лікування свідчать про виправданість використання методик остеосинтезу при патологічному переломі або загрозі патологічного перелому у пацієнтів із метастатичними пухлинами довгих трубчастих кісток.
Висновки
1. Для вирішення питання про можливість проведення остеосинтезу патологічного перелому кісток кінцівки на фоні метастатичної пухлини необхідно враховувати локалізацію та протяжність ураження, давність перелому, морфологічну будову первинної пухлини, наявність м’якотканинного компоненту та чутливість пухлини до специфічного лікування.
2. Застосування методик остеосинтезу при лікуванні хворих із метастатичним ураженням довгої трубчастої кістки призводить до зменшення больового синдрому, відновлення функції кінцівки, що сприяє покращенню якості життя даної категорії хворих.
Список литературы
1. Современные подходы к лечению патологических переломов длинных трубчатых костей / В.Ю. Карпенко, В.В. Тепляков, А.А. Амирасланов и др. // Мат-лы III съезда онкологов и радиологов СНГ. — Минск, 2004. — С. 276.
2. Современные подходы к хирургическому лечению метастазов злокачественных опухолей в кости / М.Д. Алиев, В.В. Тепляков, В.Е. Каллистов и др. // Практическая онкология. — 2001. — № 1. — С. 39-43.
3. Хирургическое лечение метастазов в кости / В.Е. Каллистов, А.П. Николаев, М.Д. Алиев и др. // Вестник РОНЦ им. Н.Н. Блохина РАМН. — 2003. — № 2. — С. 76-81.
4. Хирургическое лечение патологических переломов длинных трубчатых костей при метастатическом поражении / Тепляков В.В., Карпенко В.Ю., Валиева А.К. и др. // Вопросы онкологии. — 2005. — Т. 51, № 3. — С. 377-381.
5. An evaluation of the potential cost reductions resulting from the use of clodronate in the treatment of metastatic carcinoma of the breast / Biermann W.A., Cantor R.I., Fellin F.M. et al. // Bone. — 1991. — Vol. 12. — P. 37-42.
6. Fidler M. Incidence of fracture through metastases in long bones / М. Fidler // Acta Orthop. Scand. — 1987. — Vol. 52. — P. 623-627.
7. Huggia F.M. Overview of cancer related hypercalcaemia: epidemiology and etiology / F.M. Huggia // Seminars Oncol. — 1990. — Vol. 17. — P. 3-9.
8. Kanis J.A. Consequences of neoplasia induced resorption and the use of clodronate (Review) / J.A. Kanis, N. O’Rourke, E. McCloskey // Int. J. Oncol. — 1994. — Vol. 5. — P. 713-731.
9. Reconstruction nailing for pathological subtrochanteric fractures with coexisting femoral shaft metastases / Т. Karachalios, R.M. Atkins, P.P. Sarangi et al. // J. Bone Joint Surg. Br. — 1993. — Vol. 75-B. — Р. 119-122.
10. Spencer S.J. Locked intramedullary nailing of symptomatic metastases in the humerus / S.J. Spencer // J. Bone Joint Surg. Br. — 2010. — Vol. 92-B, № 1. — Р. 142-145.
11. Wedin R. Surgical treatment of skeletal metastatic lesions of the proximal femur: Endoprosthesis or reconstruction nail? / R. Wedin // J. Bone Joint Surg. Br. — 2005. — Vol. 87-B. — Р. 1653-1657.

/66.jpg)
/67.jpg)