Статтю опубліковано на с. 73-77
Травми периферичних нервів досить часто зустрічаються в умовах мирного й воєнного часу. Незадовільні результати після проведеного хірургічного лікування пов’язані в першу чергу з розвитком механічних перешкод (травматичної невроми, фіброзу) на шляху регенеруючих фасцикул нерва, також порушення трофіки пов’язане з порушенням мікроциркуляції в зоні фіброзу [1]. Це стосується регенерації епі- та периневрію травмованого нерва й експансивного росту кровоносних судин та сполучної тканини [2, 3]. Різноманітні технології пластики, різні трансплантати та покриття були запропоновані для покращення результатів відновлення нерва, але значного покращення не дає на даний момент жодна технологія [4].
Спочатку пропонувалося максимальне видалення оточуючої ушкодженої параневральної тканини, щоб мінімізувати вірогідність розвитку рубцевих явищ [5]. У подальшому запропоновано в ділянці нейрорафії використовувати деякі органічні гелі [6, 7].
При застарілих ушкодженнях, для яких характерні колагеногенез фасцикул нерва, почали застосовувати невроліз [8] і пластику нерва після видалення великих дефектів [9, 10], але жодна технологія не давала задовільного результату при пластиці великих дефектів понад 10 см.
У подальшому було відмічено: те, що оточення нерва бідне на жирову клітковину, призводить до вираженої рубцевої трансформації параневральних тканин, фіксує нерв з оточуючими тканинами, перешкоджаючи їх ковзанню при рухах, зокрема у гомілково-ступневому суглобі. Було зроблено висновок, що виражений параневральний шар жирової клітковини є дуже корисним захисним бар’єром у цих ділянках і його збереження при втручаннях на нерві є дуже важливим. Запас шкіри та м’яких тканин у параневральному оточенні запобігає фіброзуванню, фіксації й компресії нерва, дозволяє зберегти ковзальні властивості та захищає його від механічних ушкоджень. Саме тому для збереження параневральних ковзальних властивостей запропоновано використання як місцевих засобів.
Спочатку для відновлення характеристик тканин здійснювали формування тканинно-жирового ложа (футляра) та введення поліакриламідного гелю (ней-рогель, естеформ), а в подальшому для запобігання адгезивним і рубцевим явищам і трофічній активації почали застосовувати плазму, збагачену тромбоцитами, й суспензію жирових клітин [11, 12]. На нашу думку, нанесення на нейронтрансплантат жироплазмотромбоцитарної (ЖПТ) суміші чинить активуючий вплив на регенерацію фасцикул, оскільки тромбоцити вивільняють різні тканинні фактори росту, а жирова тканина запобігає фіброзуванню нерва з оточуючими тканинами протягом терміну життєздатності адипоцитів (6–8 місяців), зменшує фіксацію нерва з параневральними тканинами і зберігає ковзальну здатність. Також фактори росту судин забезпечують швидке проростання капілярів, таким чином зменшуючи гіпоксію тканин та запобігаючи фіброзу.
Для підтвердження цієї думки було проведено експериментально дослідження з хірургічного відновлення великого дефекту нерва й застосування ЖПТ- суміші для місцевої стимуляції відновних процесів.
Матеріали та методи
Методологія експерименту
Експерименти були проведені на дослідних тваринах — щурах і кроликах (30 щурів і 30 кроликів). В основу аналізу покладено результати проведення двох ідентичних експериментів, метою яких було дослідження закономірностей регенерації сідничного нерва при реконструкції великих дефектів. Тварини були розподілені на 3 групи: 1) контрольна група (без ушкодження сідничного нерва); 2) дослідна група (пластика сідничного нерва); 3) автопластика нерва із нанесенням плазми, збагаченої тромбоцитами (у щурів) і жироплазмотромбоцитарної суміші (у кроликів). Тваринам створювали дефект сідничного нерва довжиною 1 см (що відповідає 1/3 довжини кінцівки, тобто дефекту понад 10 см у людини) та здійснювали пластику виділеним сегментом нерва. Приготовану суспензію жирової тканини та збагаченої тромбоцитами плазми наносили навколо сегмента пластики сідничного нерва.
Плазму, збагачену тромбоцитами, застосовували у вигляді гелю локально в об’ємі 1 мл. Плазму готували з використанням бичачого тромбіну у співвідношенні 1 : 7, при цьому концентрація тромбоцитів у 8 разів перевищувала їх рівень у нативній крові, і вона була позбавлена фракції лейкоцитів.
Жирову тканину для вкривання зони пластики вилучали з великого сальника, фрагментували та змішували зі збагаченою тромбоцитами плазмою у співвідношенні 1 : 2.
Премедикацію дослідних тварин здійснювали шляхом введення тіопенталу натрію (і.р. 60 мг/кг). Експериментальні маніпуляції проводили відповідно до правил: Regulations on the animal use of in research biomedical research, European Convention for the protection of vertebrate animals used for experimental and other scientific purposes, Guide for the Care and Use of Laboratory Animals.
Гістологічне дослідження
Через 1 місяць після проведеної операції тварин повторно наркотизували та здійснювали видалення й підготовку окремих сегментів травмованого сідничного нерва для гістологічного дослідження. Фрагменти нерва поміщали в 10% нейтральний формалін, після чого із фіксованих ділянок на кріотомі виготовляли гістологічні зрізи товщиною 15–20 мкм. Із гістологічних методик забарвлення була використана імпрегнація азотнокислим сріблом. Морфометричний аналіз проводили за допомогою програмного забезпечення Carl Zeiss (AxioVision SE64 Rel.4.9.1) та мікроскопа Olympus BX 51 (Японія).
Статистична оцінка
Порівняння отриманих результатів здійснювали за допомогою t-критерію Стьюдента. Рівень статистичної значущості був встановлений на рівні Р < 0,05.
Результати досліджень
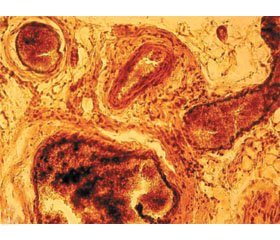
Через 30 діб після моделювання травми сідничного нерва й подальшої пластики встановлено формування значного об’єму параневральної сполучної тканини, що фіксувала регенеруючий нерв з оточуючими м’язами та шкірою (рис. 1).
На гістологічному рівні було підтверджено наявність регенеративних процесів у зоні пластики нерва й дистальному сегменті, проте рівень проростання новоутворених кластерів нервових волокон суттєво відрізнявся між групами порівняння. Низький рівень регенерації у групі 2 пов’язаний із формуванням сполучнотканинного і гліального рубця навколо проксимального і дистального швів, осередковими рубцями в сегменті пластики нерва й ремоделюванням стромальних елементів травмованого нерва, у першу чергу ендоневрію та епіневрію. Останній характеризувався розростанням сполучної тканини й новоутворених кровоносних судин.
/75.jpg)
У групі 3 (при застосуванні тканинних гелів) встановлено значно вищий рівень регенерації сідничного нерва крізь сегмент пластики (рис. 2). Так, при застосуванні плазми, збагаченої тромбоцитами, рівень регенерації в щурів на 79,1 % перевищив показники групи 2 у дистальному сегменті (p < 0,05), а в дослідах із застосування жироплазмотромбоцитарної суміші в кроликів рівень регенерації осьових циліндрів досяг дистального шва сегмента пластики, проте результат вірогідно перевищував показники групи 2 у 2 рази (p < 0,05) (табл. 1). При нанесенні гелю, що містив плазму, збагачену тромбоцитами, а також комбінованого гелю з адипоцитами відмічено зменшення щільності сполучнотканинних елементів навколо епіневральних швів нерва, відносно менший ступінь реорганізації епіневрію й системи регіонарних кровоносних судин.
/76.jpg)
Ці дані вказують на те, що раннє застосування тканинних матеріалів, що містять тромбоцитарну плазму та активовані адипоцити, у вигляді суспензії або гелю активує репаративні процеси в проксимальному відділі нерва й запобігає сполучнотканинному заміщенню його дистальних сегментів, зростанню з параневральними тканинами.
Узагальнюючи результати експериментальних досліджень, можна зробити висновок про те, що навіть вдало проведена хірургічна пластика великого сегмента травмованого периферичного нерва потребує ранньої стимуляції щодо відновлення та заходів щодо запобігання фіброзним явищам у нерві та параневральних тканинах. Застосування плазми, збагаченої тромбоцитами, та тромбоцитарної плазми із суспензією адипоцитів дозволяє вплинути на репаративні процеси, трофічно підтримує ушкоджений нерв, пригнічує фібротичні зміни і тим самим створює сприятливе мікросередовище для забезпечення бажаного відновного процесу.
Висновки
1. Тваринні моделі достатньо точно відтворюють процеси, що проходять при пластиці великих дефектів у людини.
2. Основною причиною невдач при пластиці великих дефектів є фіброз навколо нерва та в місці дистального шва.
3. Недостатність трофіки та гіпоксія погіршують регенераторні процеси в зоні пластики.
4. Тромбоцитарні фактори росту забезпечують швидке проростання капілярів у зону пластики, зменшуючи ступінь дегенеративних процесів та покращуючи якість регенерації.
5. Застосування жирової тканини дозволяє створити навколо зони пластики захисну муфту, що запобігає здавлюванню нерва оточуючим рубцем та дозволяє відновити ковзні властивості в зоні пластики.
Список литературы
1. Maciel F.O., Viterbo F., Chinaque Lde F., Souza B.M. Effect of electrical stimulation of the cranial tibial muscle after end-to-side neurorrhaphy of theperoneal nerve in rats // Acta Cir. Bras. — 2013. — Vol. 28(1). — P. 39-47.
2. Yokota A., Doi M., Ohtsuka H., Abe M. Nerve conduction and microanatomy in the rabbit sciatic nerve after gradual limb lengthening-distraction neurogenesis // J. Orthop. Res. — 2003. — Vol. 21(1). — P. 36-43.
3. Shevtsov V.I., Shchudlo N.A., Shchudlo M.M., Borisova I.V. Peculiarities of sciatic nerve endoneurium cellular composition in hip distraction osteosynthesis in dogs // Morfologiia. — 2007. — Vol. 132(4). — P. 39-43.
4. Boyd K.U., Nimigan A.S., Mackinnon S.E. Nerve reconstruction in the hand and upper extremity // Clin. Plast. Surg. — 2011. — Vol. 38(4). — P. 643-660.
5. Siemionow M., Zielinski M., Meirer R. The Single-Fascicle Method of Nerve Grafting // Annals of Plastic Surgery. — 2004. — Vol. 52(1). — P. 72-79.
6. Ramanan M., Chandran K.N. Common peroneal nerve decompression // ANZ J. Surg. — 2011. — Vol. 81(10). — P. 707-712.
7. Ward J.P., Yang L.J., Urquhart A.G. Surgical Decompression Improves Symptoms of Late Peroneal Nerve Dysfunction After TKA // Orthopedics. — 2013. — Vol. 36(4). — P. e515-519.
8. Nazzi V., Cordella R., Messina G., Dones I., Franzini A. Role of intra-operative neurophysiologic monitoring during decompression and neurolysis after peripheral nerve injury: case report // Somatosens. Mot. Res. — 2012. — Vol. 29(4). — P. 117-121.
9. Flores L.P. The radio-radial nerve transfer for elbow extension restoration in C5 to C7 nerve root injury // Microsurgery. — 2012. — Vol. 32(1). — P. 55-59.
10. Murphy R.K., Ray W.Z., Mackinnon S.E. Repair of a median nerve transection injury using multiple nerve transfers, with long-term functional recovery // J. Neurosurg. — 2012. — Vol. 117(5). — P. 886-889.
11. Kilic A., Ojo B., Rajfer R.A. [et al.]. Effect of white adipose tissue flap and insulin-like growth factor‑1 on nerve regeneration in rats // Microsurgery. — 2013. — Vol. 33(5). — P. 367-375.
12. Javaloy J., Alió J.L., Rodriguez A.E., Vega A., Muñoz G. Effect of platelet-rich plasma in nerve regeneration after LASIK // J. Refract. Surg. — 2013. — Vol. 29(3). — P. 213-219.

/75.jpg)
/76.jpg)
/75_2.jpg)