Статтю опубліковано на с. 78-85
Вступ
Біль у спині є однією з найбільш частих скарг, з якою пацієнти звертаються до лікаря. За даними Deyo і Weinstein, кількість амбулаторних візитів зі скаргою на біль у нижній частині спини (БНЧС) у загальній картині звернень посідає друге місце, поступаючись лише респіраторним захворюванням [1]. Було показано, що в розвинутих країнах від 60 до 90 % населення відчували БНЧС мінімум раз у житті, а щорічний приріст цього показника становить 5 % [2]. Діагностика та лікування БНЧС часто є складним завданням, що пов’язано з етіологічною неоднорідністю захворювання.
Більшість випадків БНЧС мають доброякісний характер і м’язово-скелетне походження. Такий БНЧС називається неспецифічним і на відміну від специфічного обумовлений підтвердженою первинною патологією (інфекція, пухлина, деформація, остеопоротичний або травматичний перелом хребця, запальний процес, радикулярний синдром, стеноз хребетного каналу та ін.). Незважаючи на те, що немає точних даних про співвідношення специфічного і неспецифічного БНЧС, загальноприйнято вважати, що 95 % випадків припадає на неспецифічний БНЧС [3, 4].
Сьогодні очевидним є той факт, що вираженість больового синдрому не завжди корелює з розмірами грижі диска і ступенем компресії нервового корінця [5–7]. Клініцисти добре знайомі з ситуацією, коли у хворого з інтенсивними болями при проведенні МРТ виявляються негрубі зміни і, навпаки, у пацієнта з помірним больовим синдромом або без больових відчуттів може бути виявлена грижа диска великих розмірів. Локалізація клінічних симптомів також не завжди відповідає локалізації грижі міжхребцевого диска. Тому важливо визначати провідний механізм розвитку болю, щоб із самого початку правильно вибрати лікувальну стратегію та мінімізувати ризик хронізації болю або його повторення. 1987 року у Квебеку спеціальна робоча група запропонувала діагностичні критерії для класифікації захворювань хребта з метою допомоги у прийнятті клінічного рішення, оцінки якості медичної допомоги, оцінки прогнозу та проведення досліджень.
Мета дослідження — визначити клінічні профілі пацієнтів із болем у нижній частині спини відповідно до груп за класифікацією захворювань хребта Квебекської спеціальної комісії (КЗХКСК).
Матеріали та методи
У дослідження було включено 103 пацієнти з хронічними попереково-крижовими больовими синдромами (діагнози: люмбалгія та люмбоішіалгія).
Обстеження починалося з клініко-неврологічного огляду, за результатами якого проводився відбір пацієнтів згідно з критеріями включення та виключення.
Критерії включення:
— Вік понад 18 і менше 60 років.
— Біль у попереково-крижовій ділянці з іррадіацією в ногу або без такої.
— Інтенсивність болю за ВАШ — 4 бали і більше.
— Тривалість болю — 3 місяці та більше.
— Для жінок фертильного віку — відсутність вагітності та прийому оральних контрацептивів.
— Підписання інформованої згоди на участь у дослідженні.
Критерії виключення:
— Наявність тяжкої соматичної патології.
— Синдром кінського хвоста.
— Перелом хребта.
— Вроджені аномалії розвитку хребта.
— Пухлина хребта.
— Активний інфекційний процес.
З метою оцінки рухливості поперекового відділу хребта проводили пальце-підлогову пробу (ППП) і модифікований тест Шобера.
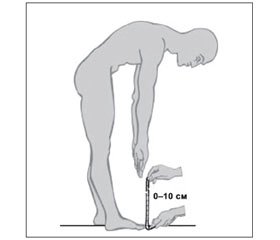
ППП проводиться при прямих колінах. Пацієнта просять дотягнутися пальцями рук до підлоги і вимірюють цю відстань. У нормі вона повинна становити від 0 до 10 см (рис. 1).
Модифікований тест Шобера (рис. 2) проводиться у вертикальному положенні пацієнта. Спочатку пальпаторно визначають задні верхні клубові ості та на середині відстані між ними наносять відмітку. Потім за допомогою вимірювальної стрічки наносять другу (на 5 см нижче) і третю (на 10 см вище) мітки. Пацієнта просять не згинати коліна й дотягнутися пальцями рук до пальців ніг. У цей час вимірюють відстань між верхньою і нижньою позначками і визначають її збільшення щодо вихідного значення. У нормі вона повинна становити 5 см і більше. Значення менше 5 см свідчить про обмеження рухливості поперекового відділу хребта.
З метою об’єктивізації наявності ураження корінця чи інших структур проводився аналіз МРТ і рентгенограм попереково-крижового відділу хребта.
Оцінка больового синдрому проводилася за допомогою візуальної аналогової шкали (ВАШ) та больового опитувальника Мак-Гілла. При використанні ВАШ пацієнту пропонували відобразити суб’єктивне відчуття болю. Шкала проградуйована від 0 до 10, де 0 — відсутність болю, 10 — максимально сильний біль, який коли-небудь доводилося відчувати пацієнту.
Аналіз за больовим опитувальником Мак-Гілла дає якісну характеристику болю. Опитувальник складається з сімдесяти восьми прикметників (дескрипторів), що описують біль [8]. Дескриптори болю розподілені за класами щодо наростання смислового значення. Перший клас (1–13-й пункти) дає характеристику болю на сенсорному, другий клас (14–18-й) — на психоемоційному рівні, третій клас (20-й) являє собою вербальну шкалу інтенсивності болю. Пацієнту пропонують відзначити одне слово, що найбільш точно відображає його больові відчуття в будь-якому (не обов’язково в кожному) з класів. Нами використовувався варіант перекладу опитувальника, підготовлений співробітниками Російського державного медичного університету, Московського державного університету ім. М.В. Ломоносова та Центрального інституту травматології і ортопедії ім. М.М. Пріорова [9].
Статистична обробка матеріалу проводилася за допомогою комп’ютерної програми SPSS 17. Для всіх статистичних обчислень була встановлена помилка першого роду на рівні 5 %. Кількісні змінні описувалися середнім значенням і стандартним відхиленням, для їх визначення використовувалася програма описової статистики. Якісні змінні описувалися частотою і процентом представленості. Достовірність групових відмінностей для сукупностей, що підпорядковуються нормальному розподілу, оцінювали за допомогою критерію Стьюдента (T). У випадку, коли вибірки не підкорялися нормальному розподілу, а також для аналізу якісних параметрів застосовувався U-критерій Вілкоксона — Манна — Уїтні та точний метод Фішера. Для порівняння трьох і більше груп застосовувався дисперсійний аналіз (ANOVA).
Всі пацієнти були розподілені на групи, відповідно до класифікації захворювань хребта Квебекської спеціальної комісії, що поділяє всі захворювання хребта на 11 груп, ґрунтуючись на даних клінічного обстеження, локалізації болю, результатах параклінічних досліджень та ефективності лікування [10, 11] (табл. 1).
/80.jpg)
У нашій роботі ми провели розподіл пацієнтів на 4 групи за КЗХКСК згідно з даними клінічного обстеження. До першої групи були зараховані пацієнти з БНЧС без іррадіації в ногу (перша група за КЗХКСК). До другої групи — пацієнти з БНЧС, іррадіацією болю в ногу до рівня коліна і відсутністю неврологічного дефіциту (нормальні рефлекси, відсутність сенсорного або моторного дефіциту (друга група за КЗХКСК)). До третьої групи — пацієнти з БНЧС, іррадіацією болю в ногу нижче від рівня коліна і відсутністю неврологічного дефіциту (нормальні рефлекси, відсутність сенсорного або моторного дефіциту (третя група за КЗХКСК)). До четвертої групи — пацієнти з БНЧС, іррадіацією болю в ногу за ділянками дерматомів і наявністю неврологічного дефіциту в цих ділянках (м’язова слабкість, атрофії м’язів, зниження або відсутність рефлексів, сенсорні порушення), що відповідає картині класичної радикулопатії (четверта група за КЗХКСК)). Розподіл пацієнтів на групи поданий у табл. 2.
Результати
Було обстежено 103 пацієнти (37 чоловіків, 66 жінок, середній вік 41,22 ± 10,92 року) з діагнозами «люмбалгія» (n = 23) та «люмбоішіалгія» (n = 80). Інтенсивність болю на момент обстеження за ВАШ становила 5,2 ± 1,15, у чоловіків — 5,24 ± 1,04, у жінок — 5,18 ± 1,21. Середня тривалість захворювання — 19,60 ± 23,95 міс., у чоловіків — 16,85 ± 22,03 року, у жінок — 21,15 ± 24,98 року, мінімальний показник — 3 місяці, максимальний — 10 років. Середній вік появи перших симптомів захворювання — 41,83 ± 11,38 року, у чоловіків — 42,05 ± 10,81 року, у жінок — 41,71 ± 11,77 року. Характеристика групи пацієнтів наведена в табл. 3.
У скаргах пацієнтів найбільш часто зустрічались такі дескриптори болю: тягнучий, викручуючий, подібний до удару струму, пекучий, колючий, подібний до електричного розряду та інші. Характеристика дескрипторів болю та їх поширеність зазначені у табл. 4.
Пекучі, гарячі та палючі болі зустрічались у 41 (39,8 %) пацієнта. Стріляючі, подібні до удару струмом, електричного розряду болі зустрічались у 54 (52,4 %) пацієнтів. Вони мали короткочасний характер (від декількох секунд до 1–2 хвилин), глибоку локалізацію і високу інтенсивність, частіше виникали при русі або мимовільно. Тягнучі болі зустрічались у 82 (79,6 %) пацієнтів, викручуючі — у 63 (61,2 %).
При дослідженні чутливої сфери у пацієнтів із БНЧС були виявлені як позитивні, так і негативні сенсорні феномени.
До негативних феноменів, що були виявлені в групі, належали: знижене або відсутнє відчуття дотику ватною паличкою, проведення щіточкою, уколу голкою, дотику пробіркою з гарячою або холодною водою.
/81.jpg)
Так, відсутність відчуття дотику ватною паличкою у найбільш дистальній ділянці поширення болю порівняно зі здоровою стороною було виявлено у 23 (22,3 %) пацієнтів, зниження — у 33 (32,0 %). Відсутність відчуття при проведенні щіточкою у найбільш дистальній ділянці поширення болю порівняно зі здоровою кінцівкою було визначено у 6 (5,8 %) пацієнтів, зниження — у 19 (18,4 %) пацієнтів, підвищення — у 1 (1,0 %) пацієнта. Відсутність відчуття при уколі голкою в найбільш дистальній ділянці поширення болю порівняно зі здоровою кінцівкою було зареєстровано у 3 (2,9 %) пацієнтів, зниження — у 33 (32,0 %) пацієнтів, гіпералгезія спостерігалась у 11 (10,7 %) пацієнтів. Зниження чутливості дотику пробіркою з теплою водою порівняно зі здоровою кінцівкою було виявлено у 3 (2,9 %) пацієнтів, із холодною водою — у 7 (6,8 %) пацієнтів.
До позитивних сенсорних феноменів, що були виявлені в групі, належали парестезії та алодинія. Парестезії були виявлені у 47 (45,6 %) пацієнтів. Локалізація парестезій подана в табл. 5.
У 14 (13,6 %) пацієнтів був виявлений феномен алодинії, що частіше за все був представлений механічною динамічною алодинією — 9 (8,7 %) пацієнтів. Детальна характеристика виявлених видів алодинії наведена в табл. 6.
Феномен алодинії зустрічався у різних ділянках тіла, але частіше на рівні гомілки (n = 9) — 64,3 %, ніж на рівні стегна (n = 7) — 50,0 %.
Знижені або відсутні рефлекси були виявлені у 23 (22,3 %) пацієнтів. Серед них у 4 (3,9 %) пацієнтів відзначалося зниження колінних рефлексів, у 19 (18,4 %) — ахілових. Ахілів рефлекс не визначався у 6 (5,8 %) пацієнтів. Дані про зміни рефлексів подані в табл. 7.
У 9 (8,7 %) осіб виявлено слабкість м’язів нижньої кінцівки, а саме у 5 (88,8 %) пацієнтів відзначалося утруднення тильного згинання стопи, у 4 (3,9 %) — утруднення підошовного згинання стопи. Крім того, у 3 (2,9 %) пацієнтів мала місце атрофія м’язів гомілки. У 33 (32,0 %) пацієнтів визначався позитивний симптом Ласега.
При проведенні модифікованого тесту Шобера було виявлено зниження його показників щодо нормативних. Так, середнє значення модифікованого тесту Шобера в групі пацієнтів становило 19,65 ± 2,02 см. Середнє значення, отримане при проведенні ППП у групі пацієнтів, дорівнювало 22,18 ± 10,11 см.
Згідно з КЗХКСК, пацієнти були розподілені на чотири групи. Значних відмінностей між групами за тривалістю болю і співвідношенням чоловіків і жінок не спостерігалося. Пацієнти групи I мали достовірно менший вік порівняно з іншими групами. Інтенсивність болю за ВАШ була достовірно вищою у групі IV порівняно з іншими групами. Показники модифікованого тесту Шобера були достовірно нижчими у групі IV порівняно з групою I, тоді як значення ППП були достовірно меншими у групі I порівняно з групою IV. Характеристика груп пацієнтів подана в табл. 8.
Шість пацієнтів із групи II мали сенсорний дефіцит у найбільш дистальній ділянці поширення болю у вигляді зниженої (n = 4) та відсутньої (n = 2) чутливості на дотик ватною паличкою (малий тактильний дефіцит), в одного пацієнта відзначалося зниження чутливості при проведенні пензлем з натуральної щетини (великий тактильний дефіцит).
Вісім пацієнтів групи III мали сенсорні порушення у найбільш дистальній ділянці поширення болю у вигляді зниженої (n = 2) та відсутньої (n = 10) чутливості на дотик ватною паличкою.
У групі IV сенсорний дефіцит виявлено у 90 % випадків. В 11 пацієнтів відзначалася відсутність чутливості на дотик ватною паличкою, у 26 — зниження чутливості; у 17 — була знижена чутливість на проведення пензлем, у 6 — відсутня, в 1 — підвищена; 33 пацієнти відзначали зниження чутливості при дотику голкою; 3 пацієнти не відчували дотику; в 11 пацієнтів виявлена гіпералгезія; 3 пацієнти гірше розрізняли тепловий стимул порівняно зі здоровою кінцівкою, 7 — холодовий. Розладів вібраційної чутливості в групі не спостерігалося. Детальна характеристика розладів чутливості подана в табл. 9.
У 14 пацієнтів групи IV спостерігався феномен алодинії, що був представлений статичною (n = 3) і динамічною (n = 11) алодинією, алодинією у відповідь на дотик холодним (n = 3) та гарячим (n = 1) предметами. У 2 пацієнтів мала місце динамічна алодинія у ділянках гомілки і стопи одночасно, в одного — у ділянках стегна і гомілки одночасно. Детальна характеристика типів алодинії, її локалізації та частоти наведена в табл. 10.
У групі IV також спостерігались зміни в рефлекторній сфері, зниження сили м’язів та атрофія м’язів. Зниження сили м’язів у нижніх кінцівках виявилось у 10 (24,4 %) пацієнтів і було представлено легким (n = 7) і помірним (n = 3) ступенем моторного дефіциту. У 3 (7,3 %) пацієнтів спостерігалась атрофія м’язів гомілки. У 20 (48,8 %) пацієнтів були наявні зміни сухожилкових рефлексів із ніг, а саме зниження колінного рефлексу — 4 (9,8 %) особи, зниження ахілового рефлексу — 10 (24,4 %) осіб та відсутні ахілові рефлекси — 6 (14,6 %) пацієнтів.
Обговорення
Внаслідок роботи було визначено, що група I за КЗХКСК характеризується достовірно меншим віком і меншою інтенсивністю болю за ВАШ. У переважної кількості пацієнтів цієї групи тривалість болю становила від 3 до 6 місяців, що було значно меншим порівняно з іншими групами. Перша група пацієнтів за КЗХКСК також мала достовірно найбільші показники тесту Шобера та найменші показники ППП порівняно з іншими групами. Це свідчить про найменшу ступінь обмеження рухливості в поперековому відділі хребта порівняно з іншими групами. Протилежні дані були отримані при визначенні характерних клінічних особливостей пацієнтів у групі II за КЗХКСК.
Було визначено, що група IV за КЗХКСК характеризується достовірно (p < 0,05) більшим віком (45,59 ± 10,57 року) та більшою інтенсивністю болю за ВАШ (5,66 ± 1,11 бала). В цій групі частіше зустрічався біль, подібний до удару струмом (85,4 %), пекучий (70,7 %), гарячий (34,1 %), палючий (31,7 %) та колючий (22,0 %) біль. Ці дескриптори є специфічними для невропатичного компоненту болю [12–14]. Статистично значущо частіше в групі IV за КЗХКСК відзначались такі сенсорні феномени, як гіпалгезія (63,4 %), парестезія (70,7 %), алодинія (34,1 %) та гіпералгезія (2,4 %); частіше також зустрічався позитивний симптом Ласега (58,5 %). Майже у 30 % пацієнтів цієї групи тривалість болю становила понад 3 роки, що було значно більшим порівняно з іншими групами. Четверта група пацієнтів за КЗХКСК також мала достовірно найменші показники тесту Шобера (18,88 ± 1,89 см) та найбільші показники ППП (25,95 ± 8,52 см) порівняно з іншими групами. Це свідчить про найбільший ступінь обмеження рухливості в поперековому відділі хребта порівняно з іншими групами.
Отже, за даними клініко-неврологічної характеристики групи пацієнтів визначено, що всі вони мають як певні спільні риси (тривалість болю, дескриптори болю, наявність сенсорного дефіциту та ін.), так і певні особливості, що добре виділяються при розподілі групи пацієнтів на 4 підгрупи за КЗХКСК (значення тесту Шобера, ППП, наявність алодинії, зниження рефлексів, м’язової сили, наявність атрофії м’язів).
Висновки
1. Пацієнти з хронічними больовими синдромами попереково-крижової локалізації мають певні клінічні особливості, що чітко виділяються при розподілі пацієнтів на групи відповідно до КЗХКСК.
2. Лікарям різних спеціальностей доцільно використовувати у своїй клінічній практиці КЗХКСК із метою оцінки провідного механізму болю, прогнозу захворювання та вибору механізм-орієнтованої терапії.
Список литературы
1. Deyo R.A. Low back pain / R.A. Deyo, J.N. Weinstein // N. Engl. J. Med. — 2001. — Vol. 344. — P. 363-370.
2. Andersson G.B.J. The epidemiology of spinal disorders // JW F, ed. The adult spine: principles and practice, 2nd ed. — New York: Raven Press. — 1997. — Р. 93-14.
3. Croft P. Back pain / P. Croft, H. Raspe // Baillieres Clin. Rheumatol. — 1995. — Vol. 9. — Р. 565-583.
4. Henschke N. Prevalence of and screening for serious spinal pathology in patients presenting to primary care settings with acute low back pain / C.G. Maher, K.M. Refshauge, R.D. Herbert, R.G. Cumming, J. Bleasel, J. York, A. Das, J.H. McAuley // Arthritis and Rheumatism. — 2009. — Vol. 60. — Р. 3072-3080.
5. Suri P. Longitudinal associations between incident lumbar spine MRI findings and chronic low back pain or radicular symptoms: retrospective analysis of data from the longitudinal assessment of imaging and disability of the back (LAIDBACK) / P. Suri, E.J. Boyko, J. Goldberg et al. // BMC Musculoskeletal Disorders. — 2014. — Vol. 15. — P. 52.
6. Jensen M.C. Magnetic resonance imaging of the lumbar spine in people without back pain / M.C. Jensen, M.N. Brant-Zawadzki, N. Obuchowski et al. // N. Engl. J. Med. — 1994. — Vol. 331(2). — P. 69-73.
7. Jensen M.C. Magnetic resonance imaging of the lumbar spine in people without back pain / M.C. Jensen, M.N. Brant-Zawadzki, N. Obuchowski et al. // New England Journal of Medicine. — 1994. — № 331. — P. 69-73.
8. Melzack R. The McGill Pain Questionnaire: major properties and scoring methods / R. Melzack // Pain. — 1975. — Vol. 1(3). — P. 277-299.
9. Кузьменко В.В. Психологические методы количественной оценки боли / В.В. Кузьменко, В.А. Фокин, Е.Л. Соков // Сов. мед. — 1986. — № 10. — С. 44-48.
10. Atlas S.J. The Quebec Task Force classification for Spinal Disorders and the severity, treatment, and outcomes of sciatica and lumbar spinal stenosis / S.J. Atlas, R.A. Deyo, D.L. Patrick et al. // Spine. — 1996. — Vol. 21. — P. 2885-2892.
11. Report of the Quebec Task Force on Spinal Disorders. Scientific approach to the assessment and management of activity-related spinal disorders. A monograph for clinicians. — Phyladelphia: Spine. — 1987. — P. 1-59.
12. Lewis R.A. Tackling neuropathic pain: different perspectives of clinicians and investigators / R.A. Lewis, G. Said // Neurology. — 2008. — Vol. 70(18). — P. 1582-1583.
13. Smart K.M. Clinical indicators of «nociceptive», «peripheral neuropathic» and «central» mechanisms of musculoskeletal pain. A Delphi survey of expert clinicians / K.M. Smart, C. Blake, A. Staines et al. // Man. Ther. — 2009. — Vol. 1. — P. 80-87.
14. Treede R.D. Neuropathic pain: redefinition and a grading system for clinical and research purposes / R.D. Treede, T.S. Jensen, J.N. Campbell et al. // Neurology. — 2008. — Vol. 70(18). — P. 1630-1635.
/80.jpg)

/79.jpg)
/81.jpg)
/82.jpg)
/83.jpg)