Статтю опубліковано на с. 7-12
Вступ
Убіквітин-протеасомна протеолітична система являє собою багатокомпонентний білковий комплекс, що забезпечує енергоємний процес розщеплення відпрацьованих короткоживучих протеїнів, у тому числі регуляторних, або ж протеїнів, синтезованих зі структурними дефектами. Шляхом селективного протеолізу в клітині контролюються усі фундаментальні процеси — проліферація та диференціація клітин, синтез біологічно активних протеїнів, репарація ДНК, апоптоз тощо [1]. Протеасомна система відіграє значну роль у підтриманні життєдіяльності та функціонуванні імунних клітин, а також виконує специфічні функції — антигенпрезентація, позитивна селекція лімфоцитів у тимусі, регуляція основних внутрішньоклітинних сигнальних шляхів з подальшим синтезом цитокінів та навіть посттрансляційна модифікація структурних білків шкіри для забезпечення бар’єрної функції.
Центральним компонентом протеасоми є 20S каталітичне ядро, що складається з 4 кілець і містить порожнину всередині. Зовнішні кільця являють собою ланцюжки з’єднаних між собою 7 α-субодиниць, внутрішні — 7 субодиниць β-типу, кожна з яких займає визначене положення. Лише три β-субодиниці мають каталітичну активність — β1, β2 та β5, а заміна їх альтернативними субодиницями призводить до зміни протеолітичних властивостей протеасоми [17].
Біогенез 20S протеасоми відбувається в декілька етапів — формування кілець з α-субодиниць, подальше приєднання β-субодиниць, що призводить до утворення напівпротеасоми та об’єднання останніх в єдину органелу [6, 17]. Приєднання β-субодиниць до α-кільця та об’єднання двох напівпротеасом відбувається при участі шаперону — протеїну дозрівання протеасоми (proteasome maturation protein — POMP) [7, 10]. Розщеплення протеїну POMP, який опиняється в центрі протеолітичної камери і являє собою перший субстрат деградації, сигналізує про успішне завершення синтезу зрілої 20S протеасоми [3, 6, 16].
Блокування протеїну РОМР призводить до порушення процесів біогенезу та зниження гідролізуючих властивостей протеасоми, що веде до накопичення убіквітинованих субстратів у клітині. При дефіциті синтезу імунопротеасом під впливом інтерферону γ рівень експресії антигенів у головному комплексі гістосумісності (major histocompatibility complex — МНС) І типу антигенпрезентуючими клітинами знижується приблизно на 50 % внаслідок порушення процесів їх обробки протеасомами [10, 12].
Продукти протеасомного протеолізу відіграють значну роль в патогенезі атопічних захворювань, а саме в активації факторів транскрипції та регуляції ключових клітинних сигнальних шляхів.
Ядерний фактор κB (Nuclear factor-κB — –NF-κB) — фактор транскрипції, який експресується у більшості клітинних ліній. У відповідь на цитокіни, продукти життєдіяльності вірусів та бактерій, оксидативні ураження NF-κB забезпечують індукцію генів, що призводить до негайного синтезу прозапальних цитокінів та протеїнів, необхідних для підтримки внутрішньоклітинного гомеостазу [6, 9].
До родини NF-κB належать кінази, інгібітори κB (ІκB) і транскрипційні фактори — p65, Rel-B, c-rel, p105/p50, р100/р52 тощо. У цитозолі транскрипційні фактори знаходяться в інактивованому стані за допомогою білків — інгібіторів ІκB. Під впливом стресових факторів відбувається фосфорилювання ІκB, що, у свою чергу, індукує процес убіквітування та деградацію ІκB за допомогою протеасомного протеолізу. Вивільнені таким чином димери NF-κB активуються шляхом посттрансляційних модифікацій та транслокуються в ядро, де відбувається приєднання до специфічних послідовностей ДНК [6, 9].
Серед цитокінів, продукцію яких індукує –NF-κB, особливу увагу слід приділити гранулоцитарно-макрофагальному колонієстимулючому фактору (GM-CSF) та інтерлейкіну (IL) 8. Рівні цих цитокінів підвищені в епітеліальних клітинах дихальних шляхів та периферичних мононуклеарах у пацієнтів з бронхіальною астмою. Доведено, що їх гіперпродукція пов’язана саме з персистуючою надмірною активацією NF-κB, що підтверджується високим рівнем зв’язування р65 з ДНК, зниженням кількості ІκB та локалізацією транскрипційних факторів у ядрі клітин. При цьому слід додати, що постійний прийом глюкокортикостероїдів не забезпечує повною мірою інгібування NF-κB [8].
JunB — транскрипційний фактор, що активує промотори генів IL-4, IL-5 і таким чином безпосередньо бере участь у процесах диференціації Т-хелперів 2-го типу. Окрім того, накопичення JunB в Т-хелперах 2-го типу сприяє високій активності комплексу активуючого протеїну-1 (АР-1), який також виявляє транскрипційну активність порівняно з Т-хелперами 1-го типу. Відомо, що одна з убіквітин-лігаз Е3 Itch шляхом реакції убіквітування відповідає за деградацію JunB. Дефіцит лігази Itch призводить до значного підвищення рівня JunB в Т-клітинах, що, у свою чергу, веде до надмірної продукції цитокінів, характерних для Th2-відповіді [18, 20].
Цікаво, що транскрипційні фактори NF-κB та АР-1, які регулюють синтез багатьох цитокінів, що беруть участь в алергічному запаленні, проявляють синергічну дію. Тобто при активації одразу обох зазначених факторів ступінь уражень при запальному процесі, ймовірно, більший, ніж при активації одного з них [2].
Активація факторів транскрипції може вимагати залучення сигнальних шляхів мітоген-активуючих протеїнкіназ (МАРК). Родина МАРК включає в себе підгрупи Jun аміно-термінальні кінази (JNK), екстрацелюлярні сигнал-регулюючі кінази (ERK) та протеїн р38. Представники кожної з них беруть участь у реалізації алергічного запалення — активації Т-клітин, інфільтрації тканин еозинофілами та мастоцитами, продукції та вивільненні цитокінів, гіперреактивності бронхів та ремодуляції дихальних шляхів при бронхіальній астмі. Особливу увагу приділяють МАРК у контексті кортикостероїд-резистентної бронхіальної астми. Так, сучасні глюкокортикостероїди не пригнічують активність JNK кіназ, які стимулюють АР-1. Крім того, протеїн 38 здатний змінювати структуру рецепторів до глюкокортикостероїдів, що призводить до порушення їх функціонування [15].
Інгібуючий вплив на прозапальний каскад МАРК справляє родина ендогенних подвійно-специфічних МАРК фосфатаз (DUSPs або МРК). МРК-1 при цьому інгібує МАРК-залежну ремодуляцію дихальних шляхів, деградація ендогенного МРК-1 відбувається за допомогою убіквітин-протесомного протеолізу.
Підведемо підсумки: роль убіквитин-протеасомної системи в етіології та патогенезі атопічних захворювань у літературі висвітлюється головним чином як фактор регуляції транскрипції медіаторів алергійного запалення. При цьому не виключається роль протеасом у посттрансляційній модифікації структурних білків шкіри. У цьому контексті привертає увагу дослідження, що виконувалось з метою вивчення KLICK-синдрому — захворювання шкіри, що супроводжується гіперкератозом та іхтіозом. Було виявлено взаємозв’язок однонуклеотидної делеції c.-95delC у 5′ регіоні гена РОМР з розвитком KLICK-синдрому. Окрім того, у результаті дослідження було виявлено зміни активності, структури та локалізації протеасом, що, у свою чергу, призводить до порушення диференціації структурного білка шкіри філагрину [4]. Роль білка філагрину в розвитку атопічного дерматиту (АД) достатньо вивчена на сьогодні [11]. Саме тому визначення ролі протеасом у диференціації молекул профілагрину та формуванні таким чином епідермального водного бар’єра відкриває нові аспекти розвитку атопічного дерматиту та ініціації атопічного маршу.
Виходячи з наведених даних, можна припустити, що поліморфізм rs4769628 гена РОМР може бути асоційованим із розвитком атопічних захворювань у дитячому віці. Для перевірки цієї гіпотези, проведено дослідження відмінності в частоті однонуклеотидного поліморфізму (SNP) rs4769628 у дітей з маніфестацією атопічного маршу та практично здорових дітей.
Матеріали та методи
Поліморфізм rs4769628 гена РОМР досліджувався у 98 дітей віком від 5 до 18 років з бронхіальною астмою, атопічним дерматитом та/або іншим алергічним захворюванням, що перебували на стаціонарному лікуванні в алергологічному відділенні Київської міської дитячої клінічної лікарні № 2. Групу контролю становили 98 дітей віком від 5 до 18 років без алергічної патології. Основна та контрольна групи були порівнянні за віком та статтю. Діагноз бронхіальної астми встановлювався згідно з протоколом діагностики й лікування бронхіальної астми в дітей (№ 868 від 08.10.2013р.) та рекомендаціями глобальної стратегії лікування та профілактики бронхіальної астми GINA (Global Initiative for Asthma, перегляд 2015 року). Діагноз атопічного дерматиту верифікований відповідно до наказу МОЗ України № 767 від 27.12.2005 р., додаток № 5 «Протокол діагностики та лікування дітей з атопічним дерматитом», а також діагностичних критеріїв Hanifin, Rajka (1980). Усім 98 хворим (100,00 %) основної групи проведено такі методи дослідження: клініко-анамнестичний, лабораторні (загальний аналіз крові, загальний аналіз сечі, копрограма, загальний імуноглобулін Е (IgE)), інструментальні (спірометрія, пікфлоуметрія, шкірні проби), генетичні (визначення наявності поліморфізму rs4769628 гена POMP методом полімеразно-ланцюгової реакції (ПЛР) у реальному часі), статистичні методи. Батьки дітей підписали інформовану згоду на включення в дослідження.
Вибір SNP
Поліморфізм rs4769628 гена POMP був обраний для генотипування, тому що гіпотетично він може впливати на розвиток алергічного фенотипу і, як повідомляється, зустрічається в європейських популяціях.
Виділення ДНК
Для виділення ДНК з букального епітелію використовувався набір реагентів DiatomTM Prep 200 («Лаборатория Изоген», РФ). Метод виділення ДНК полягав у застосуванні лізуючого реагенту із гуанідинізоціонатом для лізису клітин, солюбілізації клітинного дебрису та денатурації клітинних нуклеаз. У присутності лізуючого реагента ДНК активно сорбувався на NucleoSТМ-сорбенті, потім відмивався від білків та солей спиртовим розчином. Після чого ДНК була екстрагована із сорбенту та перенесена в стерильні, вільні від ДНК та РНК мікропробірки. Отримана ДНК (40–50 тисяч пар нуклеотидів високої чистоти (OD260/280 нм 1,6–2,0) безпосередньо використовувалася для проведення ПЛР.
Концентрація загального ДНК і РНК визначалася за допомогою NanoDrop спектрофотометра ND1000 (NanoDrop Technologies Inc., США). Вихід чистої ДНК становив 50 мкг. Виділення ДНК проведено згідно з рекомендаціями виробника.
Полімеразна ланцюгова реакція
Реакції ампліфікації проведені за допомогою Fast Real-time PCR System (Applied Biosystems, США), у кінцевій реакції об’ємом 20 мкл, що містив 2X TaqMan Універсальний Master Mix (Applied Biosystems, США), assay C_1445481_10 rs4769628 і матричну ДНК. Ампліфікація фрагментів генів складалася зі стадії денатурації при 95 °С протягом 20 с, а потім 40 циклів ампліфікації при 95 °С протягом 3 с і при 60 °С протягом 30 с. Аналіз даних проводився з 7500 Fast Real-Time PCR Software.
Статистичний аналіз
Отримані під час дослідження результати були опрацьовані за допомогою програми SPSS (версії 22.0) та програмного середовища R (версії 3.0). Для перевірки відповідності розподілу алелей згідно із законом Харді — Вайнберга застосоване веб-програмне забезпечення SNP Analyzer [http://snpanalyzer.uthsc.edu]. Відмінність у частоті алельних варіантів між групами дітей з атопічними захворюваннями і здоровими дітьми визначалась за допомогою χ2-тесту Пірсона. Кількісні та якісні дані, отримані при обстеженні хворих дітей, оброблялися з використанням статистичного пакета Medstat.
Результати
98 дітей (100,00 %) основної групи на момент включення в дослідження мали встановлений діагноз бронхіальної астми згідно з Міжнародною класифікацією захворювань Х перегляду та атопічний дерматит на першому році життя. У 31 хворого (31,60 %) мав місце алергічний риніт (кон’юнктивіт). Усі 98 хворих (100,00 %) основної групи мають випадки алергічних захворювань у сімейному анамнезі. Спадковість обтяжена по обох лініях у 19 дітей (19,38 %), по материнській лінії — у 63 (64,29 %), по батьківській — у 35 (35,71 %). У 32 родичів (32,65 %) спостерігалася бронхіальна астма, у 28 (28,57 %) — алергічний риніт, 29 (29,59 %) мали атопічний дерматит, у 16 родичів (16,32 %) діагностовано харчову алергію, у 10 осіб (10,20 %) виявлено кропив’янку.
У 5 хворих (5,10 %) діагностовано інтермітуючу бронхіальну астму, у 18 дітей (18,37 %) виявлено персистуючу бронхіальну астму легкого ступеня, у 51 особи (52,04 %) встановлено середньотяжку персистуючу, у 24 пацієнтів (24,49 %) — тяжку персистуючу бронхіальну астму. Повний контроль над симптомами бронхіальної астми впродовж останніх 3 місяців досягнуто у 38 хворих (38,77 %), частковий контроль — у 44 дітей (44,89 %), у 16 осіб (16,32 %) діагностована неконтрольована бронхіальна астма.
У 25 хворих (25,51 %) основної групи відмічалась еритематозно-сквамозна форма атопічного дерматиту, еритематозно-сквамозна з ознаками ліхеніфікаціі — у 19 хворих (19,39 %). У 7 (7,14 %) — ліхеноїдна форма атопічного дерматиту. 48 хворих (48,98 %) скаржились на шкірний свербіж, у 32 дітей (32,65 %) відзначалися елементи висипу переважно на згинальних поверхнях кінцівок, обличчі, у 43 (43,88 %) — сухість шкіри, у 19 (19,38 %) — гіперлінеарність долонь і підошов, у 5 (5,10 %) — Pityriasis alba, у 8 (8,16 %) — фолікулярний гіперкератоз, у 11 (11,22 %) — лущення, у 23 (23,47 %) — білий дермографізм, у 6 (6,12 %) — екзема сосків, у 2 (2,04 %) — рецидивуючий кон’юктивіт, у 13 (13,27 %) — інфраорбітальна зморшка Денні — Моргана, у 9 (9,18 %) — періорбітальна інфільтрація.
У 12 хворих (38,71 %) діагностовано інтермітуючий алергічний риніт, з них 7 дітей (22,58 %) знаходилися в стадії загострення, 5 (16,12 %) — у стадії ремісії. У 19 осіб (61,29 %) мав місце персистуючий алергічний риніт, з них у 14 хворих (45,16 %) — у стадії загострення, у 5 (16,12 %) — у стадії ремісії. У 22 хворих (70,96 %) діагностовано легкий перебіг алергічного риніту, у 9 (29,03 %) — середньотяжкий/тяжкий алергічний риніт.
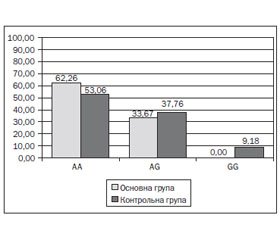
Генотипування показало наступний розподіл алельних варіантів у гені РОМР: у 52 дітей (53,06 %) контрольної групи виявлений мажорний гомозиготний варіант (АА), у 37 (37,76 %) — гетерозиготний (AG), у 9 (9,18 %) — мінорний (GG). Розподіл алельних варіантів поліморфізму rs4769628 гена РОМР відповідає закону розподілу Харді — Вайнберга. У 62 дітей (62,26 %) основної групи була наявна мажорна гомозигота, у 33 (33,67 %) — гетерозиготний варіант, мінорний варіант у дітей основної групи не визначався (рис. 1).
Отже, знайдено статистично значущі відмінності у розподілі генотипів rs4769628 гена РОМР серед дітей основної та контрольної груп (χ2 = 10,16, р < 0,05).
З метою визначення зв’язку поліморфізму rs4769628 гена РОМР із ступенем тяжкості бронхіальної астми дітей основної групи було поділено на дві підгрупи. До 1-ї підгрупи увійшли 24 хворі (24,49 %) з тяжкою персистуючою астмою, з них у 17 осіб (70,83 %) виявлений генотип АА, у 7 (29,17 %) — AG, мінорний генотип в 1-й підгрупі не виявлений. У 2-й підгрупі 69 дітей (70,41 %) мали інтермітуючу, легку персистуючу та середньотяжку персистуючу бронхіальну астму. З них у 44 осіб (63,77 %) виявлений генотип АА, у 25 (36,23 %) — AG, мінорний — не визначений. Статистично значущих відмінностей у частоті виявлення генотипу АG в першій та другій підгрупах не було виявлено (Т = 0,38, р < 0,05) (табл. 1).
Для з’ясування впливу поліморфізму rs4769628 гена РОМР на тяжкість перебігу атопічного дерматиту дітей основної групи було поділено на дві підгрупи. У 1-шу підгрупу увійшов 61 хворий (62,24 %) з атопічним дерматитом легкого ступеня тяжкості та в стадії ремісії. З них 40 осіб (65,57 %) мали генотип АА, 21 (34,43 %) — гетерозиготний варіант, мінорний генотип не зустрічався. До 2-ї підгрупи було включено 34 дитини (34,69 %) з атопічним дерматитом середнього та тяжкого ступеня тяжкості. У 2-й підгрупі мажорний генотип АА виявлений у 23 хворих (67,64 %), гетерозиготний варіант — в 11 (32,35 %), мінорний генотип не виявлений. Частота алельних варіантів rs4769628 гена РОМР залежно від тяжкості атопічного дерматиту подана в табл. 2.
Обговорення та висновки
Літературні дані свідчать про значну роль протеасомного протеолізу в активації факторів регуляції транскрипції медіаторів алергійного запалення. Іінгібітори протеасом, що забезпечують активацію NF-κB, можуть пригнічувати синтез цитокінів, характерних для атопії, та покращувати перебіг відповідних захворювань. Таким чином була продемонстрована ефективність застосування інгібітора протеасом бортезомібу для зниження рівня IgE в сироватці та кількості еозинофілів при проведенні бронхоальвелярного лаважу в мишей з індукованою бронхіальною астмою [21]. Також було показано можливість комбінованого прийому низьких доз інгібітору PS-519 та глюкокортикостероїдів для покращення відповіді на лікування бронхіальної астми на тваринних моделях [5].
Структурні дефекти протеасом також можуть впливати на рівень цитокінів, синтез яких залежить від NF-κB. Наприклад, індукція бронхіальної астми в мишей із делецією гена, що кодує субодиницю β5і, призвела до зниженої Th2-відповіді, що проявилася зменшенням кількості еозинофілів, Т-хелперів 2-го типу. При цьому CD4+ Т-клітини диференціювалися в Т-хелпери 2-го типу з нормальною продукцією IL-4 та IL-5 [19].
Цікавими виявилися результати застосування препарату бортезоміб для лікування атопічного дерматиту в експерименті на тваринних моделях. Незважаючи на зниження кількості плазматичних клітин, рівня загального та алергенспецифічного IgE, зменшення Т-клітинної інфільтрації шарів шкіри, клінічного покращення стану шкіри досягти не вдалося. Такі результати можуть бути пов’язані з інгібуванням посттрансляційної модифікації структурних білків шкіри протеасомами, наприклад, філагрину, що спричинило порушення бар’єрної функції шкіри [14]. Застосування інгібіторів протеасом призводить до підвищення рівня МРК-1, зниження секреції цитокінів клітинами гладенької мускулатури дихальних шляхів, що характерні для бронхіальної астми [13].
З огляду на результати проведених досліджень, що підтверджують роль протеасомного протеолізу у розвитку атопії, було сформульоване припущення, що однонуклеотидні поліморфізми генів, які кодують структурні білки протеасоми, впливають на ризик виникнення атопічних захворювань у дітей.
Поліморфізм rs4769628 гена РОМР був вивчений у європейській популяції та обраний нами для дослідження. У європейській популяції мажорний гомозиготний генотип rs4769628 гена РОМР зустрічається в 67,27 %, гетерозиготний — у 29,09 %, мінорний — у 3,63 %. Отже, розподіл алельних варіантів зазначеного поліморфізму в українців відповідає європейському рівню поширення.
Встановлено, що мінорна алель G rs4769628 гена РОМР зустрічається вірогідно частіше в здорових дітей, ніж у дітей з атопічними захворюваннями (χ2 = 10,16, р < 0,05), асоціюється зі зниженим ризиком розвитку атопії в дітей, має протективне значення й може застосовуватися як прогностичний маркер розвитку атопічних захворювань.
У даному дослідженні не вдалося виявити статистично значущих відмінностей у розподілі генотипів поліморфізму rs4769628 гена РОМР залежно від особливостей клінічного перебігу атопічних захворювань. Отримані результати обумовлені тим, що дані захворювання є мультифакторіальними, і тому їх клінічний перебіг залежить як від сукупності генетичних факторів, так і від несприятливих факторів оточуючого середовища.
Отже, поліморфізм rs4769628 гена РОМР є генетичним маркером для прогнозування розвитку атопії в дітей. Подальші дослідження ролі протеасомного протеолізу та поліморфізмів генів, що забезпечують його активність, у етіології та патогенезі атопічних захворювань є надзвичайно важливим для розробки ефективних заходів профілактики захворювання та підвищення ефективності їх лікування.
Висновок
Подані результати свідчать про те, що мінорна алель G rs4769628 гена РОМР асоційована зі зниженим ризиком розвитку атопічних захворювань у дітей. Даний поліморфізм може використовуватись як прогностичний маркер розвитку атопічних захворювань у дітей.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів.
Список литературы
1. Цимоха А.С. Протеасомы: участие в клеточных процессах / А.С. Цимоха // Цитология. — 2010. — 4 (52). — С. 277-299.
2. Adcock I.M. Cross-talk between pro-inflammatory transcription factors and glucocorticoids / Adcock I.M., Caramori G. // Immunol. Cell Biol. — 2001. — Vol. 79, № 4. — P. 376-84.
3. Burri L. Identification and characterization of a mammalian protein interacting with 20S proteasome precursors / Burri L., Höckendorff J., Boehm U., Klamp T., Dohmen R.J., Lévy F. // Proc. Natl. Acad. Sci USA. — 2000. — Vol. 97, № 19. — P. 10348-53.
4. Dahlqvist J. A single-nucleotide deletion in the POMP 5' UTR causes a transcriptional switch and altered epidermal proteasome distribution in KLICK genodermatosis / Dahlqvist J., Klar J., Tiwari N., Schuster J., Törmä H., Badhai J., Pujol R., van Steensel M.A., Brinkhuizen T., Gijezen L., Chaves A., Tadini G., Vahlquist A., Dahl N. // Am. J. Hum. Genet. — 2010. — Vol. 86, № 4. — P. 596-603.
5. Elliott P.J. Proteasome inhibition: A novel mechanism to combat asthma / Elliott P.J., Pien C.S., McCormack T.A., Chapman I.D., Adams J. // J Allergy Clin Immunol. — 1999. — Vol. 104, № 2. — P. 294-300.
6. Ferrington D.A. Immunoproteasomes: structure, function, and antigen presentation / Ferrington D.A., Gregerson D.S. // Prog. Mol. Biol. Transl. Sci. — 2012. — № 109. — P. 75-112.
7. Fricke B. The proteasome maturation protein POMP facilitates major steps of 20S proteasome formation at the endoplasmic reticulum / Fricke B., Heink S., Steffen J., Kloetzel P.M., Krüger E. // EMBO Rep. — 2007. — Vol. 8, № 12. — P. 1170-5.
8. Gagliardo R. Persistent activation of nuclear factor-kappaB signaling pathway in severe uncontrolled asthma / Gagliardo R., Chanez P., Mathieu M., Bruno A., Costanzo G., Gougat C., Vachier I., Bousquet J., Bonsignore G., Vignola A.M. // Am. J. Respir. Crit. Care Med. — 2003. — Vol. 168, № 10. — P. 1190-8.
9. Hayashi T. Essential role of human leukocyte antigen-encoded proteasome subunits in NF-kappaB activation and prevention of tumor necrosis factor-alpha-induced apoptosis / Hayashi T., Faustman D. // J. Biol. Chem. — 2000. — Vol. 275, № 7. — P. 5238-47.
10. Heink S. IFN-γ-induced immune adaptation of the proteasome system is an accelerated and transient response / Heink S., Ludwig D., Kloetzel P.-M., Krüger E. // Proc. Natl Acad. Sci USA. — 2005. — Vol. 102, № 26. — P. 9241-46.
11. Kelleher M. Skin barrier dysfunction measured by transepidermal water loss at 2 days and 2 months predates and predicts atopic dermatitis at 1 year / Kelleher M., Dunn-Galvin A., Hourihane J.O., Murray D., Campbell L.E., McLean W.H., Irvine A.D. // J. Allergy Clin. Immunol. — 2015. — Vol. 135, № 4. — P. 930-5.
12. Kincaid E.Z. Mice completely lacking immunoproteasomes show major changes in antigen presentation / Kincaid E.Z., Che J.W., York I., Escobar H., Reyes-Vargas E., Delgado J.C., Welsh R.M., Karow M.L., Murphy A.J., Valenzuela D.M., Yancopoulos G.D., Rock K.L. // Nat. Immunol. — 2011. — Vol. 113, № 2. — P. 129-35.
13. Moutzouris J.P. Proteasomal inhibition upregulates the endogenous MAPK deactivator MKP‑1 in human airway smooth muscle: mechanism of action and effect on cytokine secretion / Moutzouris J.P., Che W., Ramsay E.E., Manetsch M., Alkhouri H., Bjorkman A.M., Schuster F., Ge Q., Ammit A.J. // Biochim. Biophys. Acta. — 2010. — Vol. 1803, № 3. — P. 416-23.
14. Mudnakudu Nagaraju K.K. Opposing effects on immune function and skin barrier regulation by the proteasome inhibitor bortezomib in an allergen-induced eczema model / Mudnakudu Nagaraju K.K., Babina M., Worm M. // Exp. Dermatol. — 2013. — Vol. 22, № 11. — P. 742-7.
15. Pelaia G. Mitogen-activated protein kinases and asthma / Pelaia G., Cuda G., Vatrella A., Gallelli L., Caraglia M., Marra M., Abbruzzese A., Caputi M., Maselli R., Costanzo F.S., Marsico S.A. // J. Cell Physiol. — 2005. — № 202. — P. 642-653.
16. Schmidtke G. Analysis of mammalian 20S proteasome biogenesis: the maturation of beta-subunits is an ordered two-step mechanism involving autocatalysis / Schmidtke G., Kraft R., Kostka S., Henklein P., Frömmel C., Löwe J., Huber R., Kloetzel P.M., Schmidt M. // EMBO J. — 1996. — Vol. 15, № 24. — P. 6887-98.
17. Tanaka K. The proteasome: from basic mechanisms to emerging roles / Tanaka K. // Keio J. Med. — 2013. — Vol. 62, № 1. — P. 1-12.
18. Venuprasad K. Convergence of Itch-induced ubiquitination with MEKK1-JNK signaling in Th2 tolerance and airway inflammation / Venuprasad K., Elly C., Gao M., Salek-Ardakani S., Harada Y., Luo J.L., Yang C., Croft M., Inoue K., Karin M., Liu Y.C. // J. Clin. Invest. — 2006. — Vol. 116, № 4. — P. 1117-26.
19. Volkov A. β5i subunit deficiency of the immunoproteasome leads to reduced Th2 response in OVA induced acute asthma / Volkov A., Hagner S., Löser S., Alnahas S., Raifer H., Hellhund A., Garn H., Steinhoff U. // PLoS One. — 2003. — Vol. 8, № 4. — e60565.
20. Weathington N.M. The Emerging Role of the Ubiquitin Proteasome in Pulmonary Biology and Disease / Weathington N.M., Sznajder J.I., Mallampalli R.K. // Am. J. Respir. Crit. Care Med. — 2013. — Vol. 188, № 5. — P. 530-537.
21. Wegmann M. Long-term bortezomib treatment reduces allergen-specific IgE but fails to ameliorate chronic asthma in mice / Wegmann M., Lunding L., Orinska Z., Wong D.M., Manz R.A., Fehrenbach H. // Int. Arch. Allergy Immunol. — 2012. — Vol. 158, № 1. — P. 43-53.
/10.jpg)

/10_2.jpg)