Статтю опубліковано на с. 19-28
У наш час алергія являє собою глобальну загальносвітову проблему, що обумовлює повсюдні значні медико-соціальні та економічні втрати, про що попереджав ще у 30-ті роки минулого століття наш славнозвісний учений академік О.О. Богомолець: «Прийде час, і алергія буде в усіх на вустах». Дійсно, наприкінці ХХ — початку ХХІ століття поширеність алергічної патології досягла масштабів епідемії. Особливістю сьогодення також є більш ранній і майже одночасний розвиток у дітей перших місяців і років життя декількох атопічних захворювань: гастроінтестинальної алергії, атопічного дерматиту (АД), алергічного риніту (АР), бронхіальної астми (БА) [1, 2, 7]. Дуже часто дитині пізно встановлюють діагноз АР — у віці 6–7 років, хоча перші його прояви можуть спостерігатися вже у 2–3-річних дітей і навіть у малюків. Підтвердженням цього є результати епідеміологічного дослідження BAMSE (Швеція), перший етап якого завершено у 2012 році та в якому вивчались розвиток і поєднання найбільш поширених алергічних захворювань у дітей — АД, БА й АР — від дня народження до 12-річного віку. На першому році життя ізольовані АР і БА зустрічалися у 2 % відповідно, їх поєднання відзначено в 1 % випадків серед усіх народжених дітей, тобто БА і АР розвивались одночасно [11, 14].
Відзначається тісний взаємозв’язок між атопічними захворюваннями в дітей: так, у 20–60 % хворих на АД формується БА, у 30–45 % — АР. Згідно з даними епідеміологічних досліджень, 15–40 % хворих на АР мають БА, а у 76–80 % пацієнтів із БА діагностується АР [1, 3, 16, 25]. З урахуванням статистичних даних стає зрозумілим факт, що АР є предиктором розвитку БА. АР реєструється приблизно у 40 % дітей, зрідка зустрічається у малюків віком до 2 років і найчастіше спостерігається у хворих шкільного віку [1, 21, 27]. Наявність АР обтяжує перебіг інших захворювань ЛОР-органів, підвищує ризик розвитку середнього отиту з перфорацією барабанної перегородки, рецидивного і/або хронічного риносинуситу та, безперечно, БА.
Недіагностований АР у дитини з БА може призводити до збільшення обсягу контролюючої терапії основного захворювання аж до застосування системних глюкокортикостероїдів (ГКС). У зв’язку з цим дітей з АР необхідно обстежувати на наявність БА, а хворих на астму — на наявність АР [1, 5, 13].
Взаємозв’язок БА та АР пояснюється наявністю єдиного морфологічного субстрату (у верхніх і нижніх дихальних шляхах), загальними тригерами та патогенетичними механізмами. В наш час розглядається концепція єдиного хронічного алергічного респіраторного синдрому, при якому явища риніту і транзиторної бронхообструкції розцінюються як маніфестація однієї й тієї самої хвороби у верхніх і нижніх дихальних шляхах [9, 21, 24].
Відомо, що в основі етіопатогенезу БА лежить хронічне запалення, тому наріжним каменем терапії цієї хвороби є протизапальні засоби і перш за все інгаляційні ГКС (ІГКС), що рекомендовані як препарати першої лінії, починаючи з легкого ступеня персистуючої БА. Однак при застосуванні ІГКС лікарям доводиться стикатися з цілою низкою проблем, серед яких — невміння пацієнтів правильно користуватися інгаляційною технікою, складнощі в оволодінні технікою інгаляції, розвиток системних ефектів при застосуванні ІГКС у дозах, що перевищують 1500 мкг за беклометазону дипропіонатом, відмова дітей або їх батьків від використання будь-яких гормональних засобів через стероїдофобію, невисокий комплайєнс тощо [4, 23].
Перерахованих недоліків позбавлені антагоністи цистеїніл-лейкотрієнових рецепторів, які також є протизапальними препаратами і рекомендуються сучасними керівництвами (GINA, ICON) [17–19, 22] як альтернатива ІГКС в лікуванні БА легкого ступеня в дітей. Пероральний та одноразовий прийом антагоністів лейкотрієнових рецепторів (АЛР), зокрема монтелукасту натрію (надалі — монтелукаст), дозволяє суттєво підвищити комплайєнс, а також усуває проблему зниження ефективності терапії внаслідок неправильного використання препарату. Для пацієнтів (або їх батьків) зі стероїдофобією, які категорично відмовляються від застосування ІГКС, незважаючи на роз’яснення лікаря, монтелукаст є альтернативою ІГКС у досягненні контролю за хворобою. Монтелукаст — представник 3-ї групи модифікаторів лейкотрієнів, який є інгібітором 1-го рецептора цистеїніл-лейкотрієнових рецепторів на клітинах-ефекторах — гладком’язових і секретуючих клітинах [4]. Препарати монтелукасту відрізняються від існуючих протиастматичних протизапальних засобів не лише механізмом дії, а й шляхом (пероральним) і кратністю (1 раз у день) введення, що, безумовно, привертає до них увагу як лікарів, так і хворих, особливо дітей [15]. Слід підкреслити, що монтелукасту властива системна дія завдяки пероральному шляху надходження в організм людини, і це є ще однією його перевагою, оскільки дозволяє отримати ефект при різних імунних і неімунних формах нозологічних алергічних захворювань — БА, аспіриновій астмі, АР, АД, харчовій алергії тощо.
Згідно з останнім переглядом міжнародних рекомендацій GINA (2014–2016) [17–19], антилейкотрієнові препарати розглядають як альтернативу терапії ІГКС при лікуванні легкої персистуючої астми та вірус-індукованої бронхіальної обструкції у дітей з інтермітуючою БА і як компонент базової протизапальної терапії (для доповнення до ІГКС) персистуючої середньотяжкої астми. Ефективність АЛР була доведена в багатьох дослідженнях. Наприклад, результати дослідження PREVIA (Prevention of Viral-Induced Asthma) показали зниження частоти загострень БА на 39,9 % на фоні використання монтелукасту у дітей віком 2–5 років [8]. Тим не менш використання монтелукасту у дітей підліткового та юнацького віку з БА як єдиного контролюючого препарату зазвичай буває менш ефективним, ніж ІГКС; у той же час він вважається альтернативою ІГКС при можливості здійснити step down-терапію [23].
Одним з ефективних препаратів монтелукасту є Глемонт (виробник — фармацевтична компанія «Гленмарк Фармасьютикалз Лімітед», Індія). Цей препарат показаний як альтернативний засіб лікування замість низьких доз інгаляційних кортикостероїдів для пацієнтів із персистуючою астмою легкого ступеня, в яких не було нещодавно серйозних нападів астми, що потребують перорального прийому кортикостероїдів, а також для тих пацієнтів, у яких виявлено непереносимість інгаляційних кортикостероїдних препаратів, за експериментальними і клінічними даними [4] запобігає бронхоконстрикції, зумовленій фізичним зусиллям, вдиханням холодного повітря та алергенів, дією аспірину та діоксиду сірки. До показань до застосування Глемонту (БА, БА з коморбідним АР) долучено й ізольований АР, що розширює можливості використання препарату, крім того, значно зменшує обсяг базової терапії та пов’язаний з необхідністю тривалого протизапального лікування розвиток побічних ефектів.
Мета дослідження — оцінка ефективності та безпечності застосування протизапального препарату антилейкотрієнової дії — монтелукасту натрію у дітей різного віку, хворих на легку і середньотяжку персистуючу бронхіальну астму у комбінації з алергічним ринітом, і дітей перших років життя з повторними епізодами обструктивного бронхіту.
Матеріали та методи
Під спостереженням було 40 дітей віком від 6 до 11 років із проявами астми фізичного і психоемоційного навантаження, вірус-індукованою астмою, яким був призначений монтелукаст натрію. Групою порівняння були діти такого самого віку, хворі на легку астму аналогічної характеристики, які отримували лікування препаратом флутиказону пропіонат (по 20 дітей у кожній групі). З усіх 40 пацієнтів 15 дітей було віком 6–8 років і 25 хворих віком 9–11 років, хлопчиків — 26, дівчаток — 14.
Крім того, до обстеження було залучено 30 дітей молодшої вікової групи — від 2 до 6 років, які були розподілені на 2 групи: 1-ша група — діти з повторним обструктивним бронхітом (ПОБ) — 15 дітей (середній вік 36,40 ± 2,68 місяця) і 2-га група — хворі на БА (15 дітей, середній вік 32,00 ± 3,93 місяця), які отримували лише монтелукаст натрію. Для визначення вікових нормативів сироваткових показників — загального імуноглобуліну E (ІgE), інтерлейкіну-13 (ІL-13) та інтерферону γ (IFN-γ) обстежено 12 практично здорових дітей віком 36,91 ± 3,25 місяця, які не мали хронічних вогнищ інфекції і не хворіли на ГРВІ впродовж останнього місяця (група контролю).
Більшість хворих (65 %) — хлопчики, що відбиває характерні особливості БА у дітей (табл. 1).
Критеріями включення у клінічне дослідження були: діагноз БА, діагноз ОБ, вік від 2 до 11 років, згода пацієнта/батьків пацієнта на участь у дослідженні.
Критерії виключення: онкологічні, гематологічні, системні та ендокринні захворювання; гострі та хронічні захворювання нирок і печінки; набуті та вроджені вади серця; аномалії розвитку дихальної системи; тимомегалія; гострі та хронічні неврологічні й психічні захворювання; тяжкі супутні захворювання з несприятливим прогнозом; непереносимість досліджуваних препаратів в анамнезі; відмова пацієнта чи батьків (опікунів) від участі в дослідженні з будь-якої причини.
Діагноз БА встановлювався згідно з Уніфікованим протоколом надання первинної, вторинної (спеціалізованої) медичної допомоги дітям із бронхіальною астмою (наказ МОЗ України № 868 від 08.10.2013 р.) [10] та критеріями Міжнародного консенсусу з БА GINA перегляду 2014 р. [17].
Діагноз ОБ встановлювся згідно з Протоколом надання медичної допомоги дітям за спеціальністю «Дитяча пульмонологія» (наказ МОЗ України № 18 від 13.12.2005 р.) [6]. Діагностика АР проводилася відповідно до рекомендацій Міжнародної асоціації алергологів за документом ARIA (2008–2012) [12].
З метою дослідження впливу монтелукасту на перебіг клінічної симптоматики і характер змін запального процесу у хворих на БА та ОБ у динаміці спостереження проведено дослідження рівнів у крові загального IgE (методом твердофазного імуноферментного аналізу (ІФА) за допомогою системного аналізатора — імуноферментного фотометра Multiscan Plus (Labsystems, Франція), ІФН-γ, IL-12 та IL-13 (методом непрямого твердофазного ІФА із застосуванням стандартних діагностичних наборів виробництва Іnvitrogen Corporation (США) — Human INF-γ, Human IL-13 і Human IL-12+p40, призначених для кількісного визначення людського ІНФ-γ, IL-13 та IL-12 у сироватці крові та культурі клітин) на імуноферментному аналізаторі iEMS Labsystems (Фінляндія).
Аналіз анамнестичних даних в обстежених дітей показав, що патологія перинатального періоду і пологів відзначалась у 62,5 % хворих. На ранньому штучному вигодовуванні знаходились 52,5 % дітей. Прояви алергічної конституції мали 55 % пацієнтів. Обтяжену спадковість щодо алергічної патології виявлено у 62,5 % хворих: серед них — по лінії матері у 68 %, по лінії батька — у 32 %. Пацієнти мали найближчих родичів, які страждали від астми, що становило 36 % від усіх пробандів з обтяженою спадковістю.
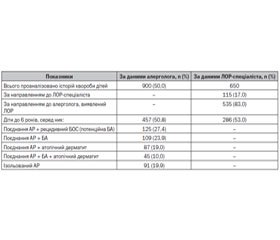
Результати власного дослідження [5], в якому вивчалась частота як ізольованого АР, так і у поєднанні з БА та АД у дітей віком до 6 років, за даними звернення хворих до алерголога і ЛОР-спеціаліста, свідчать про аналогічні характеристики АР у пацієнтів цього віку (табл. 2).
За результатами табл. 2, частота АР за один рік у дітей до 6 років становила 50,8 %. Серед них поєднання АР з рецидивним бронхообструктивним синдромом (БОС) відзначено у 27,4 % дітей, поєднання АР і БА — у 23,9 %, а разом коморбідність АР у дітей із рецидивним БОС або вже діагностованою БА сягала 51,2 %, поєднання АР з АД спостерігалося в 19 % випадків, поєднання АР із БА і АД — у 10 %, поєднання АР із потенційною й діагностованою БА та АД — у 80,3 %, ізольований АР сягав майже 20 %. Отже, важливою рисою алергічних хвороб у дітей дошкільного віку є висока частота АР, як ізольованого, так і в поєднанні з БА та шкірною алергією, тобто характерний високий рівень їх коморбідності.
Із коморбідних захворювань у 62,5 % обстежених хворих діагностовано АР, і 12,5 % дітей мали прояви АД, 37,5 % пацієнтів мали харчову і медикаментозну алергію. Отже, значна кількість дітей обстежених груп мали поліорганні прояви алергії, що свідчить про бурхливий розвиток «алергічного маршу».
На першому році життя у 57,5 % хворих мали місце часті ГРВІ з проявами обструкції дихальних шляхів. Катарально-гнійний ендобронхіт у грудному віці перенесли 20 % дітей. Інші інфекційні хвороби (вітряну віспу, краснуху, кір, епідемічний паротит) відзначено у 45 % дітей.
Серед супутніх захворювань в обстежених хворих зі значною частотою реєструвалась патологія ЛОР-органів: аденоїдит — у 40 % дітей, хронічний тонзиліт — у 15,5 % хворих, що зумовило часті ГРВІ у 70 % дітей. Патологія травного каналу відзначалась у 27,5 % дітей із БА.
У 67,3 % дітей БА вперше маніфестувала в ранньому віці (табл. 3).
Наші дані підтверджують головну тенденцію сучасної еволюції БА — початок захворювання у перші роки життя. Загалом дебют БА припадав у середньому на вік 2,8 ± 0,3 року і у 72,5 % хворих відбувся на фоні перебігу ГРВІ. Тривалість астми становила 2–8 років (у середньому — 3,4 ± 0,3 року). Тригерами загострень хвороби були аероалергени (тварини, побутовий пил, пилок), фізичне зусилля, ГРВІ, вдихання холодного повітря, емоційний стрес, зміни метеоумов.
На початку дослідження в усіх хворих симптоми астми відзначалися частіше ніж 1 раз на тиждень, нічні пробудження через прояви астми — більше ніж 1 раз на тиждень, тому була потреба у призначенні контролюючої терапії.
Препарати призначались випадковим методом відразу після купірування загострення астми. Діти основних груп отримували монтелукаст (Глемонт) перорально у вигляді жувальної таблетки 1 раз на добу на ніч: у дозі 4 мг — дітям віком 2–6 років і 5 мг — дітям 6–11 років. Хворі групи порівняння (тільки віком 6–11 років) лікувалися інгаляційним базовим препаратом флутиказону пропіонат у низьких дозах (50 мкг 2 рази на добу). Тривалість курсу терапії кожним препаратом становила 6 місяців. Всі хворі простежені в одномісячному катамнезі.
Результати та обговорення
Проведена контролююча терапія зазначеними засобами (монтелукаст і флутиказон) виявила позитивну динаміку проявів астми в усіх дітей віком 6–11 років, що проявлялося зниженням частоти нападів ядухи і потреби у бронхолітиках швидкої дії, поліпшенням самопочуття, збільшенням кількості днів без проявів (табл. 4).
У процесі терапії монтелукастом позитивна динаміка клінічних проявів, що відзначалася вже на першому тижні лікування (на 2–3-й день у 15 (75 %) дітей), була більш вираженою наприкінці першого місяця використання препарату і зберігалася протягом усього періоду дослідження (табл. 4).
/23.jpg)
Вірогідне зниження загальної кількості нападів ядухи або утрудненого видиху мало місце на четвертому тижні терапії монтелукастом (з 14,20 ± 1,12 до 7,10 ± 0,65; p < 0,05). Середня частота нічних нападів ядухи до лікування цим препаратом становила 2,80 ± 0,48, а після тримісячної терапії ці симптоми не відзначалися. На фоні лікування монтелукастом у всіх хворих виявлено тенденцію до збільшення (на 28,5 %; p > 0,05) кількості днів без симптомів астми, що призвело до зниження пропусків занять у школі на 23,5 %. Істотною особливістю ефекту монтелукасту стали зменшення або повна відсутність симптомів, зумовлених гіперреактивністю дихальних шляхів: виникнення кашлю і wheezing (свистячого дихання) при фізичному зусиллі, емоційному стресі, вдиханні холодного повітря. Загалом ефективною терапія монтелукастом була у 19 (95 %) дітей.
Відмінні результати за 5-бальною шкалою отримані у 15 (75 %) дітей, що проявлялось відсутністю нападів ядухи і дихального дискомфорту, потребою у використанні бронхолітиків короткої дії; фізична активність була нормальною, діти не пропускали занять у школі, тобто був досягнутий повний контроль за перебігом БА. Добрий ефект відзначено у 4 (20 %) хворих — напади ядухи зникли, але зрідка були епізоди wheezing, турбував рідкісний сухий кашель, що іноді вимагало застосування сальбутамолу. Задовільною ефективність терапії монтелукастом оцінена в 1 (5 %) хворого, який скаржився на періодичні епізоди wheezing, що виникали зрідка, були короткими та легкими. Загалом кількість ознак астми під впливом лікування монтелукастом вірогідно (p < 0,05) знизилась у 2,2 ± 0,1 раза, відзначалося менше у 2,8 ± 0,3 раза нічних симптомів хвороби, у 6,0 ± 0,4 раза скоротилася потреба у бронхолітиках, в 1,3 ± 0,1 раза збільшилася кількість безсимптомних днів впродовж місяця. Слід окремо зауважити, що на фоні лікування монтелукастом у всіх хворих на БА з коморбідним АР і у всіх дітей із БА і супутнім АД відбулася значна регресія клінічної симптоматики.
Порівняння ефективності терапії хворих на БА монтелукастом і флутиказоном не виявило істотних розбіжностей між кількістю нападів ядухи у дітей обох груп: суттєве зниження (у 1,7 ± 0,3 раза і 1,8 ± 0,2 раза відповідно; р < 0,05) спостерігалось наприкінці четвертого тижня лікування і залишалось таким до закінчення курсу терапії (табл. 4). У пацієнтів обох груп відзначалося вірогідне (р < 0,05) зниження нічних симптомів БА (у 8,3 ± 1,1 раза у випадку лікування монтелукастом і у 4,5 ± 0,9 раза у разі терапії флутиказоном) після 1-місячного курсу, що зберігалось до кінця лікувального періоду. У хворих на фоні терапії монтелукастом на 3-му місяці терапії нічних нападів ядухи зовсім не відзначено, а у дітей при лікуванні флутиказоном нічні епізоди хвороби за відповідний час спостереження виникали рідко. Стосовно потреби в ситуаційній терапії у хворих обох груп відбувалися аналогічні зміни: суттєве зниження числа інгаляцій сальбутамолу за потреби наприкінці 3-го місяця терапії — у 5,2 ± 0,3 раза за умов лікування монтелукастом і у 8,1 ± 0,4 раза — у випадку терапії флутиказоном, що спостерігалось і наприкінці курсу лікування. Отже, терапія монтелукастом дітей, хворих на БА, за впливом на редукцію клінічних проявів астми була настільки ж ефективною, як і лікування низькими дозами флутиказону.
Отже, при лікуванні хворих на середньотяжку БА монтелукаст дещо поступається флутиказону за швидкістю регресії клінічних симптомів БА, але перевершує останній за впливом на ліквідацію нічних проявів хвороби і на пов’язане з цим поліпшення якості сну дітей. Монтелукаст також мав значні переваги для хворих та їх батьків у зв’язку з можливістю прийому у таблетованій формі з відмінними смаковими якостями, був зручним у використанні, що дуже важливо для дітей, у яких є проблеми із застосуванням інгаляційних засобів техніки [23].
Для об’єктивної оцінки ефективності обраних препаратів базової терапії в обстежених хворих було проведено вивчення динамічних показників легеневої функції. У всіх дітей перед початком терапії відзначалися помірні рестриктивні порушення (табл. 5), що підтверджувалося зниженням форсованої життєвої ємності легень (ФЖЄЛ) у середньому до 80 % від належних величин.
Показники об’єму форсованого видиху (ОФВ1), що становили 72–87 % від належних величин, свідчили про помірно виражену й зворотну обструкцію у 26 (65 %) хворих. Приріст ОФВ1 після бронходилатаційної проби варіював від 12 до 21 %. З урахуванням проведеного моніторингу показників пікфлоуметрії ранковий провал бронхіальної прохідності як прояв гіперреактивності бронхів виявлено у 11 (27,5 %) хворих.
/24.jpg)
Курсова терапія монтелукастом хворих на БА призводила до зростання динамічних показників видиху (табл. 5): при застосуванні монтелукасту вірогідне (р < 0,05) поліпшення ФЖЄЛ (на 28,1 %) і ОФВ1 (на 24,8 %) відзначалось вже наприкінці 3-го місяця лікування і після завершення 6-місячного курсу залишалось на тому самому рівні впродовж усього терміну терапії (р > 0,05). Поліпшення прохідності бронхів на фоні терапії монтелукастом здійснювалося на всіх рівнях бронхів, включаючи й дрібні. Збільшення величин прохідності середніх бронхів (максимальної об’ємної швидкості, МОШ50) через 3 місяці терапії було вірогідним (на 51,1 %; р < 0,05), а приріст прохідності дрібних бронхів, за даними МОШ75, становив 63,2 % (р < 0,05). Наприкінці 6-місячного курсу терапії ці параметри були на такому ж рівні. Слід зазначити, що прохідність дрібних бронхів під впливом монтелукасту зростала більше, ніж прохідність середніх бронхів, хоча різниця між ними була несуттєвою (р > 0,05). Лікування монтелукастом позитивно вплинуло і на зменшення ступеня латентного бронхоспазму, про що свідчило зниження приросту ОФВ1 (ΔОФВ1) після бронходилатаційної проби на 43,8 % на 3-му місяці терапії і на 63,6 % наприкінці 6-го місяця порівняно з початковим показником (р > 0,05). У той же час відзначено вірогідне (р < 0,05) подальше зменшення реактивності бронхів при продовженні лікування монтелукастом (різниця між показниками ΔОФВ1 на 3-му і 6-му місяцях становила 1,5 ± 0,3 раза).
Щоденний моніторинг пікфлоуметрії у момент фізіологічного піку (вранці та ввечері) дозволив оцінити рівень добових коливань функції легень, що корелює зі ступенем гіперреактивності дихальних шляхів, а також сприяє оцінці ефективності обраного варіанта базової терапії. Моніторинг пікової швидкості видиху (ПШВ) при застосуванні монтелукасту виявив чітку тенденцію до збільшення ранкових і вечірніх показників (табл. 6) вже на 3-му місяці лікування, а після завершення терапії різниця між початковими і кінцевими їх рівнями була вірогідною (р < 0,05), що проявлялось у зростанні значень в 1,42 ± 0,3 раза і 1,25 ± 0,1 раза відповідно.
Добова лабільність бронхів (ДЛБ — індекс варіабельності) в цей час знижувалась на 29,4 і 44,5 % відповідно (р < 0,05), що збігалося зі зникненням скарг у дітей і зменшенням потреби у сальбутамолі. Отже, базова терапія монтелукастом у дітей покращує перебіг БА за показниками клінічної дінаміки хвороби, що підтверджено позитивними змінами легеневої функції.
При застосуванні низьких доз флутиказону найбільш істотна позитивна динаміка всіх спірометричних показників була виявлена наприкінці 3-го місяця терапії зі збільшенням ФЖЄЛ на 28,0 % (р < 0,05), ОФВ1 — 22,8 % (р < 0,05), МОШ50 — 45,6 % (р < 0,05), МОШ75 — 46,5 % (р < 0,05). Про зменшення прихованого бронхоспазму свідчило зниження приросту ΔОФВ1 від 22,8 ± 4,7 % до 12,2 ± 2,4 % (р < 0,05), виявлене наприкінці 3-го місяця лікування флутиказоном із вірогідними позитивними змінами в процесі подальшої терапії (табл. 5). Індекс варіабельності (ДЛБ), що на початку був 26,7 ± 4,3 %, знизився до рівня 14,6 ± 2,7 % (р < 0,05) вже на першому місяці активної терапії і зберігався таким до кінця спостереження. Порівняльний аналіз параметрів легеневої функції дітей під час терапії монтелукастом і флутиказоном показав, що на фоні лікування ІГКС ефект був дещо вищим упродовж всього терміну терапії, ніж у разі використання монтелукасту, проте вірогідної різниці між вентиляційними показниками хворих обох груп не було (р > 0,05).
Отже, за результатами дослідження вентиляційних характеристик дітей, хворих на середньотяжку БА, на фоні курсового 2-місячного лікування монтелукастом і препаратами порівняння виявлено, що застосування монтелукасту у базовій терапії дозволяє надійно контролювати бронхіальну прохідність, і за рівнем дії на ФЗД він наближається до ефекту флутиказону. Динамічні показники легеневої функції зростали під впливом терапії монтелукастом вже після першого місяця використання, досягаючи максимального значення, і зберігались на цьому рівні протягом подальшого спостереження. За даними тесту із сальбутамолом, монтелукаст здійснював істотну превентивну дію на прихований бронхоспазм. Результати дослідження свідчать про зниження бронхіальної гіперреактивності у хворих на фоні лікування монтелукастом.
Динаміка маркерів алергічного запалення (табл. 7) у хворих на БА під впливом зазначених базових препаратів мала односпрямований характер: у всіх хворих простежувались відсутність вірогідних змін вмісту еозинофілів периферійної крові та поступове зниження рівня тканинної еозинофілії за даними дослідження назального секрету та індукованого мокротиння. Проте найбільш вагомий ефект (зменшення відносного вмісту еозинофілів) та його більш швидка динаміка спостерігались на фоні використання і флутиказону, і монтелукасту, оскільки вірогідне (p < 0,05) зниження їх після лікування цими препаратами відбулося вже на 4-му тижні терапії.
/25.jpg)
Аналіз результатів проведеного катамнестичного дослідження впродовж місяця у дітей обох груп лікування засвідчив, що після відміни монтелукасту незначне збільшення частоти симптомів БА відзначалось у 2 (10 %) хворих, а у дітей на фоні терапії флутиказоном симптомів астми майже не було. Після закінчення терапії монтелукастом у хворих зберігалися досягнуті рівні динамічних показників легеневої функції протягом всього періоду спостереження. Через місяць після закінчення курсу лікування флутиказоном результати проби з сальбутамолом мали тенденцію до зменшення, що, ймовірно, пояснюється більш вираженою протизапальною дією ІГКС.
Оцінка переносимості монтелукасту дітьми віком 6–11 років була проведена за весь період активного лікування і катамнестичного спостереження. Добра переносимість його відзначена у 18 (90 %) дітей, задовільна — у 2 (10 %). Побічні дії (тимчасові болі у животі у перші 1–2 дні лікування) відзначили 2 хворі, проте це не стало перешкодою для подальшого прийому препарату за бажанням самих дітей, які надалі на такі прояви не скаржилися. Всі діти та їх батьки відмітили простоту і зручність користування монтелукастом порівняно з інгаляційним засобом, що забезпечило високий рівень комплайєнсу. Всім дітям препарат сподобався своїми відмінними смаковими якостями.
Щодо результатів лікування монтелукастом дітей віком 2–6 років, то позитивна динаміка клінічної симптоматики відмічалася у хворих обох груп. Відзначалося вірогідне зниження частоти епізодів бронхообструкції (табл. 8). Також встановлено вірогідне зниження частоти ГРВІ у дітей з БА після лікування монтелукастом.
При оцінці клінічної ефективності монтелукасту натрію у дітей з БА позитивна динаміка відмічалася батьками вже на першому місяці лікування. Загальна кількість нападів ядухи або утрудненого видиху через 3 місяці лікування знижувалася з 12,40 ± 1,14 до 6,80 ± 0,85, що досягало вірогідної різниці рівня показників (р < 0,05). Значно знижувалася потреба в бронхолітиках — з 9,80 ± 1,74 до 1,40 ± 0,43 (р < 0,05).
У дітей обох груп відзначено зменшення вираженості симптомів коморбідної алергічної патології — АР та АД.
При оцінці рівнів ІgE, ІL-13 і ІФН-γ на фоні лікування у дітей з ПОБ відмічено вірогідне зниження (р < 0,05) вмісту ІL-13 з 24,16 ± 5,13 до 10,81 ± 2,44 пг/мл (табл. 9). Після проведеної терапії рівень ІL-13 у дітей з ПОБ залишався дещо підвищеним порівняно з умістом ІL-13 у здорових дітей (10,81 ± 2,44 проти 5,58 ± 1,71 пг/мл).
Встановлено виражене зростання рівня ІФН-γ і зниження вмісту загального ІgE у хворих на ПОБ, але без статистичної доказовості.
Порівняння показників у дітей з БА (табл. 9) до та після терапії монтелукастом показало значне зниження вмісту IL-13 (з 25,39 ± 5,64 пг/мл до 14,60 ± 3,41 пг/мл), проте без вірогідної різниці (р = 0,084), і порівняно зі здоровими дітьми рівень IL-13 залишався вірогідно вищим (р < 0,05), що свідчить про збереження вираженості запального процесу у дітей БА на фоні терапії. Поряд із цим виявлено несуттєву тенденцію до зниження рівня ІgE і підвищення вмісту ІФН-γ.
Рівні еозинофілів у біологічних рідинах хворих і здорових дітей подані у табл. 10.
Рівень еозинофілів у мокротинні та назальному секреті у дітей з БА значно (у 3,5 ± 0,3 раза, р < 0,01) перевищував вміст аналогічних показників у здорових дітей. Особливо підвищеним (у 5,1 ± 0,2 раза, р < 0,01) був їх рівень у мокротинні, що можна використовувати як орієнтовний допоміжний діагностичний критерій БА. У мазках-відбитках із середнього носового ходу секреторна еозинофілія виявлена у 22 (57,9 %) хворих, що становило у середньому 28,3 ± 4,8 % і свідчило про алергічний назальний процес.
Отримані дані говорять про значну клінічну ефективність монтелукасту у дітей віком 2–6 років із БА і ПОБ, що підтверджується змінами рівнів ІgE, ІL-13 та ІФН-γ у сироватці крові.
За період проведення дослідження на фоні прийому монтелукасту дітьми віком 2–6 років побічних ефектів не відзначено жодною дитиною.
Висновки
Наведені дані свідчать про порівнянну ефективність монтелукасту та ІГКС (флутиказону у низьких дозах) при легкій БА у дітей. При цьому монтелукаст має низку переваг, серед яких зручність і легкість у використанні, що позитивно впливає на комплайєнс.
Застосування монтелукасту у базовій терапії середньотяжкої БА у дітей є високоефективним засобом, який забезпечує повний контроль за перебігом астми у більшості дітей. Монтелукаст знижує вираженість клінічних симптомів астми, в тому числі кашель, поліпшує легеневу функцію шляхом легкої бронхіальної дилатації, пригнічує запалення у слизовій оболонці бронхів і порожнини носа, знижуючи таким чином частоту нападів БА. Монтелукаст особливо показаний у разі переважання нічних ознак хвороби, у випадках астми фізичного і психоемоційного навантаження, розвитку загострень, зумовлених змінами метеоумов і вірусними інфекціями. При тривалому використанні препарат забезпечує контроль за перебігом легкого і середньотяжкого варіантів персистуючого АР, як ізольованого, так і у поєднанні з БА. У комбінації з ІГКС монтелукаст дозволяє знижувати дозу ГКС і контролювати перебіг хвороби у пацієнтів із середніми і тяжкими формами БА. Він може бути корисним у лікуванні інших супутніх алергічних захворювань у дітей — АД, аспіринової астми, хронічної кропив’янки, що робить його перспективним для широкого застосування в дитячій практиці, особливо у пацієнтів із поліорганною алергічною патологією зі складним патогенезом.
Список литературы
1. Алергічний риніт у дітей: Монографія / Д.І. Заболотний, А.А. Лайко, О.М. Охотнікова, А.Л. Косаковський та ін. — Київ: Логос, 2016. — 216 с.
2. Антипкін Ю.Г. Бронхіальна астма, поєднана з алергічним ринітом, у дітей: місце антигістамінних препаратів у лікуванні [Текст] / Ю.Г. Антипкін, Т.Р. Уманець, В.Ф. Лапшин [та ін.] // Астма та алергія. — 2014. — № 4. — С. 60-65.
3. Гуртовая М.Н. Аллергический ринит и бронхиальная астма: частота встречаемости, причины возникновения, клиника и лечение [Текст] / М.Н. Гуртовая, Н.Н. Гребнева, Н.Я. Прокопьев // Молодой ученый. — 2014. — № 2. — С. 318-326.
4. Mastalerz L., Kumik J. Антилейкотриеновые препараты в лечении бронхиальной астмы [Текст] / L. Mastalerz, J. Kumik // Ліки України. — 2012. — № 3–4(1). — С. 21-24.
5. Охотнікова О.М. Алергічний риніт у дітей: нагальні питання діагностики і лікування [Текст] / О.М. Охотнікова, Ю.І. Гладуш, Л.В. Бондаренко [та ін.] // Клінічна імунологія. Алергологія. Інфектологія. — 2015. — № 1(80). — С. 26-36.
6. Протокол надання медичної допомоги дітям за спеціальністю «Дитяча пульмонологія» (наказ МОЗ України № 18 від 13.12.2005).
7. Романюк Л.И. Аллергический ринит как коморбидное состояние бронхиальной астмы [Текст] / Л.И. Романюк // Астма та алергія. — 2013. — № 2. — С. 62-65.
8. Wahn U. Обзор современных данных о результате применения монтелукаста при монотерапии легкой астмы у детей [Текст] / U. Wahn // Клінічна імунологія. Алергологія. Інфектологія. — 2010. — Спецвип. 3. — С. 78-82.
9. Уманец Т.Р. Бронхиальная астма и аллергический ринит: пути оптимизации комплайенса и эффективности лечения [Текст] / Т.Р. Уманец // Астма та алергія. — 2015. — № 1. — С. 61-64.
10. Уніфікований протокол надання первинної, вторинної (спеціалізованої) медичної допомоги дітям з бронхіальною астмою (наказ МОЗ України № 868 від 08.10.2013).
11. Ballardini N., Kull I., Lind T. et al. Development and comorbidity of eczema, asthma and rhinitis to age 12 — data from the BAMSE birth cohort [Text] / N. Ballardini, I. Kull, T. Lind [et al.] // Allergy. — 2012. — № 67. — Р. 537-544.
12. Brozek J.L. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines: 2010 Revision [Text] / J.L. Brozek, J. Bousquet, C.E. Baena-Cagnani [et al.] // J. Allergy Clin. Immunol. — 2010. — Vol. 126. — P. 466-476.
13. Boulet L.-Ph. Asthma-related comorbidities [Text] / –L.-Ph. Boulet, M. Boulay // Expert Rev. Respir. Med. — 2011. — Vol. 5(3). — P. 377-393.
14. Chawes Bо L.K. Upper and lower airway pathology in young children with allergic- and non-allergic rhinitis [Text] / Bo L.K. Chawes // Dan. Med. Bull. — 2011. — Vol. 58 (5). — B4278.
15. Dawood O.T. Medication compliance among children / O.T. Dawood, M. Izham MIbrahim, S. Palaian // World J. Pediatr. — 2010. — Vol. 6(3). — Електронний режим доступу: www.wjpch.com.
16. Gentile D. Current and Future Directions in Pediatric Allergic Rhinitis [Text] / D. Gentile, A. Bartholow, E. Valovirta [et al.] // J. Allergy Clin. Immunol. In Practice. — 2011. — Vo. 1(3). — P. 214-226.
17. Global strategy for asthma management and prevention. National institutes of health. National Heart, lung and Blood Institute. Revised 2014. — Електронний режим доступу: http://www.ginasthma.org
18. Global strategy for asthma management and prevention. National institutes of health. National Heart, lung and Blood Institute. Revised 2015. — Електронний режим доступу: http://www.ginasthma.org
19. Global strategy for asthma management and prevention. National institutes of health. National Heart, lung and Blood Institute. Revised 2016. — Електронний режим доступу: http://www.ginasthma.org
20. Hansen T.E. Increasing prevalence of asthma, allergic rhinoconjunctivitis and eczema among schoolchildren: three surveys during the period 1985–2008 / T.E. Hansen, B. Evjenth, J. Holt // Foundation Acta Pediatrica. — 2013. — Vol. 102. — P. 47-52.
21. Holgate S.T. Мechanisms of asthma and implications for its prevention and treatment: a personal journey [Text] / S.T. Holgate // Allergy Asthma Immunol. Res. — 2013. — Posted online 2013.
22. International consensus on (ICON) pediatric asthma [Text] / N.G. Papadopoulos, H. Arakawa, K.H. Carlsen [et al.] // Allergy. — 2012. — Vol. 67, № 8. — P. 976-997.
23. Katie M. Non-compliance amongst adolescents with asthma: listening to what they tell us about self-management [Text] / K.M. Buston, S.F. Wood // Family Practice. — 2000. — Vol. 17, № 2 (Oxford University Press).
24. Obimbo E.M. Allergic rhinitis and asthma — evidence for an association [Text] / E.M. Obimbo, M.E. Levin // Curr. Allergy Clin. Immunol. — 2013. — Vol. 26, № 1.
25. Pawankar R. World Allergy Organization (WAO) White Book on Allergy: Update 2013 [Text] / R. Pawankar, G.W. Canonica, S.T. Holgate [et al.]. — 239 р.
26. Turner P.J. Allergic rhinitis in children [Text] / P.J. Turner, A.S. Kemp // J. of Paediatrics and Child Health. — 2012. — Vol. 48. — P. 302-310.
27. Valovirta E. Мanaging co-morbid asthma with allergic rhinitis: targeting the one-airway with leukotriene receptor antagonist [Text] / E. Valovirta // WAO Journal. — 2012. — Vol. 5. — P. 210-211.

/21.jpg)
/22.jpg)
/23.jpg)
/24.jpg)
/25.jpg)
/26.jpg)
/27.jpg)