Статтю опубліковано на с. 35-42
Звіт за результатами рандомізованого плацебо-контрольованого
проспективного паралельного відкритого клінічного дослідження
ефективності лікування 80 пацієнтів з больовим синдромом
у ранньому післяопераційному періоді (до 5 діб)
Знеболювальна терапія у хворих із пошкодженнями та захворюваннями опорно-рухового апарату є складною, багатокомпонентною проблемою, що потребує індивідуального підходу з урахуванням конкретних патогенетичних механізмів виникнення болю та дотримання принципів ефективності, безпечності та адекватності лікування. Доведено, що недолікований гострий біль із часом стає хронічним з формуванням осередку патологічного больового збудження в центральній нервовій системі (ЦНС).
Посттравматичний больовий синдром є гострим, ноцицептивним (соматогенним) і полімодальним та має соматичну, вісцеральну й нейрогенну складові. Саме це визначає необхідність застосування мультимодальної фармакотерапії зазначеного больового синдрому з метою гальмування аферентного потоку больової імпульсації на різних рівнях її поширення. Остання забезпечується використанням лікарських засобів різних груп, що впливають на різні ланки ноцицептивної системи. До препаратів, що доцільно включати в комбіновані схеми знеболювання у хворих із посттравматичним больовим синдромом, належать місцеві анестетики, нестероїдні протизапальні препарати (НПЗП) з переважним периферичним та/або центральним механізмом дії, наркотичні аналгетики, кетамін у субнаркотичних дозах, психотропні препарати, антиконвульсанти. Традиційне застосування опіатів і опіоїдів у сучасній хірургічній практиці, безумовно, є ефективним, однак зумовлює ризик розвитку таких побічних ефектів, як депресія дихання, пригнічення моторики шлунково-кишкового тракту, жовчовивідних шляхів та сечового міхура. У лікуванні слабкого соматогенного больового синдрому ефективними є НПЗП, що мають периферичний механізм дії та справляють ефект у зоні первинного пошкодження та/або запалення, але вони можуть мати гастропатичний та ульцерогенний вплив і навіть у терапевтичних дозах можуть бути нефротоксичними та гепатотоксичними. Крім того, інтенсивніший больовий синдром часто не може бути адекватно усунутий за допомогою виключно НПЗП із периферичним механізмом дії, що вимагає застосування ад’ювантних аналгетичних засобів.
Сьогодні проблема адекватного знеболювання в післяопераційному періоді не втратила своєї актуальності [1, 5]. За даними літератури, від значного та помірного больового синдрому в післяопераційному періоді страждають майже 75 % усіх прооперованих пацієнтів [2, 6]. При цьому біль після оперативних втручань на кістках та суглобах за інтенсивністю посідає друге місце після операцій на органах черевної порожнини, а неадекватна аналгезія спостерігається в 30–50 % пацієнтів [1, 6]. Вищевказане призводить до продовження періоду іммобілізації та терміну перебування пацієнта в стаціонарі, віддаляє його активізацію, збільшується частота регоспіталізацій, підвищується ризик виникнення інфекційних ускладнень та розвитку хронічного больового синдрому, а головне, неадекватна аналгезія зводить нанівець усі переваги дорогих сучасних малоінвазивних оперативних методик. Згідно із сучасною фізіологічною класифікацією болю виділяють ноцицептивний біль, що поділяється на соматичний та вісцеральний, невропатичний біль, або комплексний регіонарний больовий синдром І та ІІ типу (периферичний та центральний), а також психогенний біль. У пацієнтів з травматичними пошкодженнями опорно-рухового апарату, а також після перенесених хірургічних втручань має місце саме ноцицептивний соматичний больовий синдром. Ноцицептивний біль — це гострий біль, що виникає внаслідок подразнення периферичних больових рецепторів при травмі, а також може виникати de novo у результаті дегенеративного ураження, запалення, ішемії або метаболічних змін.
Сучасні тенденції післяопераційної аналгезії характеризуються помітним обмеженням традиційного призначення опіоїдних аналгетиків, що обумовлено не тільки підвищенням вимог до їх суворого обліку, але і їх низькою ефективністю та наявністю побічних ефектів (особливо в осіб похилого та старечого віку), що виявляються в пригніченні дихання, гіподинамії, нудоті, блюванні, затримці сечі, свербінні шкіри, лікарській залежності. Відзначається більш широке застосування сучасних найбільш ефективних неопіоїдних аналгетиків, нестероїдних протизапальних препаратів із центральним та периферичним механізмом дії та внутрішньовенного парацетамолу. Частота їх застосування варіює від 45 до 99 %. Визначилася тенденція до застосування комплексного післяопераційного знеболювання з одночасним призначенням декількох препаратів знеболювання та ад’ювантних засобів для впливу на різні механізми формування больового синдрому та профілактики побічних реакцій внаслідок прийому аналгетиків. Тривають дослідження щодо збалансованого вибору оптимальних поєднань аналгетиків і ад’ювантних засобів, спрямованих на зменшення токсичної дії НПЗП, парацетамолу, опіатів. У спеціалізованих відділеннях хірургії, у відділеннях реанімації та інтенсивної терапії широке застосування знаходять високотехнологічні методи знеболювання — продовжена епідуральна аналгезія, електроаналгезія, акупунктура, сугестивні способи аналгезії та їх поєднання. Причому економічні витрати, пов’язані з упровадженням цих методів, компенсуються більш гладким перебігом післяопераційного періоду.
Виділяють 4 провідних механізми формування болю в організмі.
1. Трансдукція, або формування імпульсу в больових рецепторах. За відсутності пошкодження тканин больові рецептори «мовчать». Пошкодження тканин викликає активацію цих рецепторів і виділення комплексу медіаторів запалення й болю, що відіграють провідну роль у формуванні больової імпульсації. Повторна активація больових рецепторів викликає зміни як у центральній, так і в периферичній нервовій системі.
2. Трансмісія, або передача больового імпульсу по безмієлінових С-волокнах і тонких мієлінових Аd-волокнах у задні роги спинного мозку. Перервавши передачу імпульсу від тканин до спинного мозку на якомусь з етапів, можна не допустити інформацію про біль у ЦНС.
3. Модуляція, або сприйняття й модифікація больового імпульсу в спинному та головному мозку. Складний і багаторівневий процес, завдяки цьому механізму інформація про больовий імпульс кваліфікується за ступенем важливості для організму та направляється в численні центри спинного й головного мозку для подальшого формування поведінкової відповіді. Велика кількість центрів ЦНС втягується в роботу як при нетривалій, але інтенсивній больовій імпульсації, так і при тривалому збереженні больової імпульсації.
4. Перцепція, або формування почуття болю, відбувається в головному мозку.
Зв’язки між центрами, що виникли в ЦНС у відповідь на біль, можуть функціонувати досить довго, навіть після того як ушкодження тканин давно загоїлося, складний комплекс відповіді на біль продовжує функціонувати ще деякий час, а у разі формування хронічного больового синдрому — роками.
У подальшому формуванні складної відповіді організму на післяопераційний біль велике значення мають перші години та перша доба після операції. Саме тому застосування мультимодального підходу з початком анестезії до виконання операційної травми дає можливість запобігти формуванню значної больової імпульсації у ЦНС та відіграє ключову роль у знеболюванні під час операції й у післяопераційному періоді.
На різні етапи цього складного процесу можуть впливати різні групи препаратів. Етап формування імпульсу (трансдукція) — точка прикладання нестероїдних протизапальних засобів із переважно периферичним механізмом дії. Етап передачі імпульсу (трансмісія) — місцеві анестетики. Їх завдання — не пустити больовий сигнал у ЦНС. Це один з найбільш патогномонічних і ефективних шляхів знеболювання — не пригнічувати вже діючі центри болю в ЦНС, а перешкоджати їх формуванню. Етап модуляції — опіоїдні аналгетики, НПЗП з переважним центральним впливом (кеторолаку трометамін) і парацетамол. Змінюючи сприйняття болю, вони, однак, не можуть усунути вже існуючі осередки збудження в ЦНС, а відповідно, і формування патологічних механізмів відповіді на больову імпульсацію. На етап сприйняття болю (перцепція) впливають психотропні препарати, антиконвульсанти і певною мірою опіоїдні аналгетики.
Згідно з Європейським анестезіологічним протоколом, стратегічні підходи до лікування післяопераційного болю такі:
1. Близько 90 % хірургічних пацієнтів відчувають слабкий, помірний або помірно сильний післяопераційний біль. Як правило, вони отримують комбінацію нестероїдних протизапальних засобів (центральної та периферичної дії) і внутрішньовенного парацетамолу як терапію вибору. У тому випадку, коли застосування цієї комбінації недостатньо для полегшення болю, додатково призначають опіоїди.
2. Решта 10 % пацієнтів, які в післяопераційному періоді відчувають сильний біль, перебувають під спостереженням фахівців служби з гострого болю. У 2002 року 71 % пацієнтів була призначена контрольована пацієнтом епідуральна анестезія, у 23 % застосовувалися інші методи регіонарної анестезії та в 6 % — внутрішньовенна контрольована пацієнтом аналгезія.
3. Пацієнтів, які отримують контрольовану пацієнтом епідуральну анестезію, через 2 дні поступово переводять на стандартну знеболювальну терапію. З цією метою використовуються в першу чергу НПЗП із переважно центральним механізмом дії.
4. Пацієнтам, які отримували контрольовану пацієнтом аналгезію, одночасно вводять центральні та периферичні НПЗП з метою припинення застосування опіоїдів.
Мета роботи: оцінити ефективність аналгетичної дії назальної форми кеторолаку трометаміну Asprix в ортопедичних пацієнтів у ранньому післяопераційному періоді та ін’єкційної форми декскетопрофену трометамолу в порівнянної категорії пацієнтів.
Матеріали та методи дослідження
Дослідження проводилось на базі кафедри травматології та ортопедії Національного медичного університету імені О.О. Богомольця в ДУ «Інститут травматології та ортопедії НАМН України» в трьох клінічних групах пацієнтів.
У рамках рандомізованого плацебо-контрольованого проспективного паралельного відкритого клінічного дослідження проведено комплексне лікування та обстеження 80 пацієнтів.
Групи спостереження були порівнянні за статевим та віковим складом пацієнтів, структурою ортопедичної патології та післяопераційним больовим синдромом помірної та помірно сильної вираженості.
Перед включенням до груп спостереження всі пацієнти надавали інформовану згоду щодо участі в клінічному дослідженні.
У першій групі пацієнтів — основній групі клінічного спостереження (n1 = 35: закритий перелом кісточок гомілки, стан після відкритої репозиції та стабільно-функціонального малоінвазивного остеосинтезу (СФ МОС) — 15 пацієнтів, стан після діагностично-лікувальної артроскопії колінного або гомілковостопного суглоба — 20 пацієнтів)) базове знеболювання проводилося із застосовуванням назальної форми кеторолаку трометаміну Asprix, а як ад’ювантний препарат було застосовано парацетамол з відповідним дозуванням та режимом введення (табл. 1).
У другій групі пацієнтів — групі порівняння (n2 = 35: пацієнти порівнянні за характером патології, статтю та віком із хворими основної групи (закритий перелом кісточок гомілки, стан після відкритої репозиції та СФ МОС — 15 пацієнтів, стан після діагностично-лікувальної артроскопії колінного або гомілковостопного суглоба — 20 пацієнтів)) базове знеболювання проводилося із застосуванням ін’єкційного декскетопрофену, а як ад’ювантний препарат, аналогічно до основної групи, було застосовано парацетамол із відповідним дозуванням та режимом введення (табл. 1).
У третій групі пацієнтів — група плацебо-контролю (n3 = 10: група порівнянна за характером патології та статево-віковим складом з основною групою та групою порівняння (закритий перелом кісточок гомілки, стан після СФ МОС — 5 пацієнтів, стан після діагностично-лікувальної артроскопії колінного або гомілковостопного суглоба — 5 пацієнтів)) для базового знеболювання було застосовано плацебо у формі назального спрея — буферний розчин, ідентичний до того, що застосовувався в препараті Asprix, а як ад’ювантний знеболювальний препарат було застосовано парацетамол з відповідним дозуванням та режимом введення, аналогічним до застосовуваного в основній групі та групі порівняння (табл. 1).
Тривалість дослідження становила 5 діб.
Клінічне обстеження пацієнтів проводилося щоденно (пацієнти перебували на стаціонарному лікуванні) до початку застосування препарату та упродовж 1–5-ї доби лікування із заповненням відповідної анкети та фіксацією таких критеріїв та параметрів оцінки болю:
— оцінка болю за візуальною аналоговою шкалою (ВАШ) із фіксацією інтенсивності болю через 3–4 години після застосування препарату, але перед застосуванням ад’ювантного засобу (парацетамолу);
— оцінка швидкості настання знеболювального ефекту;
— оцінка тривалості знеболювального ефекту (час наступної вимоги аналгетика);
— оцінка тривалості застосування знеболювання;
— облік побічних ефектів та небажаних проявів при застосуванні препарату.
Критерії включення пацієнтів до дослідження:
1. Вік пацієнтів 25–50 років.
2. Відсутність алергічних реакцій або гіперчутливості до кеторолаку трометаміну, декскетопрофену, парацетамолу або компонентів цих препаратів.
3. Відсутність на момент обстеження активної пептичної виразки або нещодавньої шлунково-кишкової кровотечі на фоні виразкової хвороби в анамнезі.
4. Відсутність бронхіальної астми в анамнезі, активної бронхіальної астми, риніту, ангіоневротичного набряку або кропив’янки, спричинених застосуванням ацетилсаліцилатів або інших НПЗП.
5. Відсутність помірних або тяжких форм серцево-судинної недостатності, ниркової, печінкової недостатності.
6. Відсутність поліпозу носових ходів (повний або частковий синдром носових поліпів).
7. Відсутність вагітності або пологів.
8. Больовий синдром помірної та помірно сильної вираженості у пацієнтів після травми або після хірургічного втручання, що за ВАШ становить 40–70 мм (рис. 1).
Методика проведення знеболення в післяопераційному періоді. Застосування препаратів в основній групі відбувалось у такій послідовності. Після закінчення операції та відновлення чутливості у кінцівках кожні 6–8 годин пацієнту призначався Asprix інтраназально в дозі 31,5 мг (по 15,75 мг кеторолаку трометаміну в кожну ніздрю), а в проміжках між його застосуванням внутрішньовенно вводили парацетамол у дозі 1 г. Назальний спрей застосовували тричі на добу, парацетамол — 2–3 рази на добу, отже, добова доза Asprix становила 94,5 мг, парацетамолу — 2000–3000 мг.
У групі порівняння застосування препаратів відбувалося за такою схемою. Кожні 6–8 годин пацієнтам призначався ін’єкційний декскетопрофену трометамол у дозі 50 мг, при цьому добова доза становила 150 мг. У проміжках між його застосуванням внутрішньовенно вводили парацетамол у дозі 1000 мг, отже, добова доза парацетамолу становила 2000–3000 мг.
У групі плацебо-контролю пацієнтам тричі на добу вводили парацетамол у дозі 1000 мг, а інтраназально застосовували плацебо за аналогічною до основної групи схемою.
Результати дослідження та їх обговорення
Нами проведено комплексну оцінку ефективності застосування мультимодальної аналгезії в групах спостереження за динамікою зменшення інтенсивності больового синдрому, що оцінювалася за ВАШ, а також за швидкістю настання та тривалістю знеболювального ефекту (час до наступної вимоги аналгетика), тривалістю застосування знеболювання (у межах 5 діб), наявністю небажаних побічних проявів. Зведені показники оцінки в групах спостереження подано в табл. 2.
/39.jpg)
Оцінка результатів лікування пацієнтів за ВАШ засвідчила, що в основній групі пацієнтів, у якій у складі мультимодальної аналгезії застосовувався кеторолаку трометамін у назальній формі (Asprix), динаміка зменшення больового синдрому упродовж 5 діб була вірогідно кращою (p < 0,05), ніж у контрольній групі та групі плацебо. При цьому в основній групі середній показник інтенсивності болю в підгрупі артроскопічного лікування становив 3,5 ± 0,6 бала, що майже у 1,5 раза менше, ніж у аналогічній підгрупі з групи порівняння. Подібна ситуація виявилася і в підгрупах пацієнтів, яким виконувався стабільно-функціональний остеосинтез з приводу перелому кісточок гомілки (табл. 2, рис. 2).
При оцінюванні швидкості настання знеболювального ефекту в основній групі пацієнтів виявлено вірогідно кращий результат (p < 0,01), що в обох підгрупах основної групи та групи порівняння відрізнявся майже в 3 рази. Так, якщо в підгрупі артроскопії швидкість знеболювання пацієнтів основної групи в середньому становила 8,7 хв, то у пацієнтів групи контролю — 26,3 хв. Після остеосинтезу кісточок гомілки в основній групі швидкість настання знеболювання становила 9,3 хв, а в групі контролю — 29,2 хв (табл. 2, рис. 3).
/40.jpg)
Що стосується тривалості знеболювання, що визначалася часом, через який пацієнт потребував повторного введення аналгетика, то в основній групі пацієнтів у підгрупі остеосинтезу відзначено незначне переважання часу знеболювання порівняно з групою порівняння, що становило відповідно 6,5 та 6,4 год. У підгрупі ж артроскопії нами зафіксовано, що тривалість знеболювання в основній групі була навіть дещо меншою, ніж у групі порівняння (6,7 та 6,9 год), однак статистичної різниці при цьому не було (p > 0,05). Отже, за тривалістю знеболювання переваг у групах спостереження, крім групи плацебо-контролю, виявлено не було (табл. 2, рис. 4).
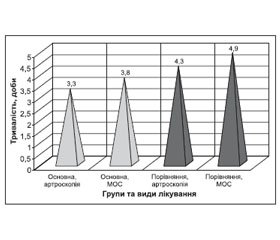
Оцінка тривалості застосування мультимодальної аналгезії в групах спостереження засвідчила, що в основній групі загальний час потреби пацієнтів у знеболюванні був вірогідно меншим (p < 0,05), ніж у пацієнтів груп порівняння та плацебо-контролю. Так, в основній групі пацієнтів у підгрупі артроскопії середня тривалість знеболювання становила 3,3 доби, а в підгрупі остеосинтезу — 3,8 доби. У групі порівняння дані показники становили 4,3 та 4,9 доби відповідно (табл. 2, рис. 5).
Аналіз частоти та характеру виникнення побічних ефектів та небажаних проявів внаслідок застосування аналгетичних препаратів в групах спостереження виявив, що при використанні назальної форми кеторолаку трометаміну Asprix в основній групі у 23 % пацієнтів спостерігалися такі явища, як свербіж у носі, нежить та короткочасне порушення носового дихання, іноді сльозотеча. У групі плацебо-контролю аналогічні явища спостерігалися в 14 % пацієнтів, а в групі порівняння не спостерігалися. При цьому зафіксовані пацієнтами побічні прояви не спричинювали відмову від застосування препарату, оскільки були нетривалими, а вираженість їх не була значною. Водночас явища, пов’язані з гастропатичним впливом препаратів, частіше спостерігалися в групі порівняння (20 % пацієнтів), а в основній групі та групі плацебо-контролю зафіксовані лише поодинокі випадки, що швидко усувалися корекцією дієти (табл. 3).
Висновки
1. Аналіз отриманих результатів показав, що в ортопедо-травматологічних пацієнтів у ранньому післяопераційному періоді застосування в складі мультимодальної аналгезії назальної форми кеторолаку трометаміну Asprix забезпечує високий рівень знеболювання за такими показниками, як вираженість аналгезії, швидкість настання ефекту та його тривалість, а також забезпечує скорочення курсу знеболювальної терапії.
2. Назальна форма препарату Asprix зручна у використанні в процесі лікування, полегшує можливість самоконтролю пацієнтом больового синдрому, а отже, запобігає формуванню осередку больового збудження у ЦНС.
3. За результатами проведеного порівняльного дослідження засвідчено переваги застосування назальної форми кеторолаку трометаміну перед декскетопрофеном трометамолом у складі комплексної мультимодальної аналгезії щодо швидкості настання ефекту, вираженості знеболювання та скорочення загального періоду необхідного знеболювання. Це пов’язано з доведеною потужною знеболювальною дією на рівні ЦНС (вплив на процеси модуляції болю), а також з ефективною периферичною протизапальною дією в осередку патологічного процесу (вплив на процес трансдукції).
4. Схема та препарати для мультимодальної аналгезії повинні добиратися індивідуально з урахуванням локалізації оперативного втручання, вираженості больового синдрому, часового періоду знеболювання й особливостей пацієнта.
Список литературы
1. Breivik H., Collett B., Ventafridda V., Cohen R., Gallacher D. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment // European Journal of Pain. — 2005. — 10. — 287-333.
2. Brodner G., Mertes N., Buerkle H., Marcus M.A.E., Van Aken H. Acute pain management: analysis, implications and consequences after prospective experience with 6349 surgical patients // Eur. J. Anaesth. — 2011. — 17. — 566-75.
3. Chaparro L.E., Smith S.A., Moore R.A. et al. Pharmacotherapy for the prevention of chronic pain after surgery in adults // Cochrane Database Syst. Rev. — 2013. — 7. — CD008307.
4. Colin А. et al. Analgesic Efficacy and Safety of Single-Dose Oral and Intramuscular Ketorolac Tromethamine for Postoperative Pain // JHPDT. — 1990. — Vol. 10, Іss. 62. — Р. 59S-70S.
5. Gupta A., Favaios S., Perniola A., Magnuson A., Berggren L. A meta-analysis of the efficacy of wound catheters for post-operative pain management // Acta Anaesthesiologica Scandinavica. — 2011. — 55(7). — 785-796.
6. Lohman D., Schleifer R., Amon J.J. Access to pain treatment as a human right // BMC Medicine. — 2010. — 8, 8. doi:10.1186/1741-7015-8-8.
7. McDaid C., Maund E., Rice S. et al. Paracetamol and selective and non-selective non-steroidal anti-inflammatory drugs (NSAIDs) for the reduction of morphine-related side effects after major surgery: a systematic review // Health Technol. Assess. — 2010. — 14. — 1.
8. McNicol E.D., Schumann R., Haroutounian S. A systematic review and meta-analysis of ketamine for the prevention of persistent post-surgical pain // Acta Anaesthesiol. Scand. — 2014. — 58. — 1199.
9. Mhuircheartaigh R.J., Moore R.A., McQuay H.J. Analysis of individual patient data from clinical trials: epidural morphine for postoperative pain // British Journal of Anaesthesia. — 2009. — 103(6). — 874-81. Epub 2009 Nov 4.
10. Moore R.A., McQuay H.J., Wiffen P.J. Single dose oral analgesics for acute postoperative pain in adults // Cochrane Database of Systematic Review. — 2011. — Issue 9. — CD008659.
11. Pavy T.J., Paech M.J., Evans S.F. The effect of intravenous ketorolac on opioid requirement and pain after cesarean delivery // Anesth. Analg. — 2001. — 92. — 1010.
12. Timothy H. Rainer. Cost effectiveness analysis of intravenous ketorolac and morphine for treating pain after limb injury: double blind randomised controlled trial // BMJ. — 2000 Nov 18. — 321(7271). — 1247.
13. Visentin M., Zanolin E., Trentin L., Sartori S., de Marco R. Prevalence and treatment of pain in adults admitted to Italian hospitals // European Journal of Pain. — 2005 Feb. — 9(1). — 61-7.
14. Young A., Buvanendran A. Recent advances in multimodal analgesia // Anesthesiol. Clin. — 2012. — 30. — 91.
/38.jpg)

/38_2.jpg)
/39.jpg)
/40.jpg)
/41.jpg)