Журнал «Травма» Том 17, №3, 2016
Вернуться к номеру
Функціональний стан нижніх кінцівок у хворих з ортопедичними проявами спінальних дизрафій
Авторы: Гук Ю.М., Чеверда А.І., Секер Т.М., Кінча-Поліщук Т.А., Шкурко Ю.М., Зотя А.В. - ДУ «Інститут травматології та ортопедії НАМН України», м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
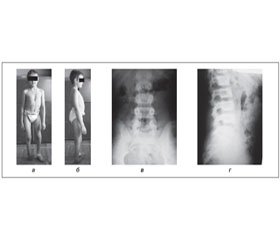
Спінальні дизрафії є важливою причиною статико-локомоторних порушень у дітей. Залежно від рівня ураження спинного мозку виникає різний ступінь паралічу чи парезу нижніх кінцівок, порушення функції тазових органів, деформації кінцівок і хребта, що значною мірою впливає на якість життя дитини та її можливість до пересування та обслуговування. Мета: залежно від рівня функціональної недостатності нижніх кінцівок оцінити здатність до пересування хворих із наслідками відкритих форм спінальних дизрафій. Матеріали та методи. Матеріал дослідження становили 81 пацієнт віком від 5 до 21 року (середній вік 8 років 10 місяців): у 69 пацієнтів спостерігався парапарез нижніх кінцівок, у 12 — монопарез. Визначення рівня нейросегментарного ураження спинного мозку проводилося згідно з класифікацією Sharrard`s (1964) у модифікації Bartonek et al. (1999). Здатність до пересування оцінювали за класифікацією Hoffer et al. (1973). Результати та обговорення. Всіх хворих, включених у дослідження, розподілено відповідно до рівня функціональної м’язової сили на 5 клінічних груп із визначеним рівнем функціональної м’язової сили за класифікацією Sharrard’s (1964) у модифікації Bartonek et al. (1999), проведено оцінку фактичного ступеня пересування хворих за Hoffer (1973). Порівняння отриманого фактичного ступеня пересування до теоретично очікуваного ступеня пересування пацієнтів показало, що діти з однаковим рівнем функціональної недостатності нижніх кінцівок не завжди досягають очікуваного ступеня пересування, а залежно від впливу супутніх факторів, таких як інтелектуальний (розумовий) рівень дитини, прогресування гідроцефалії, ожиріння, тяжкість ортопедичної патології, наявність спастичності та інші, можуть досягати як вищого, так і гіршого ступеня пересування. Висновки. Рівень нейросегментарного ураження спинного мозку, що визначає рівень м’язової функції нижніх кінцівок, є важливим фактором у здатності до пересування хворих із наслідками спінальних дизрафій. Пацієнти з однаковим рівнем втрати м’язової функції не завжди досягають очікуваного рівня пересування.
Спинальные дизрафии — важная причина статико-локомоторных нарушений у детей. В зависимости от уровня поражения спинного мозга возникают различная степень паралича и пареза нижних конечностей, нарушение функции тазовых органов, деформации конечностей и позвоночника, что в значительной степени влияет на качество жизни ребенка и его возможность к передвижению и обслуживанию. Цель. В зависимости от уровня функциональной недостаточности нижних конечностей оценить способность к передвижению больных с последствиями открытых форм спинальных дизрафий. Материалы и методы. Материал исследования составили 81 пациент в возрасте от 5 до 21 года (средний возраст 8 лет 10 месяцев): у 69 пациентов наблюдался парапарез нижних конечностей, у 12 — монопарез. Определение уровня нейросегментарного поражения спинного мозга выполнялось согласно классификации Sharrard`s (1964) в модификации Bartonek
et al. (1999). Способности к передвижению оценивали по класификации Hoffer et al. (1973). Результаты и обсуждение. Все больные, включенные в исследование, распределены соответсвенно уровню функциональной мышечной силы на 5 клинических групп с определением уровня функциональной мышечной силы по классификации Sharrard’s (1964) в модификации Bartonek et al. (1999), проведена оценка фактической степени передвижения больных по Hoffer (1973). Сравнение полученной фактической степени передвижения к теоретически ожидаемой степени передвижения пациентов показало, что дети с одинаковым уровнем функциональной недостаточности нижних конечностей не всегда достигают ожидаемой степени передвижения, а в зависимости от влияния сопутствующих факторов, таких как интелектуальный (умственный) уровень ребенка, прогрессирование гидроцефалии, ожирение, тяжесть ортопедической патологии, наличие спастичности и др., могут достигать как лучшей, так и худшей степени передвижения. Выводы. Уровень нейросегментарного поражения спинного мозга, определяющий уровень мышечной функции нижних конечностей, является важным фактором в способности к передвижению больных с последствиями спинальных дизрафий. Пациенты с одинаковым уровнем потери мышечной функции не всегда достигают ожидаемой степени передвижения.
Spinal dysraрhism is an important cause of static-locomotor disorders in children. Injuries of varying degrees of paralysis or paresis of the lower limbs, dysfunction of the pelvic organs, limbs and spine deformation, which significantly affects the quality of life and ability to movement and maintenance depends on the level of spinal cord lesion. Objective. To assess the ability to move in patients with the consequences of open forms of spinal dysraрhism, depending on the level of functional insufficiency of the lower limbs. Materials and methods. Material of the study were 81 patients aged from 5 to 21 years old (average age was 10 years and 8 months olg), 69 patients experienced paraparesis of the lower extremities, 12 — monoparesis. To determine the level of spinal cord lesion we used Sharrard’s (1964) as modified Bartonek et al. (1999) classification. Ability to move was evaluated by Hoffer et al. (1973) classification. Results and discussion. All patients included in the study are distributed according to the level of functional muscular strength into five clinical groups with a certain level of functional muscular strength by Sharrard’s classification (1964) with Bartonek modification (1999) and estimated actual degree of movement in the patients by Hoffer’s classification. Comparing the actual degree of movement in groups of patients to the theoretically expected degree of movement of patients it was conducted that children with the same level of functional insufficiency of the lower limbs do not always achieve the expected degree of movement, and it depends on the confounding factors such as intellectual (mental) level of a child, the progression of hydrocephalus, obesity, severity of orthopedic pathology, presence of spasticity that impact a degree of movement. Conclusions. The level of the spinal cord lesion that determines the level of muscle function of the lower limbs is an important factor in the ability of patients to move in comorbid spinal dysraphism. Patients with the same level of loss of the muscle function does not always achieve the expected level of movement.
спінальні дизрафії, нижні кінцівки, параліч, парез, сила м’язів.
спинальные дизрафии, нижние конечности, паралич, парез, сила мышц.
spinal dysraphism, lower limbs, paralysis, paresis, muscle strength.
Статтю опубліковано на с. 82-91
Спінальні дизрафії (СД) — група вроджених аномалій розвитку спинного мозку та хребта, що виникає внаслідок порушення злиття однієї чи більше хребцевих арок в поєднанні з формуванням грижового мішка зі спинномозкових оболонок, і залученням спинного мозку і нервових корінців за межами спинномозкового каналу, що веде до формування різноманітних клінічних проявів [2, 10, 23]. Сьогодні виділяють такі форми СД: spina bifida occulta — приховане незарощення хребта; spina bifida cystica uverta — відкрите розщеплення хребта з формуванням кистозної спинномозкової грижі; rhachischiasis posterior (totalis et partialis) — розщеплення хребта та м’яких тканин з розшаруванням спинного мозку, що виникає на всьому протязі хребта чи тільки в якойсь його частині.
Матеріали та методи
Результати та обговорення
Висновки
1. Abraham E. Supramalleolar osteotomy for ankle valgus in myelomeningocele / E. Abraham, J.P. Lubicky, M.N. Songer, E.A. Millar // J. Ped. Orthop. — 1996. — Vol. 16. — P. 774-781.
2. Akar Z. Myelomeningocele / Z. Akar // Surg. Neural. — 1995. — Vol. 43. — P. 113-118.
3. Alexiou G.A. Cerebral abnormalities in infants with myelomeningocele / G.A. Alexiou, M.K. Zarifi, G. Georgoulis et al. // Neurol. Neurochir. Pol. — 2011. — Vol. 45. — P. 18-23.
4. Asher M. Factors affecting the ambulatory status of patients with spina bifida cystica / M. Asher, J. Olson // J. Bone Joint Surg. — 1983. — Vol. 65-A. — P. 350-356.
5. Banta J.V. Long-term ambulation in spina bifida / J.V. Banta, J.M. Casey, L. Bedell, J. Morgan // Devel. Med. Child Neurol. — 1983. — Vol. 25. — P. 110.
6. Bartonek A. Ambulation in patients with myelomeningocele: a 12-year follow-up / A. Bartonek, H. Saraste, L. Samuelsson, M. Skoog // J. Ped. Orthop. — 1999. — Vol. 19. — P. 202-206.
7. Bartonek A. Factors influencing ambulation in myelomeningocele: a cross-sectional study / A. Bartonek, H. Saraste // Dev. Med. Child Neurol. — 2001. — Vol. 43. — P. 253-260.
8. Broughton N.S. The high incidence of foot deformity in patients with high-level spina bifida / N.S. Broughton, G. Graham, M.M. Menelaus // J. Bone Joint Surg. — 1994. — Vol. 76-B. — P. 548-550.
9. Correll J. The effect of soft tissue release of the hips on walking in myelomeningocele / J. Correll, C. Gabler // J. Ped. Orthop. — 2000. — Vol. 9-B. — P. 148-153.
10. Doran P.A. Studies in spina bifida cystica: I general survey and reassessment of the problem / P.A. Doran, A.N. Guthkelch // J. Neurol. Neurosurg. Psychiatry. — 1961. — Vol. 24. — P. 331-345.
11. Fletcher J.M. Spinal lesion level in spina bifida: a source of neural and cognitive heterogeneity / J.M. Fletcher, K. Copeland, J.A. Frederick et al. // J. Neurosurg. — 2005. — Vol. 102 (Suppl. 3). — P. 268-279.
12. Hoffer M.M. Functional ambulation in patients with myelomeningocele / M.M. Hoffer, E. Feiwell, R. Perry et al. // J. Bone Joint Surg. — 1973. — Vol. 55-A. — P. 137-148.
13. Huff C.W. Myelodysplasia / C.W. Huff, P.L. Ramsey, M.D. Wilmington // J. Bone Joint Surg. — 1978. — Vol. 60-A. — P. 432-443.
14. Lee E.H. Hip stability and ambulatory status in myelomeningocele / E.H. Lee, N.C. Carroll // J. Ped. Orthop. — 1985. — Vol. 5. — P. 522-527.
15. Lew S.M. Tethered cord syndrome: an updated review / S.M. Lew, K.F. Kothbauer // Pediatr. Neurosurg. — 2007. — Vol. 43(3). — P. 236-248.
16. Lindseth R.E. Myelomeningocele / R.E. Lindseth, L.S. Dias, J.C. Drennan // Instr. Course Lect. — 1991. — Vol. 40. — P. 271-291.
17. Marshall P.D. Surgical release of knee flexion contractures in myelomeningocele / P.D. Marshall, N.S. Broughton, M.B. Menelaus, H.K. Graham // J. Bone Joint Surg. — 1996. — Vol. 78-B. — P. 912-916.
18. Mazur J.M. Neurologic status of spina bifida patients and the orthopedic surgeon / J.M. Mazur, M.B. Menelaus // Clin. Orthop. Relat. Research. — 1991. — Vol. 264. — P. 4-64.
19. McDonald C.M. Ambulatory outcome of children with myelomeningocele: effect of lower-extremity muscle strength / C.M. McDonald, K.M. Jaffe, V.S. Mosca, D.B. Shurtleff // Devel. Med. Child Neurol. — 1991. — Vol. 33. — P. 482-490.
20. McDonald C.M. Assessment of muscle strength in children with myelomeningocele: accuracy and stability of measurements over time / C.M. McDonald, K.M. Jaffe, D.B. Shurtleff // Arch. Phys. Med. Rehabil. — 1986. — Vol. 67. — P. 855-861.
21. Northrup H., Volcik K.A. Spina bifida and other neural tube defects / H. Northrup, K.A. Volcik // Curr. Probl. Pediatr. — 2000. — Vol. 30. — P. 313-332.
22. Phillips D.L. Reciprocating orthoses for children with myelomeningocele. A comparison of two types / D.L. Phillips, R.E. Field, N.S. Broughton et al. // J. Bone Joint Surg. — 1995. — Vol. 77-B. — P. 110-113.
23. Rengasamy P. Etiology, pathogenesis and prevention of neural tube defects / P. Rengasamy // Cong. Anomal. — 2006. — Vol. 46. — P. 55-67.
24. Samuelsson L. Ambulation in patients with myelomeningocele: a multivariate statistical analysis / L. Samuelsson, M. Skoog // J. Ped. Orthop. — 1988. — Vol. 8. — P. 569-575.
25. Sharrard W.J.W. The segmental innervation of the lower limb muscles in man / W.J.W. Sharrard // An. Royal Coll. Surg. — 1964. — Vol. 35. — P. 106-122.
26. Swaroop V.T. Orthopaedic management of spina bifida. Part I: hip, knee and rotational deformities / V.T. Swaroop, L.S. Dias // J. Child. Orthop. — 2009. — Vol. 3. — P. 441-449.
27. Swaroop V.T. Orthopaedic management of spina bifida. Part II: foot and ankle deformities / V.T. Swaroop, L. Dias // J. Child. Orthop. — 2011. — Vol. 5. — P. 403-414.
28. Vachha B. Limbic tract anomalies in pediatric myelomeningocele and Chiari II malformation: anatomic correlations with memory and learning — initial investigation / B. Vachha, R.C. Adams, N.K. Rollins // Radiology. — 2006. — Vol. 240. — P. 194-202.

/85.jpg)
/86.jpg)
/87.jpg)
/88.jpg)
/89.jpg)