Статтю опубліковано на с. 21-24
Магній (Mg) є четвертим найбільш поширеним катіоном в організмі людини [6]. У середньому в організмі дорослої людини міститься 21–28 г (2000 мг-екв) магнію [4]. Переважна більшість цього іона знаходиться в середині клітини (99 %) [9], а решта 1 % — у позаклітинній рідині. Основним депо внутрішньоклітинного Mg є кістки (60–65 %). Приблизно 25–30 % локалізуються у скелетних м’язах, близько 10–15 % — в інших нем’язових м’яких тканинах.
Баланс магнію, як і інших іонів, підтримується його надходженням ззовні та виведенням з організму. Надходження в організм залежить від вмісту магнію в продуктах харчування. Найбільш багатими щодо вмісту цього мікроелемента є зелені овочі, насіння бобових, горох, горіхи [6]. Незначна кількість магнію всмоктується в шлунку. Але основним місцем всмоктування Mg є тонкий кишечник [8], особливо його проксимальні ділянки.
Нирки відіграють основну роль у підтриманні гомеостазу Mg, забезпечуючи його виведення. Приблизно 70–80 % Mg плазми підлягає фільтрації, що становить близько 2 г Mg щодня. У нормальних умовах 95 % відфільтрованого Mg реабсорбується в нирках, і тільки 5 % (100 мг) виводиться з сечею. Рух магнію в нефроні відрізняється від більшості інших іонів тим, що проксимальний каналець не є основним місцем реабсорбції і забезпечує реабсорбцію тільки 15–25 % відфільтрованого Mg. Більшість же Mg підлягає реабсорбції (60–70 %) у висхідному коліні петлі Генле [12].
Концентрація сироваткового Mg є визнаним біомаркером магнієвого статусу. Але оскільки магній є в основному внутрішньоклітинним елементом, то концентрація його в сироватці крові може не завжди адекватно відображати вміст елемента в середині клітини [2]. Тому треба враховувати, що при концентрації магнію на рівні нижньої межі референтного діапазону часто спостерігається його дефіцит [1].
Оцінка магнієвого статусу шляхом визначення іонізованого магнію за аналогією до іонізованого кальцію з урахуванням інтрацелюлярного розміщення також є неадекватною та економічно недоцільною. Визначення добової екскреції магнію з сечею на фоні навантаження магнієм [13], а також визначення магнію в еритроцитах у рутинній клінічній практиці не використовується. Тому сироватковий Mg залишається на сьогодні єдиним критерієм магнієвого статусу.
Аліментарні дослідження показують, що значна частина дорослих в Північній Америці мають неадекватне споживання Mg. Канадське дослідження Canadian Community Health Survey 2.2 (2004) показало, що більше 34 % дорослого населення у віці від 19 років має споживання Mg з їжею нижче від розрахункових середніх потреб [3].
Коли аліментарне споживання магнію недостатнє, нирки можуть компенсувати нестачу за рахунок збільшення реабсорбції. Проте тривалий аліментарний дефіцит у кінцевому підсумку призведе до зниження внутрішньоклітинної концентрації магнію.
Також варто врахувати часте застосування лікарських засобів, що виводять магній. Переважно це сечогінні препарати [10] (петльові, тіазидні, тіазидоподібні), що широко використовуються у пацієнтів з артеріальною гіпертензією, серцевою недостатністю, хронічною хворобою нирок (ХХН).
/22.jpg)
Ниркова недостатність є найбільш поширеною причиною гіпермагніємії, що перебігає як правило, м’яко і безсимптомно навіть у хворих із термінальною нирковою недостатністю. У пацієнтів з ХХН, поки швидкість клубочкової фільтрації не зменшиться нижче за 30 мл/хв, екскреція магнію з сечею може бути нормальною або навіть підвищеною. У міру прогресування ХХН, коли швидкість клубочкової фільтрації зменшується нижче за 30 мл/хв, виведення магнію може бути недостатнім [11], щоб збалансувати його надходження через кишечник. З іншого боку, деякі умови призводять і до негативного балансу Mg у цих пацієнтів, наприклад використання діуретиків, зниження шлунково-кишкової абсорбції (через ацидоз, недостатнє харчування і всмоктування).
Тому питання зміни концентрації магнію в сироватці крові при ХХН не є остаточно вивченими і потребують подальших спостережень для встановлення індивідуальних особливостей.
Мета дослідження: оскільки дефіцит магнію відіграє важливу роль у виникненні та прогресуванні серцево-суднних захворювань, формуванні порушення толерантності до глюкози, метаболічного синдрому, дослідження було проведене для оцінки поширеності гіпомагніємії у пацієнтів з хронічною хворобою нирок І–ІІІ стадій.
Матеріали і методи
Було обстежено 33 пацієнти КЗ Київської обласної ради «Київська обласна лікарня № 2» з хронічною хворобою нирок віком 49–82 роки. Середній вік обстежуваних становив 64 роки. Серед них було 25 чоловіків (76 %) і 8 жінок (24 %). За стадіями розподіл пацієнтів був таким: І стадію хронічної хвороби нирок було діагностовано у 6 пацієнтів (18 %), ІІ стадію — у 18 пацієнтів (55 %), ІІІ — відповідно у 9 пацієнтів (27 %). Усі пацієнти були обстежені в такому обсязі: проводилось обстеження на виявлення альбумінурії шляхом напівкількісного визначення співвідношення альбумін/креатинін з використанням тест-смужок Microalbuphan®, був виконаний загальний аналіз сечі, визначення рівнів сечової кислоти, креатиніну і магнію сироватки крові. Проводився розрахунок швидкості клубочкової фільтрації з використанням формули CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). Причиною розвитку ХХН у більшості пацієнтів була артеріальна гіпертензія — 55 % (18 пацієнтів), поєднання цукрового діабету ІІ типу з артеріальною гіпертензією — 33 % (11 пацієнтів), поєднання артеріальної гіпертензії з подагрою — 9 % (3 пацієнти), цукровий діабет І типу — 3 % (1 пацієнт). Під час дослідження дуже висока альбумінурія була виявлена у 33 % (11 пацієнтів), висока — у 67 % (22 пацієнти). Гіперкреатинемія спостерігалась в 1 пацієнта. Розрахункова швидкість клубочкової фільтрації за формулою CKD-EPI становила в середньому 70,7 ± 18,0 мл/хв/1,73 м2 з коливаннями від 37 до 109 мл/хв/1,73 м2.
Усім пацієнтам, у яких було виявлено гіпомагніємію, проводилася її корекція з використанням препаратів магнію, оскільки дефіцит магнію з урахуванням його потенційних негативних впливів з боку серцево-судинної системи потребує обов’язкової корекції. Пацієнтам із дефіцитом магнію був призначений препарат магнерот у дозі 1000 мг 3 рази на день протягом одного тижня, потім 500 мг 3 рази на день ще протягом трьох тижнів. Контроль вмісту магнію був проведений через 4 тижні.
Результати та їх обговорення
При нижній межі норми концентрації магнію в сироватці крові 0,67 ммоль/л (референтні значення лабораторії КЗ КОР «Київська обласна лікарня № 2») середня концентрація магнію сироватки крові досліджуваних становила 0,69 ± 0,09 ммоль/л, з мінімальним значенням 0,56 ммоль/л — у 2 пацієнтів (6 %) і максимальним значенням 1,05 ммоль/л — у 1 пацієнта (3 %). У цілому ж дефіцит магнію був виявлений у 12 пацієнтів із хронічною хворобою нирок І–ІІІ стадій, що становило 36 % досліджуваних. Середні значення магнію не відрізнялися у чоловіків (0,696 ± 0,108 ммоль/л) і жінок (0,700 ± 0,038 ммоль/л) (рис. 2Б). Також у наявній вибірці не виявлено залежності рівня магнію в сироватці крові від стадії хронічної хвороби нирок, він становив в середньому для І стадії 0,680 ± 0,007 ммоль/л, для ІІ стадії — 0,708 ± 0,106 ммоль/л і для ІІІ — 0,69 ± 0,09 ммоль/л (рис. 2А).
/23.jpg)
Враховуючи невелику кількість пацієнтів, які брали участь у дослідженні, для статистичної обробки матеріалу було використано непараметричні методи оцінки, а саме коефіцієнт рангової кореляції Спірмена та непараметричний критерій Манна — Уїтні, що забезпечують достатньо високу статистичну вірогідність результатів навіть за відсутності нормального розподілу значень показників дослідження.
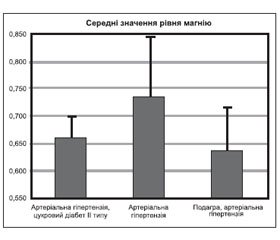
При індивідуальному аналізі кожної з груп пацієнтів із різними стадіями хронічної хвороби нирок було виявлено прямий зв’язок між швидкістю клубочкової фільтрації та концентрацією магнію сироватки крові з використанням коефіцієнта рангової кореляції Спірмена (коефіцієнт кореляції становив 0,71) у пацієнтів з ІІІ стадією ХХН (p-level 0,031887). При порівнянні рівнів магнію у групах з артеріальною гіпертензією та поєднанням артеріальної гіпертензії і цукрового діабету з використанням непараметричного критерію Манна — Уїтні виявлено вірогідну різницю у цих групах: у групі з артеріальною гіпертензією рівень магнію був вірогідно вищим і становив 0,736 ± 0,105 ммоль/л порівняно з групою з поєднанням артеріальної гіпертензії і цукрового діабету, де середнє значення було 0,66 + 0,04 ммоль/л (p-level 0,0169) (рис. 3).
Серед 12 пацієнтів із гіпомагніємією у 4 було додатково діагностовано гіперурикемію. Середнє значення сечової кислоти у цих пацієнтів становило 446,75 ± 28,01 мкмоль/л, у пацієнтів з нормальним рівнем сечової кислоти та гіпомагніємією — 282,12 ± 60,69 мкмоль/л.
Через 4 тижні від початку лікування препаратом магнію середні показники сироваткого магнію становили 0,699 ± 0,024 ммоль/л порівняно з вихідним рівнем 0,613 ± 0,034 ммоль/л. Додатково у пацієнтів із гіперурикемією виявлено зниження рівня сечової кислоти до 408,75 ± 17,02 мкмоль/л.
Висновки
У 36 % пацієнтів із хронічною хворобою нирок І–ІІІ стадій діагностовано гіпомагніємію. Частота виявлення гіпомагніємії була однаковою у пацієнтів з різними стадіями захворювання: серед пацієнтів з І стадією ХХН дефіцит магнію був у 33 %, з ІІ стадією — у 39 %, з ІІІ — у 33 %. Що стосується причин розвитку ХХН, то найменша кількість пацієнтів з гіпомагніємією була серед пацієнтів тільки з артеріальною гіпертензією — 17 %, при приєднанні до артеріальної гіпертензії цукрового діабету ІІ типу дефіцит магнію був діагностований у 56 %, а при поєднанні артеріальної гіпертензії з подагрою — у 67 %.
Корекція гіпомагніємії дозволила нормалізувати значення магнію при 4-тижневому курсі лікування в усіх пацієнтів. З огляду на підвищений ризик серцево-судинної патології у пацієнтів із хронічною хворобою нирок, гіпомагніємія потребує особливої уваги у цією когорти пацієнтів, оскільки магній сповільнює розвиток кальцифікації судин, також запобігає розвитку аритмій, регулює артеріальний тиск шляхом зменшення загального периферичного опору, виявляє антитромботичну дію, стимулює синтез оксиду азоту, зменшує запальну відповідь та полегшує реендотеліалізацію судинних пошкоджень [7].
Отримані дані потребують подальших досліджень для встановлення статистично значущих тенденцій та формулювання рекомендацій для нефрологічної практики.
Конфлікт інтересів: відсутній.
Рецензенти: член-кор. НАМН України проф. В.З. Нетяженко, доцент О.І. Таран.
Список литературы
1. Магний: роль в развитии и лечении инсулинорезистентности, метаболического синдрома и диабета. Рекомендации Германского общества по исследованию магния (2014 г.) // Рациональная фармакотерапия: сборник клинических рекомендаций. — 2015. — С. 31-37.
2. Ayuk J. How should hypomagnesaemia be investigated and treated? / Ayuk J., Gittoes N.J. // Clin. Endocrinol. (Oxf.). — 2011. — Vol. 75, № 6. — Р. 743-746. — Doi: 10.1111/j.1365-2265.2011.04092.x. — PMID: 21569071.
3. Bertinato J. Lower serum magnesium concentration is associated with diabetes, insulin resistance, and obesity in South Asian and white Canadian women but not men / Bertinato J., Xiao C.W., Ratnayake W.M., Lois Fernandez L., Lavergne C., Wood C., Swist E. // Food Nutr. Res. — 2015. — Vol. 59, № 25974. — Doi: 10.3402/fnr.v59.25974. PMCID: PMC4422846.
4. Fox C. Magnesium: its proven and potential clinical significance / Fox C., Ramsoomair D., Carter C. // South Med. J. — 2001. — Vol. 94, № 12. — Р. 1195-1201. — PMID: 11811859.
5. Hazardous chemicals in human and environmental health. —WHO, 2002. — 312 р.
6. Ismail Y. The underestimated problem of using serum magnesium measurements to exclude magnesium deficiency in adults; a health warning is needed for «normal» results / Ismail Y., Ismail A.A., Ismail A.A. // Clin. Chem. Lab. Med. — 2010. — Vol. 48, № 3. — Р. 323-327. — Doi: 10.1515/CCLM.2010.077. — PMID: 20170394.
7. Kanbay M. Magnesium in chronic kidney disease: challenges and opportunities / Kanbay M., Goldsmith D., Uyar M.E., Turgut F., Covic // Blood Purif. — 2010. — Vol. 29, № 3. — Р. 280-292. — Doi: 10.1159/000276665. Epub. 2010 Jan 21. — PMID: 20090315.
8. Knoers N.V. Inherited forms of renal hypomagnesemia: an update // Pediatr. Nephrol. — 2009. — Vol. 24, № 4. — Р. 697-705. — Doi: 10.1007/s00467-008-0968-x. Epub. 2008 Sep 26. — PMID: 18818955.
9. Konrad M. Insights into the molecular nature of magnesium homeostasis / Konrad M., Schlingmann K.P., Gudermann T. // Am. J. Physiol. Renal. Physiol. — 2004. — Vol. 286, № 4. — Р. 599-605. — PMID: 15001450.
10. Morger I.D. Plasma ionized magnesium in tubular disorders with and without total hypomagnesemia / Morger I.D., Truttmann A.C., von Vigier R.O., Bettinelli A., Ramelli G.P., Bianchetti M.G. // Pediatr. Nephrol. — 1999. — Vol. 13, № 1. — Р. 50-53. — PMID: 10100289.
11. Navarro-González J.F. Clinical implications of disordered magnesium homeostasis in chronic renal failure and dialysis / Navarro-González J.F., Mora-Fernández C., García-Pérez J. // Semin. Dial. — 2009. — Vol. 22, № 1. — Р. 37-44. — Doi: 10.1111/j.1525-139X.2008.00530.x. — PMID: 19250445.
12. Schlingmann K.P. Genetics of hereditary disorders of magnesium homeostasis / Schlingmann K.P., Konrad M., Seyberth H.W. // Pediatr. Nephrol. — 2004. — Vol. 19, № 1. — Р. 13-25. — Epub. 2003 Nov 22. — PMID: 14634861.
13. Wälti M.K. Urinary excretion of an intravenous 26Mg dose as an indicator of marginal magnesium deficiency in adults / Wälti M.K., Walczyk T., Zimmermann M.B., Fortunato G., Weber M., Spivas G.A., Hurrell R.F. // Eur. J. Clin. Nutr. — 2006. — Vol. 60, № 2. — Р. 147-154. — PMID: 16234844.
/22.jpg)

/23.jpg)