Журнал «Травма» Том 17, №4, 2016
Вернуться к номеру
Структурні зміни плечового суглоба при експериментальному відтворенні його порушеної біомеханіки
Авторы: Сергієнко Р.О., Страфун С.С., Савосько С.І., Макаренко О.М. - ДУ «Інститут травматології та ортопедії НАМН України», м. Київ, Україна; Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Деформуючий остеоартроз плечового суглоба — актуальна та малодосліджена проблема. Одним з основних чинників розвитку артрозу є травматичне ушкодження капсулярно-зв’язкового апарату суглоба, порушення рухомості суглоба та запалення. Разом із тим залишається невстановленим місце аномальної біомеханіки у розвитку остеоартрозу плечового суглоба як монофактора патологічного стану. Мета. Дослідити роль обмеженої біомеханіки плечового суглоба як монопатогенетичного чинника в розвитку остеоартрозу плечового суглоба. Матеріали та методи. В експерименті морським свинкам відтворювали модель остеоартрозу і через 3 місяці досліджували структурні зміни суглоба. Із декальцинованих зразків плечового суглоба отримували кріозрізи, проводили гістологічне та морфометричне дослідження. Результати та обговорення. Встановлено структурні порушення суглобової поверхні головки плечової кістки і западини лопатки, зміну контура субхондральної кісткової тканини, проліферативні зміни капсули суглоба. Порушена рухливість і змінена зона навантаження спричинили втрату 48 % (р < 0,01) товщини хрящової суглобової поверхні плечової кістки та 14 % з боку гленоїду (р < 0,01). Тобто суттєве обмеження мобільності (біомеханіки) плечового суглоба призводить до дистрофічних змін хрящових елементів в обох суглобових поверхнях. Висновки. Результати експериментальних досліджень підтвердили, що порушена біомеханіка рухів плечового суглоба є одним із монопатогенетичних чинників остеоартрозу.
Деформирующий остеоартроз плечевого сустава — актуальная и малоизвестная проблема. Одним из основных факторов развития артроза является травматическое повреждение капсульно-связочного аппарата сустава, нарушение подвижности сустава и воспаление. Вместе с тем остается не установленной роль аномальной биомеханики в развитии остеоартроза плечевого сустава как монофактора патологического состояния. Цель. Исследовать роль ограниченной биомеханики плечевого сустава как монопатогенетичного фактора в развитии остеоартроза плечевого сустава. Материалы и методы. В эксперименте у морских свинок воспроизводили модель остеоартроза и через 3 месяца исследовали структурные изменения сустава. С декальцинированных образцов плечевого сустава получали криосрезы, проводили гистологическое и морфометрические исследования. Результаты и обсуждение. Установлены структурные нарушения суставной поверхности головки плечевой кости и впадины лопатки, изменение контура субхондральной костной ткани, пролиферативные изменения капсулы сустава. Нарушенная подвижность и измененная зона нагрузки привели к утрате 48 % (р < 0,01) толщины хрящевой суставной поверхности плечевой кости и 14 % со стороны гленоида (р < 0,01). То есть существенное ограничение мобильности (биомеханики) плечевого сустава приводит к дистрофическим изменениям хрящевых элементов в обеих суставных поверхностях. Выводы. Результаты исследований подтвердили, что нарушенная механика движений плечевого сустава является одним из монопатогенетичних факторов остеоартроза.
Deforming osteoarthritis of the shoulder joint — current and underinvestigated problem. One of the main factors in the development of arthrosis is a traumatic injury of the joint capsular ligaments, violation of joint mobility and inflammation. At the same time, the place of abnormal biomechanics remains unknown in the development of osteoarthritis of the shoulder joint as a monofactor of pathological condition. Objective: to investigate the role of limited biomechanics of the shoulder joint as a monopatogenetic factor in the development of osteoarthritis of the shoulder joint. Materials and methods. In the experiment, the model of osteoarthritis has been reproduced in guinea pigs, and the structural changes in the joint were investigated 3 months after. Cryosections were obtained from the decalcinated shoulder samples, histological and morphometric study was performed. Results and discussion. The structural damages of the articular surface of the humeral head and shoulder blade cavity were detected, as well as changes in the contour of the subchondral bone tissue, proliferative changes in the joint capsule. Disturbed mobility and altered zone of load caused the loss of 48 % (p < 0.01) of cartilage thickness in humeral articular surface and 14 % of the glenoid (p < 0.01). That is, a significant limitation of mobi-lity (biomechanics) of the shoulder joint leads to dystrophic changes of cartilage elements in both articular surfaces. Conclusions. Research results confirmed that impaired biomechanics of the shoulder joint movements is one of the monopatogenetic factors of osteoarthrosis.
остеоартроз, плечовий суглоб, структурні зміни.
остеоартроз, плечевой сустав, структурные изменения.
osteoarthritis, shoulder joint, structural changes.
Статтю опубліковано на с. 50-54
Вступ
Матеріали та методи
/51.jpg)
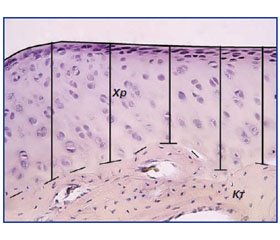
Результати та обговорення
/53.jpg)
Висновки
1. Sagittal alignment of the spine-pelvis-lower extremity axis in patients with severe knee osteoarthritis: A radiographic study / W.J. Wang, F. Liu, Y.W. Zhu [et al.] // Bone Joint Res. — 2016. — Vol. 5(5). — P. 198-205.
2. Prieto-Alhambra D. Incidence and risk factors for clinically diagnosed knee, hip and hand osteoarthritis: influences of age, gender and osteoarthritis affecting other joints / D. Prieto-Alhambra, A. Judge, M.K. Javaid // Ann. Rheum. Dis. — 2014. — Vol. 73(9). — P. 1659-1664.
3. Evaluation of cartilage degeneration in a rat model of rotator cuff tear arthropathy / E.J. Kramer, B.M. Bodendorfer, D. Laron [et al.] // J. Shoulder Elbow Surg. — 2013. — Vol. 22(12). — P. 1702-1709.
4. Birrell F. Osteoarthritis: pathogenesis and prospects for treatment / F. Birrell, N. Howells, M. Porcheret // Reports on the Rheumatic Diseases, Series 6 (Autumn 2011) Topical Reviews № 10. — P. 1-12.
5. Disruption of the anterior-posterior rotator cuff force balance alters joint function and leads to joint damage in a rat mo-del / K.E. Reuther, S.J. Thomas, J.J. Tucker [et al.] // J. Orthop. Res. — 2014. — Vol. 32(5). — P. 638-644.
6. Katz J.D. Getting to the heart of the matter: osteoarthritis takes its place as part of the metabolic syndrome / J.D. Katz, S. Agrawal, M. Velasquez // Curr. Opin. Rheumatol. — 2010. — Vol. 22(5). — P. 512-519.
7. Van den Berg W.B. Lessons from animal models of osteoarthritis / W.B. van den Berg // Curr. Rheumatol. Rep. — 2008. — Vol. 10(1). — P. 26-29.
8. Glenoid cartilage mechanical properties decrease after rotator cuff tears in a rat model / K.E. Reuther, J.J. Sarver, S.M. Schultz [et al.] // J. Orthop. Res. — 2012. — Vol. 30(9). — P. 1435-1439.
9. Loeser R.F. Age-Related Changes in the Musculoskeletal System and the Development of Osteoarthritis / R.F. Loeser // Clin. Geriatr. Med. — 2010. — Vol. 26(3). — P. 371-386.
10. Correlation between rotator cuff tear and glenohumeral degeneration / H.C. Hsu, Z.P. Luo, J.J. Stone [et al.] // Acta Orthop Scand. — 2003. — Vol. 74(1). — P. 89-94.

/51_2.jpg)
/52.jpg)