Статья опубликована на с. 63-66
Актуальность работы
По результатам обследования, проведенного совместно с сотрудниками ЦНИИС в различных климатогеографических зонах Кыргызской Республики по методу, разработанному Всемирной организацией здравоохранения (ВОЗ), распространенность заболеваний пародонта в 1988 году достигала 99 % [7]. Результаты исследований отечественных авторов показали, что особенно часто болезни пародонта встречаются у сельского населения — 88,6–94,1 % [8]. В последнее время наблюдается тенденция к росту обращаемости пациентов с заболеваниями пародонта за стоматологической помощью. По данным ВОЗ, более 80 % населения нашей планеты подвержено заболеваниям тканей пародонта, приводящим к потере зубов, появлению очагов хронической инфекции, снижению реактивности организма, микробной сенсибилизации, развитию аллергических состояний и других системных расстройств [9]. Исследования показали, что гингивит встречается у 50–90 % взрослого населения [10, 14]. В эпидемиологическом исследовании, проведенном в Москве (Российская Федерация), продемонстрировано, что распространенность заболеваний пародонта достигает 95 % [2, 13]. В России до 50 % лиц, достигших 30-летнего возраста, можно отнести к группе риска в аспекте подверженности заболеваниям пародонта, а после 40 лет эти показатели вырастают до 80–90 % [5, 6].
Воспалительные заболевания слизистой оболочки полости рта (стоматиты, гингивиты, пародонтиты) имеют широкое распространение, отмечается и тенденция к возрастанию их частоты. Рецидивирующий афтозный стоматит поражает до 20 % населения, особенно школьников и подростков [2, 11, 12]. Авторы отмечают тенденцию к увеличению распространенности хронических форм заболеваний слизистой оболочки полости рта, особенно хронического рецидивирующего афтозного стоматита (ХРАС) [2, 10, 13].
Трудность лечения воспалительных заболеваний слизистой оболочки полости рта заключается в многообразии этиопатогенеза, сложностях диагностики различных сопутствующих заболеваний и иммунокоррекции этих детей. В последнее время появились новые препараты, такие как Лизак (Lizak). Этот препарат ранее применялся лор-врачами при исследовании и лечении различных форм тонзиллофарингита.
Цель работы. На основе анализа динамики продуктов перекисного окисления липидов и системы антиоксидантной защиты (ПОЛ-АОЗ) провести изучение результатов применения нового препарата Лизак при лечении воспалительных заболеваний слизистой оболочки полости рта у детей.
Материалы и методы исследования
Под нашим наблюдением находилось 27 пациентов с воспалительными заболеваниями слизистой оболочки полости рта: ХРАС — 15 чел. и гингивитами — 12 детей. Их возраст колебался в пределах 5–12 лет. Комплекс традиционного местного лечения включал препараты, стимулирующие эпителизацию, проведение профессиональной гигиены полости рта при гингивитах, симптоматическое лечение, направленное на обезболивание, антисептическое воздействие. Подходы к лечению обусловлены уровнем научных наработок в области этиологии и патогенеза данного состояния. Забор ротовой жидкости для биохимического исследования проводился в одно и то же время, без стимуляции в течение 10 минут. Образцы собирались в охлажденные силиконированные пробирки, с внутренней обработкой для стабилизации ферментов. Определение продуктов ПОЛ-АОЗ проводилось спектрофотометрическим методом [3, 4].
Результаты исследования и обсуждение
Лизак — комплексный препарат для местного применения, обладающий выраженной антисептической, фунгицидной и антибактериальной активностью. Содержит два активных компонента — лизоцим и деквалиния хлорид, которые взаимно дополняют и усиливают действие друг друга. Механизм действия и терапевтические эффекты препарата Лизак обусловлены фармакологическими свойствами активных компонентов, входящих в его состав.
Деквалиния хлорид — местный антисептик, активный в отношении грамположительных и грамотрицательных бактерий, а также грибов (в том числе грибов рода Candida). Механизм действия деквалиния хлорида обусловлен его способностью денатурировать белки и ферменты микроорганизмов, нарушать синтез белка, а также разрушать клеточную оболочку бактерий. Лизоцим — активное вещество, по химической структуре относится к мукополисахаридам. Лизоцим обладает выраженной активностью в отношении вирусов, грибов, грамположительных и грамотрицательных бактерий. Помимо противомикробного действия, лизоцим оказывает и некоторый противовоспалительный эффект, а также способствует повышению местного иммунитета. Активные компоненты препарата Лизак практически не абсорбируются в системный кровоток и не оказывают системного действия.
В патогенезе воспалительных процессов основную роль играет активация медиаторов воспаления. Расширенная трактовка понятия «медиатор воспаления» позволяет включать в него различные компоненты, в частности компоненты межклеточного матрикса, гуморальные медиаторы (преимущественно пептидной природы), клеточные элементы (простагландины, интерлейкины (ИЛ)), продукты свободнорадикального перекисного окисления. Поскольку большинство медиаторов многофункциональны, попытки классифицировать их по эффектам вряд ли плодотворны. Наиболее непротиворечивой представляется химическая классификация медиаторов по их строению (низкомолекулярные, кислородсодержащие радикалы, пептидные, липидные, полисахаридные, биогенные амины).
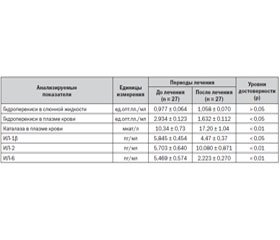
Исходя из задач настоящего исследования, нам представляется более важным освещение динамики свободнорадикальных перекисных окислительных процессов, цитокинов и некоторых аспектов антиоксидантной защиты в процессе лечения и по его окончании. Результаты определения вышеуказанных показателей приведены в табл. 1.
Как видно из данных табл. 1, со стороны содержания продуктов гидроперекисей липидов (ГПЛ) в слюнной жидкости значимой динамики по окончании лечения не наблюдается (р > 0,05). Содержание ГПЛ в плазме крови в период завершения терапии достоверно снижается (р < 0,05) по сравнению с таковым до лечения.
При этом активность одного из ключевых ферментов АОЗ — каталазы существенно повышается (р < 0,01). В этот период происходит снижение концентрации некоторых цитокинов, а именно ИЛ-1β (р < 0,05) и ИЛ-6 (р < 0,01). Следовательно, проведенное лечение приводит к ингибированию процессов липопереокисления и активности цитокиновой системы в результате повышения активности ферментной АОЗ, так как каталаза увеличивает активность реакции, которая предотвращает накопление перекиси водорода, образующейся при дисмутации супероксидного аниона и аэробном окислении восстановленных флавопротеидов. Следует отметить, что каталаза относится к ферментам, которые наиболее длительно сохраняют свою высокую активность и почти не требуют энергии активации.
Снижение концентрации противовоспалительных цитокинов (ИЛ-1β, ИЛ-6) также свидетельствует об эффективности проведенного лечения. Одним из механизмов этого является достижение ремиссии вследствие повышения возможностей фагоцитарной системы, а также эндотоксиновой толерантности моноцитов. Соответственно этому происходит уменьшение высвобождения медиаторов — производных липидов, простагландина Е2, тромбоксанов и фактора активации тромбоцитов. Снижению концентрации противовоспалительных интерлейкинов также способствует почти двукратное повышение активности ИЛ-2, являющегося важнейшим медиатором иммунитета (особенно клеточного), который оказывает преимущественно положительное влияние на гемопоэз и представляет собой фактор роста и дифференцировки Т-лимфоцитов и естественных киллеров, в меньшей степени — В-лимфоцитов. А его способность увеличивать цитолитическую активность лимфокинактивированных киллеров, обладающих высокой противоопухолевой активностью, используется в клинической практике при лечении рака.
Выводы
Таким образом, в исследованиях показано, что проведенное лечение приводит к снижению токсического действия перекисных радикалов, которые, являясь интермедиаторами клеточного метаболизма и необходимыми промежуточными продуктами при биосинтезе простагландинов, прогестерона, обеспечивают необходимый уровень протекания метаболических процессов, но в повышенной концентрации ведут к нарушениям мембранных структур клеток вследствие угнетения энергетических процессов и разобщения окислительного фосфорилирования. Токсическое действие в большом количестве перекисных продуктов может выражаться в следующих явлениях: инактивации сульфгидрильных групп в крови; активации фосфолипаз; разобщении окислительного фосфорилирования; деформации митохондрий; активации аутолитических процессов; нарушении целостности биологических мембран.
Следовательно, изучение процессов ПОЛ, системы АОЗ, цитокинов при патологических процессах обоснованно является важным этапом в рассмотрении этиопатологических аспектов заболевания и формировании симптомокомплекса, а также может быть дополнительным критерием эффективности проводимой терапии.
Список литературы
1. Буряк В.Н., Пошехонова Ю.В., Шабан Н.И. Оптимизация тактики ведения детей, страдающих хроническим тонзиллитом [Текст] / В.Н. Буряк, Ю.В. Пошехонова, Н.И. Шабан // Здоровье Украины. — 2011. — № 2(17). — С. 26-27.
2. Виноградова Т.Ф. [Текст] // Стоматология детского возраста. — М.: Медицина, 1989. — 350 с.
3. Гаврилов В.Б., Мишкорудная М.И. Спектрофотометрическое определение содержания гидроперекисей липидов в плазме крови [Текст] / В.Б. Гаврилов, М.И. Мишкорудная // Лабораторное дело. — 1983. — № 3. — С. 33-36.
4. Коробейникова Э.Н. Модификация определения продуктов перекисного окисления липидов в реакции с тиобарбитуровой кислотой [Текст] / Э.Н. Коробейникова // Лаб. дело. — 1989. — № 7. — С. 8-9.
5. Клініко-імунологічне обґрунтування диференційованого підходу до лікування хронічного генералізованого катарального гінгівіту в дітей [Текст] / П.І. Ткаченко, Н.М. Лохматова, В.І. Шинкевич, І.П. Кайдашев // Вісник стоматології. — 2004. — № 3. — С. 82-87.
6. Пухлик М.С., Тагунова И.К., Андреев А.В. Оценка эффективности применения препарата Лизак при тонзиллофарингитах [Текст] // Здоровье Украины. — 2012. — № 4. — С. 1-2.
7. Рассолова М.В., Кубрушко Т.В., Сабуров Б.А. Значение эпидемиологических исследований в профилактике кариеса зубов и болезней пародонта у подростков [Текст] / М.В. Рассолова, Т.В. Кубрушко, Б.А. Сабуров // Актуальные вопросы стоматологии (Тезисы 5-й научно-практической конференции стоматологов). — Фрунзе, 1988. — С. 93-95.
8. Соловьева A.M., Матело С.К., Тотолян А.А. и др. Эпидемиологическое исследование распространенности периодонтопатогенной микрофлоры полости рта у населения России [Текст] / A.M. Соловьева, С.К. Матело, А.А. Тотолян // Стоматологическое обозрение. — 2005. — № 2. — С. 1-5.
9. Эпидемиология, этиология, профилактика болезней периодонта: докл. науч. группы ВОЗ // Сер. технич. докл. 621, ВОЗ. — Женева, 1980. — 51 с.
10. Albandar J.M., Kingman A. Gingival recession, gingival bleeding, and dental calculus in adults 30 years of age and older in the United States, 1988–1994 // Journal of Periodontology. — 1999. — 70(1). — 30-43.
11. A Randomized, Double-blind, Placebo-Controlled Trial of Pentoxifylline for the Treatment of Recurrent Aphthous Stomatitis / M.H. Thornhill, L. Baccaglini, E. Theaker, M.N. Pemberton // Arch. Dermatol. — 2007. — Vol. 143, № 4. — P. 463-470.
12. Brailo V., Boras V.V., Cekic-Arambasin A. Recurrent aphthous ulcerations: analysis of predisposing factors in 68 patients // Lijec. Vjesn. — 2007. — Vol. 129, № 1–2. — P. 4-7.
13. Micheelis W., Schiffner U., Hrsg. Dritte Mundgesundheitsstudie (DSM IV). — Koln: Institut der Deutschen Zahnarzte, 2006.
14. Office for National Statistics (2000). Adult dental health survey: oral health in the United Kingdon, 1998. The proportion of suppressor-inducer T-lymphocytes is reduced in recurrent aphthous stomatitis / N.W. Savage, R. Mahanonda, G.J. Seymour et al. // J. Oral Pathol. — 1988. — Vol. 17. — P. 293-297.

/64.jpg)