Статья опубликована на с. 32-38
Введение
Высокая распространенность аллергических заболеваний у детей, не имеющая тенденции к снижению, является предметом постоянных серьезных дискуссий на протяжении последних десятилетий, что объясняется недостаточно эффективными методами лечения, особенно применяющимися в повседневной педиатрической практике. Согласно официальным данным, в Украине наблюдается не только неуклонный рост заболеваемости аллергическими заболеваниями детей, но и «омоложение» аллергопатологии, от которой страдает каждый четвертый-пятый ребенок страны [5].
Среди аллергических заболеваний большую часть составляют аллергические поражения кожи. Первое место в структуре аллергодерматозов у детей занимает атопический дерматит (АД), который представляет собой генетически детерминированное хроническое воспалительное иммунопатологическое заболевание кожи (чаще на основе IgE-зависимых механизмов), характеризующееся зудом, рецидивирующим стадийным течением с соответствующими возрастными клинико-морфологическими особенностями и типичным началом заболевания в раннем детском возрасте. Для АД характерны клинический полиморфизм симптоматики, склонность к хронизации процесса с четко выраженным волнообразным течением, неполная ремиссия различной частоты и длительности, а также мультифакториальность заболевания. В этиопатогенезе АД переплетены такие триггеры, как пищевая аллергия, стрессиндуцирующие моменты, изменения со стороны микробиома, изменения микроэкологии окружающей среды и анатомо-физиологические предрасполагающие особенности детского организма [8, 9, 11].
АД занимает доминирующее место в структуре кожной патологии детского возраста (от 20 до 50 % больных дерматозами детей), что определяет интерес педиатров и семейных врачей к вопросам повышения эффективности терапии данного заболевания. Кроме того, для аллергической патологии вообще и для АД в частности характерной особенностью является развитие сопутствующих патологических изменений во многих органах и системах, что определяет заинтересованность в своевременной адекватной коррекции данной патологии не только врачей-аллергологов, но и специалистов смежных, так называемых узких специальностей — отоларингологов, офтальмологов, эндокринологов и пр. [3, 4, 6].
Одним из наиболее задействованных в комплексном лечении АД специалистов является детский гастроэнтеролог. Не секрет, что нередко кожные проявления и их тяжесть тесно взаимосвязаны с патологией желудочно-кишечного тракта (ЖКТ), те или иные симптомы поражения которого встречаются у 52 % больных АД [17]. Известно, что поверхность тонкого кишечника контактирует с поступающими извне чужеродными веществами в 10 раз больше, чем дыхательный эпителий, и в 300 раз больше, чем кожа. В физиологических условиях в системе пищеварения существует ряд барьеров, представленных анатомическими, физиологическими и иммунологическими факторами, которые препятствуют проникновению пищевых антигенов во внутренние среды организма, где они индуцируют иммунный ответ. С учетом возрастных анатомо-физиологических особенностей ЖКТ несостоятельность указанных барьеров чаще проявляется именно в детском возрасте [8].
Функциональные нарушения органов пищеварения приводят к всасыванию неполноценно расщепленных компонентов пищи, особенно белков, и тем самым способствуют сенсибилизации организма к различным видам аллергенов. Массивному поступлению антигенов из кишечника способствует снижение функциональной активности поджелудочной железы (ПЖ) [15, 16]. Кроме этого, попадая в организм предрасположенного к аллергии ребенка, аллергены вызывают каскад иммунологических и биохимических процессов, приводящих к циркуляции в крови повышенного количества ряда биологически активных веществ (гистамин, серотонин, ацетилхолин, гепарин и др.), большинство из которых нарушают кровообращение в самых разных органах. Одним из таких органов, который страдает практически при любом аллергическом процессе, является ПЖ [17].
В практической работе врача-педиатра, к сожалению, лечение АД часто сводится только к назначению местной и медикаментозной терапии, направленной на подавление гистамина, и не уделяется должного внимания лечению сопутствующей патологии ЖКТ. Большое значение в лечении аллергических заболеваний кожи имеет коррекция вторичной внешнесекреторной панкреатической недостаточности (ПН) [12, 15, 17, 20].
Клинические проявления ПН у детей характеризуются болью в животе, изменением аппетита (уменьшение или полное исчезновение), тошнотой, отрыжкой воздухом, урчанием в животе, метеоризмом, флатуленцией, неустойчивым стулом. Интенсивность и выраженность этих признаков зависят от степени поражения ПЖ.
Для выявления нарушенной экзокринной функции ПЖ применяют прямые и непрямые методы обследования. К первым относятся методы, основанные на непосредственном определении активности ферментов в дуоденальном содержимом, а ко вторым — на оценке степени расщепления ферментами ПЖ тех или иных субстратов в ЖКТ. Прямые методы, требующие проведения дуоденального зондирования, не используются в педиатрии в связи с длительностью исследования, инвазивностью и неоднозначностью интерпретации результатов. Непрямые методы менее точны, но более доступны для повседневного применения.
Копрологическое исследование до сих пор не утратило своего значения и благодаря своей неинвазивности и доступности является наиболее распространенным методом определения ПН. Повышение содержания нейтрального жира указывает на нарушение липолитической функции ПЖ, увеличение мышечных волокон — на нарушение протеолитических процессов, повышенное содержание крахмала — на нарушение функции амилаз (в первую очередь панкреатической, хотя на переваривание крахмала влияет и амилаза слюны). Копрограмма при аккуратном и грамотном проведении является достаточно информативным исследованием, в большинстве случаев вполне достаточным для первичной дифференциальной диагностики и мониторинга состояния больного. Более точным, но и более сложным и дорогостоящим непрямым методом является липидограмма кала [1, 4, 6].
Золотым стандартом диагностики ПН в настоящее время является определение в кале панкреатической эластазы-1, которая в неизмененном виде достигает дистальных отделов кишечника. Нормой считаются значения эластазы-1 в кале выше 200 мкг/мл кала. Более низкие значения указывают на ПН. Важно, что на результаты теста не влияют ни характер питания пациента, ни прием препаратов панкреатических ферментов [7, 21, 23]. Однако снижение фекальной эластазы-1 четко определяется лишь при тяжелой и среднетяжелой ПН, которая редко встречается в детском возрасте. Поэтому этот метод не исключает из практики косвенные методы исследования экзокринной панкреатической функции (копрограмма или, предпочтительнее, липидограмма кала), так как лишь они позволяют оценить адекватность заместительной терапии, подобрать дозу препарата [6, 7].
Наиболее информативным из доступных инструментальных методов диагностики заболеваний ПЖ в детском возрасте является эхосонография как неинвазивный метод исследования. Традиционно считается, что косвенно о наличии хронического воспалительного процесса свидетельствуют изменения размера поджелудочной железы (увеличение), эхоструктуры (чередование гипер- и гипоэхогенных участков), контуров и формы железы, расширение основного панкреатического протока, наличие кальцинатов. Однако следует помнить, что стандартный ультразвуковой метод не имеет высокой информативности, поскольку и изменения эхогенности органа, и увеличение его размеров свидетельствуют прежде всего в пользу реактивного панкреатита или диспанкреатизма (панкреатопатия) и необязательно являются маркером выраженного воспаления. Кроме того, даже наличие подтвержденного диагноза панкреатита, не говоря уже о реактивном панкреатите и диспанкреатизме, не свидетельствует о сопутствующих явлениях внешнесекреторной ПН, хотя вероятность таковой достаточно велика.
Гораздо большей информативностью обладают новые доступные методики ультразвукового исследования, такие как метод постпрандиальной ультразвуковой оценки ПЖ, метод количественного определения показателей объемного кровотока по верхней брыжеечной артерии до и после пищевой нагрузки [2]. На кафедре педиатрической гастроэнтерологии и нутрициологии ХМАПО оценку постпрандиальной гиперемии проводят по методу С.И. Поляковой и соавт. (в нашей модификации пробный физиологический «панкреатический» завтрак рассчитывают с учетом потребности ребенка в основных ингредиентах и количестве калорий в разные возрастные периоды и содержания этих веществ в продуктах). Согласно этому методу у детей в утренние часы натощак определяют положение, контур, структуру, эхогенность, наличие патологических включений, состояние главного панкреатического протока ПЖ, измеряют линейные размеры поджелудочной железы пре- и постпрандиально (через 90 мин после приема пробного завтрака). Увеличение (уменьшение) размера меньше чем на 5 % расценивают как признак хронического панкреатита, на 5–15 % — как реактивные изменения ПЖ, более чем на 15 % — как нормальную постпрандиальную реакцию.
С современных позиций эффективное лечение ПН, в основе которой лежит снижение секреции панкреатических ферментов или их инактивация под воздействием различных эндогенных факторов, требует проведения заместительной терапии ферментными препаратами (ФП). Для обеспечения нормального процесса пищеварения необходимо создать в двенадцатиперстной кишке такое содержание ферментов, которое составляет 5–10 % от выделяющихся при максимальной стимуляции ПЖ у здоровых. Активность ФП оценивают по активности липазы в стандартных международных единицах — Ед. FIP (Federation International Pharmaceutical Unit) или в единицах Европейской фармакопеи — Ед. Ph.Eur. (Pharmacopea of Europe). Липазная активность 1 мг сухого панкреатина колеблется от 17 до 40 и выше Ед. FIP.
Следует отметить, что для коррекции симптомов ПН у детей с АД необходим дифференцированный подход при назначении ФП: воздержаться от применения препаратов, содержащих желчь и гемицеллюлозу и отдать предпочтение чистым панкреатическим энзимам, которые должны соответствовать следующим международным требованиям: отсутствие токсичности и побочных явлений; хорошая переносимость; оптимум действия в интервале рН 5–7; устойчивость к соляной кислоте, пепсину и другим протеазам; достаточное содержание активных пищеварительных ферментов; одновременный пассаж с химусом через привратник — размер таблеток или гранул не должен превышать 2 мм. К препаратам, которые применяются в детском возрасте, должны предъявляться еще дополнительные требования: удобство точного дозирования препарата в зависимости от массы тела и возраста [4, 10, 18].
Перечисленным выше требованиям соответствует натуральный полиферментный препарат Эрмиталь 10 000 производства немецкой фармацевтической компании «Нордмарк Арцнаймиттель ГмбХ и Ко.КГ». Препарат содержит панкреатин из ПЖ свиней в форме покрытых кишечно-растворимой оболочкой (устойчивой в кислой среде) микротаблеток в желатиновых капсулах. Одна капсула Эрмиталь 10 000 содержит 87,28–112,96 мг панкреатина. Активность данного количества панкреатина соответствует следующему содержанию ферментов: липазы — 10 тыс. ЕД, протеаз — 500 ЕД, амилазы — 9 тыс. Каждая капсула препарата содержит микротаблетки с диаметром 1,7 мм, которые покрыты кислотоустойчивой оболочкой, что позволяет не глотать капсулу целиком, а принимать непосредственно микротаблетки, что очень важно в детском возрасте. Следует особо подчеркнуть, что в Эрмитале 10 000 фиксированное количество микротаблеток в капсуле с одинаковым количеством активных компонентов в каждой (450–500 ЕД липазы), что позволяет его рационально дозировать с подсчетом дозы на килограмм массы тела ребенка: 2 микротаблетки на 1 кг массы тела в сутки, разделить на количество кормлений. Капсулы быстро растворяются в желудке, высвобождая микротаблетки по мультидозовому принципу, что обеспечивает хорошее перемешивание с содержимым желудка, транспортировку из желудка вместе с его содержимым и после высвобождения — достаточное распределение ферментов внутри содержимого кишечника. Когда микротаблетки попадают в тонкий кишечник, оболочка быстро растворяется (при рН > 5,5), высвобождая ферменты с липолитической, амилолитической и протеолитической активностью, что обеспечивает расщепление жиров, углеводов и белков. Продукты панкреатического пищеварения после этого всасываются или сразу, или после дальнейшего гидролиза кишечными ферментами.
Подбор адекватной дозы ферментов является едва ли не самым важным фактором успеха терапии. Он проводится по количеству содержащейся в препарате липазы — ключевого фермента, расщепляющего нейтральные жиры. Это обусловлено тем, что переваривание жиров (в отличие от белков и углеводов) не может быть в достаточной степени компенсировано внепанкреатической липазой. Дозирование препарата основано на индивидуальной потребности больного и зависит от степени нарушения пищеварения и состава пищи, составляя в среднем 1000 ЕД липазы на 1 кг массы тела ребенка в сутки. Капсулы и микротаблетки следует глотать целиком, не разламывая и не разжевывая, и запивать достаточным количеством жидкости. Если ребенок не может проглотить целую капсулу, ее можно раскрыть и добавить микротаблетки к жидкой пище, не требующей разжевывания.
Целью нашего исследования была оценка эффективности микротаблетированного ферментного препарата Эрмиталь 10 000 в коррекции ПН у детей с АД.
Критериями включения больных в исследование были: возраст от 3 до 6 лет; установленный диагноз АД и ПН; информированное согласие родителей пациента на участие в исследовании; способность ребенка к адекватному сотрудничеству в процессе исследования.
Критериями исключения были: гиперчувствительность к ферментным препаратам в анамнезе; наличие в процессе проведения исследования острых заболеваний, способных существенно повлиять на его результаты; участие в любом другом клиническом исследовании.
Материалы и методы исследования
Было обследовано 36 детей в возрасте от 3 до 6 лет с ПН, на фоне которой отмечались кожные синдромы в виде АД. Аллергические поражения кожи характеризовались полиморфными высыпаниями в виде эритемы, папулезно-макулезных элементов, лихеноидных папул, сопровождающихся зудом и расчесами. Кроме клинического обследования, проводились исследование уровней IgE, амилазы в сыворотке крови и моче, копрограмма (до и после окончания наблюдения) и ультразвуковое сканирование органов брюшной полости по методу С.И. Поляковой. Наряду с терапией АД все наблюдаемые дети для коррекции внешнесекреторной недостаточности ПЖ получали полиферментный препарат Эрмиталь 10 000, суточная доза которого рассчитывалась по липазе (1000 ЕД липазы на 1 кг массы тела ребенка), т.е. 2 микротаблетки на 1 кг массы тела в сутки, разделить на количество кормлений. Препарат применялся в каждый прием пищи (3–4 раза в сутки) в течение 2 недель. Критериями адекватного дозирования и длительности назначения препарата на фоне подбора индивидуальной диеты служили нормализация частоты и характера стула, отсутствие нейтрального жира в копрограмме и нормализация других ее показателей, улучшение аппетита, ликвидация диспептического и болевого синдромов.
Эффективность ферментотерапии Эрмиталем 10 000 изучали на основании оценки выраженности основных клинических симптомов нарушения пищеварения (боли в животе, сниженный аппетит, метеоризм, нарушения стула, тошнота) и результатов копрологического исследования.
Обработка числовых данных осуществлялась общепринятыми в медицинской статистике математическими методами: вычисляли показатели средних величин (М) и ошибку средних (m) исследуемых показателей.
Результаты исследования
Группу нашего исследования составили 36 пациентов (19 (52,7 %) мальчиков и 17 (47,2 %) девочек) в возрасте от 3 до 6 лет. По длительности заболевания наблюдаемые дети распределены следующим образом: 6 мес. — 1 год — 2 ребенка, 1–3 года — 15 детей, более 3 лет — 19 детей.
Все дети поступали в стационар в периоде неполной ремиссии АД, с установленным ранее диагнозом: эритематозно-сквамозная форма выявлена в 6 (16,7 %) случаях, эритематозно-сквамозная с лихенификацией — в 19 (52,70 %), лихеноидная — в 11 (30,6 %). Патологический процесс носил ограниченный характер у 28 (77,8 %), распространенный — у 7 (19,4 %), диффузный — у 1 (2,8 %) пациента. В группе достоверно преобладала средняя тяжесть течения АД; рецидивы 3–4 раза в течение года отмечали 29 (80,5 %) детей. Легкое течение зарегистрировано у 5 больных, тяжелое — у 2 (13,9 и 5,6 % соответственно). При сборе анамнеза стало известно, что частые рецидивы заболевания связаны с наличием очагов инфекции, гастроинтестинальными проявлениями и несоблюдением гипоаллергенной диеты. У всех больных при поступлении отмечалось повышение уровня общего сывороточного IgE в среднем до 147,5 %.
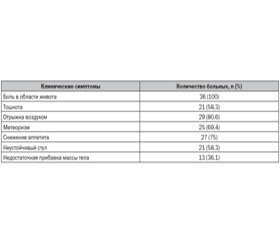
Среди всех гастроэнтерологических жалоб мы выделили те, которые характерны для ПН: боль в левом подреберье разной степени интенсивности, возникающую после погрешностей в питании, тошноту, отрыжку воздухом, метеоризм, снижение аппетита, учащенный стул с примесью непереваренных остатков пищи, недостаточную прибавку массы тела (табл. 1).
При объективном обследовании у всех 36 пациентов (100 %) пальпаторно отмечалась болезненность в точках проекции поджелудочной железы (Мейо-Робсона, Кача, Кертэ).
При лабораторном обследовании у 15 (41,6 %) больных незначительно был повышен уровень амилазы крови, уровень амилазы мочи оставался в пределах допустимых значений, что объясняется отсутствием синдрома «уклонения» ферментов и свидетельствует о функциональных изменениях в ПЖ обследованных детей. При копрологическом исследовании стеаторея 1-го типа (наличие в кале нейтрального жира) была выявлена у 34 (94,4 %) детей, креаторея — у 7 (19,4 %), непереваренная клетчатка — у 30 (83,3 %), амилорея — у 31 (86,1 %).
При ультразвуковом исследовании натощак только у 15 (41,6 %) детей отмечено незначительное увеличение размеров ПЖ за счет отека паренхимы (в основном хвоста), что подтверждает отсутствие структурной патологии ПЖ. При оценке постпрандиальной гиперемии у 24 (66,7 %) детей отмечалось увеличение размера ПЖ до 11,7 %, что расценивалось как реактивные изменения в органе.
После верификации клинического диагноза и назначения ферментного препарата Эрмиталь 10 000 клинические симптомы оценивали ежедневно, затем, после выписки из стационара, 1 раз в неделю (табл. 2), показатели копрологического исследования — на 7-е и 14-е сутки от начала лечения.
Как видно из данных табл. 2, выраженность абдоминального болевого синдрома у детей уменьшилась втрое уже через 7 дней после начала терапии, а после 14 дней он беспокоил только 2 детей (р < 0,01). Положительная динамика отмечалась и в уменьшении диспептических проявлений: метеоризм и неустойчивый стул уже через неделю после начала лечения достоверно снижались (р < 0,05) и к концу лечения исчезли практически у всех детей (р < 0,01).
Исчезновение нейтрального жира в копрологическом исследовании является маркером эффективности проводимой ферментной терапии. Следует отметить, что у наблюдаемых нами детей стеаторея исчезала у 20 (55,6 %) к концу 7-го дня после назначения Эрмиталя и через 2 недели была ликвидирована практически у всех больных, что свидетельствует об адекватно подобранной дозе ферментного препарата и его высокой активности.
На фоне комплексного лечения с включением Эрмиталя 10 000, параллельно с регрессией абдоминального, диспептического и копрологического синдромов, отмечалась положительная динамика кожных проявлений: уменьшились площадь поражения, гиперемия и инфильтрация, зуд. Значительное улучшение кожного синдрома наблюдалось у 68,7 % детей, умеренное улучшение — у 20,7 %, не ответили на терапию 10,6 % пациентов, что требует более тщательного поиска причин, поддерживающих патологический процесс.
Применение ферментного препарата Эрмиталь 10 000 у больных с АД способствовало исчезновению болевого и диспептического синдромов, улучшению лабораторных показателей функционального состояния ПЖ, уменьшению кожных проявлений АД. Препарат хорошо переносился больными, не вызывал побочных действий, поэтому может быть рекомендован в качестве средства для коррекции ПН у детей с АД.
Обсуждение
В свете современных представлений кожные проявления и их тяжесть при АД у детей тесно взаимосвязаны с внешнесекреторной недостаточностью ПЖ, в основе которой лежит снижение секреции панкреатических ферментов или их инактивация под воздействием различных эндогенных факторов [15, 17, 23].
Результаты нашего исследования показывают, что у 40 % больных незначительно был повышен уровень амилазы крови при нормальном уровне амилазы мочи. Это объясняется отсутствием синдрома «уклонения» ферментов и свидетельствует о функциональных изменениях в ПЖ обследованных детей. Изменения в копрограмме были выявлены практически у всех больных, что также подтверждает сочетанный характер поражения ПЖ при АД.
При ультразвуковом исследовании натощак и постпрандиально отмечено незначительное увеличение размеров ПЖ за счет отека паренхимы (в основном хвоста), что подтверждает отсутствие структурной патологии ПЖ. Ультразвуковые характеристики изменений ПЖ у обследованных детей показали, что клинические симптомы ПН проявляются значительно раньше, чем возникают структурные изменения железы.
В результате проведенного исследования были выявлены клинико-лабораторные маркеры относительной ПН у больных, что требовало назначения им ферментных препаратов. Многочисленные исследования показали высокую эффективность микротаблетированной ферментной терапии в лечении ПН у детей [3, 4, 6, 10, 11, 15, 17]. Эти препараты имеют высокий профиль безопасности, что позволяет их применять даже с периода новорожденности.
Наши результаты также показывают, что у большинства больных коррекция нарушений экзокринной функции ПЖ в определенной степени влияет на регрессию кожных проявлений. Но выяснение механизмов такого влияния требует проведения отдельных специальных исследований. Улучшения кожного синдрома после проведенной ферментной терапии не было отмечено у 10 % больных, что требует более тщательного поиска причин, поддерживающих патологический процесс.
Выводы
1. Препарат Эрмиталь 10 000 способствует положительной динамике ПН у детей за счет купирования диспептического и болевого синдромов и является эффективным средством в терапии ПН у детей с АД.
2. Эрмиталь хорошо переносится больными, не оказывает побочных действий и отличается от других ФП удобством применения: 2 микротаблетки на 1 кг массы тела в сутки, разделить на количество кормлений.
3. Для коррекции ПН у детей с АД необходим двухнедельный курс лечения Эрмиталем 10 000.
Список литературы
1. Белоусов Ю.В. Панкреатит и панкреатопатия: классификационные характеристики, принципы диагностики и лечения у детей // Здоровье ребенка. — 2012. — № 8(43). — С. 129-133.
2. Белоусова О.Ю., Карпушенко Ю.В. Структурно-функциональные изменения поджелудочной железы, обусловленные влиянием пищевой сенсибилизации // Здоров’я України. — 2013. — № 3(26). — С. 13-15.
3. Белоусова О.Ю. Заболевания поджелудочной железы у детей, сопровождающиеся развитием экзокринной недостаточности: тактика обследования и возможности коррекции // Сучасна гастроентерологія. — 2014. — № 3(77). — С. 51-58.
4. Белоусова О.Ю., Солодовниченко И.Г. Пангрол в коррекции панкреатической недостаточности у детей с функциональной диспепсией // Сучасна гастроентерологія. — 2013. — № 6(74). — С. 48-52.
5. Борисова Т.П. Подход к выбору антигистаминного препарата в лечении аллергических заболеваний и состояний в детской практике // Здоровье ребенка. — 2015. — № 8(68). — С. 33-37.
6. Гасилина Т.В. Болезни поджелудочной железы у детей. Первичная и вторичная экзокринная панкреатическая недостаточность / Т.В. Гасилина, С.В. Бельмер // Лечащий врач. — 2010. — № 6. — С. 6-10.
7. Губергриц Н.Б. Возможности лабораторной диагностики заболеваний поджелудочной железы // Экспериментальная и клиническая гастроэнтерология. — 2008. — № 7. — С. 93-101.
8. Детская аллергология: Руководство для врачей / Под ред. А.А. Баранова, И.И. Балаболкина. — М.: ГЭОТАР-Медиа, 2006. — 687 с.
9. Зайков С.В. Атопічний дерматит у дітей // Дитячий лікар. — 2010. — № 2. — С. 51-58.
10. Крючко Т.А., Несина И.Н., Ткаченко О.Я., Пода О.А. К вопросу коррекции внешнесекреторной недостаточности поджелудочной железы у детей с функциональными и органическими гастродуоденальными заболеваниями // Здоровье ребенка. — 2016. — № 2(70). — С. 60-64.
11. Ласица О.И. Атопический марш у детей: перспективы профилактики и прогноза // Клиническая иммунология, аллергология, инфектология. — 2005. — № 1(1). — С. 46-47.
12. Лимаренко М.П. Ферментопатия как причина кожных проявлений атопии у детей // Здоровье ребенка. — 2015. — № 2(62). — С. 93-96.
13. Нагорная Н.В., Лимаренко М.П. Внешнесекреторная функция поджелудочной железы и методы ее оценки // Здоровье ребенка. — 2012. — № 8(43). — С. 76-81.
14. Наказ МОЗ України № 59 від 29.01.2013 р. «Про затвердження уніфікованих клінічних протоколів медичної допомоги дітям із захворюваннями органів травлення». — К., 2013. — С. 143-158.
15. Охотникова Е.Н., Меллина К.В., Ткачева Т.Н., Волгина И.Е. Место ферментных препаратов в схемах лечения аллергических заболеваний кожи у детей // Современная педиатрия. — 2011. — № 6(40). — С. 177-182.
16. Охотнікова О.М., Бондаренко Л.В., Іванова Т.П. Гастроінтестинальні порушення у дітей з атопічним дерматитом // Современная педиатрия. — 2014. — № 8(64). — С. 104-109.
17. Панкреатические ферменты в комплексной терапии атопического дерматита у детей / Н.Л. Аряев, И.М. Шевченко, И.В. Кузьменко [и др.] // Современная педиатрия. — 2011. — № 5(39). — С. 200-203.
18. Шадрін О.Г., Марушко Т.Л., Радушинська Т.Ю. Недостатність травлення та шляхи його корекції у дітей раннього віку з харчовою непереносимістю // Здоров`я дитини. — 2016. — № 1(69). — С. 55-62.
19. Chauhan S. Pain management in chronic pancreatitis: A treatment algorithm / Chauhan S., Forsmark C.E. // Best Pract. Res. Clin. Gastroenterol. — 2010. — Vol. 24, № 3. — Р. 323-335.
20. Fieker A. Enzyme replacement therapy for pancreatic insufficiency: present and future / A. Fieker, J. Philpott, M. Armand // Clinical and Experimental Gastroenterology. — 2011. — Vol. 4. — Р. 55-73.
21. Leeds J.S., Oppong K., Sanders D.S. The role of fecal elastase‑1 in detecting exocrine pancreatic disease // Nat. Rev. Gastroenterol. Hepatol. — 2011. — Vol. 8, № 7. — P. 405-415.
22. Siegmund E. The diagnostic validity of non-invasive pancreatic function tests — a meta-analysis / Siegmund E., Lohr J.M., Schuff-Werner P. // Z. Gastroenterol. — 2004. — Vol. 42, № 10. — Р. 1117-1128.
23. Wali P.D. Comparison of fecal elastase‑1 and pancreatic function testing in children / Wali P.D., Loveridge-Lenza B., He Z. et al. // J. Pediatr. Gastroenterol. Nutr. — 2012. — Vol. 54, № 2. — P. 277-280.

/36.jpg)
/37.jpg)