Статья опубликована на с. 83-85
Введение
Тяжелые неврологические заболевания, такие как врожденные пороки развития (ВПР) головного мозга и детский церебральный паралич (ДЦП), по-прежнему играют ведущую роль в формировании детской инвалидности и во многом определяют высокие показатели детской смертности [1–4].
При этих заболеваниях наблюдаются не только поражения опорно-двигательного аппарата различной степени тяжести, психические и интеллектуальные нарушения, но несерьезные морфофункциональные изменения в работе внутренних органов и систем организма. Физическое развитие детей с ВПР нервной системы и ДЦП, как правило, характеризуется значительным дефицитом массы тела, развитием прогрессирующей церебральной кахексии или вторичной дистрофии смешанного, нейрогенно-алиментарного генеза [4].
При белково-энергетической недостаточности (БЭН) III степени наблюдается катаболическая направленность обмена веществ, которая приводит к быстрому истощению пластических и энергетических ресурсов организма, развитию дистрофии внутренних органов и в конечном итоге — полиорганной недостаточности. Иммунный статус детей-инвалидов с крайней степенью БЭН характеризуется снижением антиинфекционной резистентности организма, преимущественно угнетением клеточного иммунитета на фоне повышения активности окислительного метаболизма в нейтрофилах [5]. Это обусловливает высокую респираторную заболеваемость таких больных с четкой тенденцией к затяжному течению воспалительного процесса.
Проблемы организации рационального питания детей с неврологической патологией обусловлены тяжестью состояния больных, резким ограничением двигательной активности и вынужденным положением в постели. ДЦП и врожденные пороки развития головного мозга часто сопровождаются псевдобульбарными расстройствами, в связи с чем возникают определенные сложности в кормлении таких пациентов. Нарушение глотания, хронический микроаспирационный синдром не позволяют обеспечить рациональное питание этих больных в соответствии с физиологическими потребностями организма привычным пероральным путем. В связи с этим одним из важных аспектов ухода за детьми с тяжелыми неврологическими заболеваниями является организация эффективного питания.
Многочисленные исследования доказали, что питание тяжелобольных детей с БЭН III степени должно быть направлено на нормализацию обменных процессов, восстановление утраченных структур органов и систем. От качества энергетического, белкового, водно-электролитного, витаминного обеспечения организма зависят эффективность лечения и прогноз заболевания. Тактика диетотерапии церебральной кахексии и БЭН III степени у детей с грубой неврологической патологией имеет свои особенности и в первую очередь должна быть направлена на обеспечение пациента достаточным количеством белка и энергии. Своевременная и адекватная нутритивная поддержка позволяет в значительной степени сократить частоту инфекционных осложнений, снизить риск развития синдрома полиорганной недостаточности и летальность больных, добиться повышения качества жизни пациентов и ускорить их реабилитацию [6–8].
Исследования последних лет продемонстрировали эффективность применения энтеральных питательных смесей и их позитивное влияние на метаболизм организма больного с различной острой и хронической патологией. Общими качествами современных препаратов для энтерального питания являются сбалансированное соотношение различных веществ с учетом суточной потребности больного в каждом из них, наличие в составе смесей белков с высокой биологической ценностью, оптимальным набором аминокислот, отсутствием лактозы, сахарозы, глютена и холестерина [8, 9].
Материалы и методы исследования
Исследование проводилось на базе инфекционного отделения детской клинической больницы № 2 г. Днепра. Под нашим наблюдением находилось 16 детей из дома инвалидов в возрасте от 4 до 11 лет с тяжелой неврологической патологией. Дети-инвалиды по основному неврологическому заболеванию неоднократно поступали в инфекционное отделение для лечения респираторных инфекций. Как правило, в этой группе детей заболевания имели склонность к затяжному течению, что приводило к их продолжительному пребыванию в стационаре. Нозологические формы неврологической патологии были представлены следующим образом: 7 детей с диагнозом «детский церебральный паралич с устойчивыми двигательными нарушениями, симптоматической эпилепсией» и 9 детей с диагнозом «врожденный порок развития головного мозга, микроцефалия, спастический тетрапарез, симптоматическая эпилепсия, грубое отставание в развитии высших корковых функций» (табл. 1).
/84.jpg)
Нутритивный статус детей характеризовался низким индексом трофики, снижением тургора мягких тканей, уменьшением толщины или отсутствием подкожно-жировой клетчатки, трофическими изменениями кожи и слизистых оболочек. Данные симптомы позволили диагностировать у этих детей с тяжелой неврологической патологией церебральную кахексию, белково-энергетическую недостаточность III степени смешанного, нейрогенно-алиментарного генеза.
Лабораторное обследование детей включало общие анализы крови, мочи, копрологическое исследование, биохимический анализ крови с оценкой протеинограммы.
Учитывая наличие псевдобульбарного синдрома, осложняющего кормление этих пациентов, в зависимости от тяжести состояния применяли метод зондового питания или комбинацию кормления с ложки и зондового питания. В качестве основного питания использовалась полуэлементная питательная смесь полный гидролизат, которая назначалась в полном или частичном суточном объеме с учетом физиологических потребностей детей по основным нутриентам и калориям. Полуэлементная смесь полный гидролизат имеет сбалансированный состав по белкам, жирам, углеводам, обеспечивает получение высокого калоража в малом объеме смеси, содержит необходимые для данной категории больных незаменимые жирные кислоты, аминокислоты, биологически активные вещества, витамины и микроэлементы. Эффективность энтерального питания оценивали по динамике весовой кривой, показателям протеинограммы, копрограммы.
Результаты исследования и их обсуждение
В результате клинического обследования детей-инвалидов с неврологической патологией в сочетании с комплексной оценкой их физического развития в 100 % случаев была подтверждена белково-энергетическая недостаточность III степени. При лабораторном исследовании у 43,7 % (n = 7) пациентов была выявлена гипопротеинемия, причем в 31,2 % случаев (n = 5) — в сочетании с диспротеинемией за счет гипоальбуминемии. По данным копрологического исследования, у 56,2 % (n = 9) больных отмечались косвенные признаки панкреатической недостаточности, мальдигестии и мальабсорбции в виде амилореи, стеатореи, повышенного количества непереваренной растительной клетчатки.
/85.jpg)
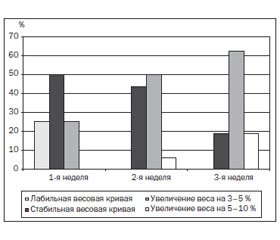
Применение полуэлементной смеси полный гидролизат в питании детей-инвалидов уже в течение первой недели обеспечило стабилизацию весовой кривой пациентов с вторичной дистрофией в 50 % случаев (n = 8) и увеличение массы на 3–5 % у 25 % больных (n = 4). На 2-й неделе кормления детей данной смесью мы отмечали устойчивое увеличение массы тела до 3–10 % у 56,2 % пациентов (n = 9), а на 3-й неделе — у 81,2 % пациентов (n = 13). Наблюдались улучшение нутритивного статуса детей этой группы, появление подкожно-жировой клетчатки, повышение тургора мягких тканей.
Нормализация протеинограммы отмечалась в 100 % случаев. Стабильной нормализации копрограммы мы не наблюдали, однако отмечали значительное снижение выраженности амилореи и стеатореи.
Выводы
1. Обеспечение адекватной нутритивной поддержки является важным и необходимым условием выхаживания детей-инвалидов с вторичной дистрофией на фоне тяжелой неврологической патологии.
2. Наиболее рациональным питанием с учетом повышенной потребности этих пациентов в белке и энергии, а также сложностей кормления этих больных является энтеральное питание с применением полуэлементных смесей.
3. Необходимо проведение постоянного контроля за весовой кривой и белковой обеспеченностью детей с вторичной дистрофией для своевременной коррекции питания.
4. Применение в питании детей-инвалидов с тяжелой неврологической патологией полуэлементной питательной смеси полный гидролизат способствует стабилизации весовой кривой с тенденцией к увеличению массы тела, что позволяет рекомендовать эту смесь в качестве основного питания детей с БЭН III степени.
Список литературы
1. Мартинюк В.Ю. Соціальна педiатрiя в Україні: концепцiя, завдання, перспективи / B.Ю. Мартинюк // Соціальна педiатрiя. — 2011. — № 1. — С. 17-23.
2. Ващенко Л.В., Равлинко А.А., Рубашная О.Ф. и др. Детская инвалидность и инвалидность с детства как медико-социальная проблема // Здоровый ребенок. — 2008. — № 2(11). — С. 34-36.
3. Коренев Н.М. Инвалидность детей с хроническими соматическими заболеваниями в Украине / Н.М. Коренев, С.Р. Толмачева, Л.Ф. Богмат // Здоровый ребенок. — 2009. — № 3(18). — С. 23-26.
4. Паламар І.В. Чинники дитячої інвалідності від хвороб нервової системи, що зумовлюють ії характером / І.В. Паламар // Вісник соц. гігієни та організації охорони здоров’я України. — 2004. — № 4. — С. 36-39.
5. Гипотрофия у детей как проявление хронической стрессовой реакции / Е.В. Неудахин, Т.Д. Джафарова, В.В. Сахаров, Л.А. Курбатова // Рус. мед. сервер http: www.rusmedserv.com
6. Руководство по лечебному питанию детей / Под ред. К.С. Ладодо. — М., 2000. — 384 с.
7. Барановский А.Ю. Искусственное питание больных / А.Ю. Барановский, И.Я. Шапиро. — СПб., 2000. — 154 с.
8. Энтеральное питание как своевременная энергетическая и пластическая поддержка детей в стрессовых состояниях / Ю.В. Ерпулева, Т.Э. Боровик, А.У. Лекманов, А.П. Шадчев // Вестник интенсивной терапии. — 2004. — № 2. — С. 39-42.
9. Современные возможности энтерального питания полимерными и модульными смесями / А.В. Снеговой, А.И. Салтанов, Л.В. Манзюк, В.Ю. Сельчук // РМЖ. — 2012. — № 19. — С. 944-946.
/84.jpg)
/85.jpg)