Статья опубликована на с. 100-105
Введение
Острые кишечные инфекции (ОКИ) сохраняют ведущие позиции в структуре инфекционной патологии и ежедневно регистрируются у 11 млн человек во всем мире [1–3, 12]. Вспышка эшерихиоза в Европе в 2011 году вызвала значительные экономические и социальные последствия [17]. Заболели более 4300 человек, 52 из которых скончались; у 852 развилась почечная недостаточность. Случаи заболевания эшерихиозом, завезенным из Германии, были зарегистрированы в Австрии, Дании, Голландии, Норвегии, Испании, Франции, Швеции, Швейцарии, Чехии, Великобритании, Финляндии, Италии, Польше и США. В Европе переболело работоспособное население, среди которого 75 % — женщины [10, 17]. Однако специальные знания о кишечной палочке O104:H4 являются весьма ограниченными. Представлялось целесообразным добавить новые сведения к известным знаниям, суммируя последнюю актуальную информацию об эпидемии, вызванной энтерогеморрагической кишечной палочкой O104:H4 в Европе.
Цель — представить практикующим врачам краткую клинико-эпидемиологическую характеристику, особенности диагностики, лечения и профилактики энтерогеморрагического и других эшерихиозов.
Определение. Эшерихиоз, или кишечная колиинфекция, — острая кишечная инфекция (ОКИ), вызываемая патогенными штаммами кишечных палочек, протекающая с симптомами общей интоксикации и поражением желудочно-кишечного тракта.
Этиология
Возбудитель открыт немецким педиатром T. Esche–rich в 1886 г. Он выделил микроб из кишечника детей и определил как Bacterium coli commune, предположив, что он может быть причиной поносов у детей. В его честь микроб назван Еscherichia coli [2]. Эшерихии — постоянные обитатели кишечника человека и теплокровных животных, но некоторые из них могут вызывать поражения желудочно-кишечного тракта (ЖКТ), что доказано экспериментально Г.Н. Габричевским в 1894 г. и подтверждено клинически в 1922 г. А. Adam. Различия в антигенной структуре патогенных и непатогенных кишечных палочек, выявленные F. Kaufmann в 1942–1945 гг., легли в основу классификации патогенных эшерихий. По рекомендации ВОЗ эшерихии, вызывающие поражение ЖКТ, называются диареегенными.
Возбудители принадлежат к виду Escherichia coli, роду Escherichia, семейству Enterobacteriaceae, представляют собой грамотрицательные подвижные и неподвижные палочки, что связано с наличием или отсутствием у них перитрихиально расположенных жгутиков. Хорошо растут на обычных питательных средах, активно ферментируют углеводы. Устойчивы во внешней среде, месяцами сохраняются в почве, воде, испражнениях. Хорошо переносят высушивание. Обладают способностью к размножению в пищевых продуктах, особенно в молоке (до 34 дней). Сохраняют жизнеспособность в детских питательных смесях — до 92 дней, на игрушках — до 3–5 мес. Быстро погибают при воздействии дезинфицирующих средств и при кипячении. У многих штаммов Е.соli отмечается резистентность к ряду антибиотиков (неомицин, ампициллин, цефалотин и др.). Устойчивость к антибиотикам выявлена у 13–35,1 % штаммов патогенных эшерихий.
Эшерихии имеют сложную антигенную структуру: термостабильный соматический О-антиген (О-Аг) — 173 серотипа, поверхностный соматический капсульный К-антиген (К-Аг) — 80 сероваров и жгутиковый термолабильный Н-антиген (Н-Аг) — 56 серотипов. На основании антигенных различий осуществляется дифференциация рода эшерихий на отдельные группы и типы. Часто отмечают лишь О-антиген. Растут на обыч–ных питательных средах, выделяют бактерицидные вещества — колицины. Серовары не имеют морфологических отличий [2].
Патогенные эшерихии классифицированы на 5 категорий:
1. Энтеропатогенные бактерии (ЭПКП, EPEC — лат.) являются возбудителями колиэнтеритов у детей и, как правило, у взрослых заболеваний не вызывают. К ЭПКП относятся класс 1: серогруппы О26, О55, О86, О111ab, О119, О125ab, О127, О128ab, О142 и О158; класс 2: О18, О44, О112, О114.
2. Энтеротоксигенные кишечные палочки (ЭТКП, ETEC — лат.) вызывают холероподобные заболевания у детей и взрослых, что связано с их способностью продуцировать экзотоксин, подобный холерогену. К их числу относят штаммы, принадлежащие к следующим О-группам: О6, О8, О11, О15, О20, О25, О27, О63, О78, О80, О85, О114, О115, О128ас, О139, О148, О153, О159, О166, О167 и др.
3. Энтероинвазивные кишечные палочки (ЭИКП, EIEC — лат.) вызывают дизентериеподобные заболевания у детей и взрослых. Наибольшее значение имеют штаммы О28ас, О29, О112ас, О124, О135, О136, О143, О144, О152, О164, О167.
4. Энтерогеморрагические кишечные палочки (ЭГКП, ЕНЕС — лат.) продуцируют цитотоксин и SLT (Shiga-like toxin), вызывают дизентериеподобные заболевания. К ним относятся штаммы Е.coli: О157, О126, О111, О145. С ЭГКП Е.coli О157:H7 связаны драматические вспышки этого эшерихиоза среди детей и взрослых в США, Канаде и Японии.
5. Среди эшерихиозов других патогенных серо–групп выделяют энтероадгезивные (ЭАКП, EAEC — лат.), которые впервые были выделены в 1985 г. Они неинвазивны, не образуют цитотоксины и не имеют плазмидного фактора адгезии. Свое название получили благодаря способности к адгезии к клеткам Нер-2 in vitro. Категория ЭАКП пока не представлена какими-либо серогруппами. Эти эшерихии обладают способностью вызывать заболевания главным образом у лиц с ослабленной сопротивляемостью к инфекции [7].
Известны несколько штаммов ЭГКП, такие как О157, О126, О111, О145. Наиболее значимой для общественного здравоохранения бактерией серотипа ЭГКП является E.сoli O157:H7 [14]; тем не менее возбудителями спорадических случаев и вспышек заболеваний являются и другие серотипы [8].
Современная классификация и регистрация
Согласно Международной классификации болезней 10-го пересмотра (МКБ-10, 1997) регистрация эшерихиозов проводится под шифрами:
А04,0 — энтеропатогенный эшерихиоз;
А04,1 — энтеротоксигенный эшерихиоз;
А04,2 — энтероинвазивный эшерихиоз;
А04,3 — энтерогеморрагический эшерихиоз;
А04,4 — эшерихиоз других патогенных серогрупп.
Эпидемиология. Эшерихиоз — повсеместно распространенное заболевание, чаще диагностируемое у детей до 1 года; у взрослых оно регистрируется как диарея путешественников [4, 15]. Групповые вспышки зарегистрированы в последние годы в Канаде, США, Японии, России и других странах. E.coli стала рассматриваться в качестве проблемы общественного здравоохранения с 1982 г., после вспышки заболевания в США [1, 5, 7, 12].
Ситуация по эшерихиозам в Гродненской области представлена следующим образом (рис. 1).
В структуре ОКИ бактериального происхождения удельный вес эшерихиозов в течение последних 15 лет наблюдения колебался от 8,5 % в 2001 году до 1,4 % в 2015 году, относительный показатель заболеваемости за эти годы снизился с 2,8 до 0,3 на 100 тысяч населения.
За 15 лет наблюдения в Гродненской области зарегистрировано 158 случаев заболевания эшерихиозами. В возрастной структуре заболевших удельный вес детей до 14 лет составил 83,5 % (132 случая). Среди детей наи–более уязвима возрастная группа 1–2 года — 113 случаев (71,5 % от числа всех детей), среди детей до 1 года зарегистрировано 58 случаев (36,7 %) [3]. С одинаковой частотой болели дети более старших возрастных групп: 3–6 лет — 10 случаев (6,3 %), 7–14 лет — 9 случаев (5,7 %). Среди взрослых зарегистрировано 25 случаев (15,8 %) эшерихиоза.
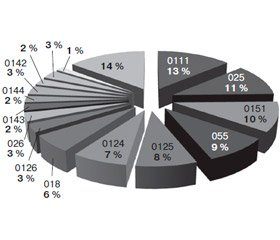
Серологическая структура эшерихиозов представлена 16 различными серогруппами кишечных палочек; наиболее распространены 8 серогрупп — О111 (13,0 %), О25 (11,0 %), О151 (10,0 %), О55 (9,0 %), О125 (8,0 %), О124 (7,0 %), О18 (6,0 %). Участие различных серогрупп кишечной палочки в эпидпроцессе эшерихиозов в разные годы неодинаково (рис. 2). Так, в 2001–2004 годах заболевания чаще вызывались серо–группами О 151, О111, О25, в последние 2 года — серо–группами О124, О25, при отсутствии циркуляции E.coli О151, О111.
Особенности энтеро–геморрагического эшерихиоза
По данным литературы, впервые штамм ЭГКП О104:H4, вызвавший эпидемию в Европе в 2011 году, был обнаружен в 2006 году в Корее у 29-летней женщины, перенесшей тяжелую форму эшерихиоза, осложнившегося гемолитико-уремическим синдромом (ГУС) [5]. Как показали лабораторные исследования антигенов бактерии, она является редким штаммом E.сoli, принадлежащим к серотипу О104:H4. Данный штамм был выделен из тканей больных в Германии и Дании [10, 15, 16]. Предварительные результаты секвенирования бактериальной ДНК свидетельствуют о том, что этот штамм является мутантом, содержащим гены двух различных типов кишечной палочки. Новый штамм ЭГКП обладает рядом характеристик, повышающих вирулентность и продукцию токсинов. ЭГКП выделяют цитотоксин, веротоксины или шигатоксины 1-го и 2-го типов (названные из-за их сходства с токсинами, производимыми шигеллами), содержат плазмиды, которые облегчают адгезию к энтероцитам. Количество бактерий ЭГКП может увеличиваться при температуре от +7 до +50 °С (оптимальная температура +37 °С). Бактерии ЭГКП могут расти в кислых продуктах с показателем pH вплоть до 4,4, а также в продуктах с минимальной активностью воды (Aw), составляющей 0,95, погибают при тщательной тепловой обработке продуктов — при нагревании до 70 °С или выше [11]. Согласно эпидемиологическим наблюдениям, заражение кишечной палочкой O104:H4 может осложняться ГУС [5, 17].
Резервуаром и источником инфекции является человек, больной или носитель, а также крупный рогатый скот и другие животные. Механизм передачи — фекально-оральный, который реализуется пищевым путем, реже — водным и бытовым. Возбудитель передается человеку главным образом в результате употребления в пищу зараженных продуктов, таких как сырые или не прошедшие достаточную тепловую обработку мясные продукты, молоко, творог, салаты из овощей, фрукты и соки. Так, к возникновению вспышек E.сoli O157:H7 привело употребление в пищу не прошедших должную тепловую обработку гамбургеров, копченой колбасы, непастеризованного свежевыжатого яблочного сока, йогуртов, сыров и молока [6, 8, 14]. Источником распространения эшерихиоза в Европе в 2011 году стали ростки сои. ЭГКП могут вызывать как спорадические, так и эпидемические вспышки [12]. Эпидемические вспышки ЭГКП пищевого происхождения, как правило, протекают бурно и заканчиваются в короткие сроки. Сезонность при эшерихиозах не выражена. Период выведения из организма бактерий ЭГКП у взрослых людей длится одну неделю и менее. У детей этот период может быть более длительным.
Механизм развития патологического процесса при эшерихиозах зависит от категории возбудителя. ЭГКП продуцируют цитотоксин и SLT (Shiga-like toxin), вызывающий разрушение клеток эндотелия мелких кровеносных сосудов кишечной стенки, преимущественно в проксимальных отделах толстой кишки [11, 16]. Образующиеся сгустки крови и выпадение фибрина приводят к нарушению кровоснабжения кишечника, появлению крови в стуле. Кроме того, происходит развитие ишемии кишечной стенки, вплоть до некроза. У некоторых больных наблюдаются тяжелые осложнения с развитием ДВС-синдрома, инфекционного токсического шока, острой почечной недостаточности (ОПН) и ГУС.
Инкубационный период длится от 3 до 8 дней, при средней продолжительности 3–4 дня. Заболевание носит манифестный характер, имеет среднетяжелое и тяжелое течение. Легкое течение описывается лишь у 15 % заболевших. Эшерихиоз, вызываемый ЭГКП, начинается остро, характеризуется синдромами общей инфекционной интоксикации и пре–имущественным поражением проксимального отдела толстой кишки. Больные ощущают общую слабость, головокружение, подъем температуры тела. Некоторых больных беспокоит тошнота и повторная рвота — вначале съеденной пищей, затем мутной белесоватой жидкостью. Одновременно с этим возникают разлитые боли в животе схваткообразного характера. У всех больных появляется частый, жидкий, обильный стул, который быстро становится водянистым, с примесью крови. В дальнейшем развивается выраженный геморрагический колит, проявляющийся сильными болями в животе, тенезмами, частым жидким стулом с примесью крови, но при отсутствии полиморфноядерных лейкоцитов. При ректороманоскопии выявляется катарально-геморрагический, эрозивно-геморрагический, реже — катаральный проктосигмоидит.
Гемолитико-уремический синдром
Большинство пациентов выздоравливает в течение 10 дней, но у 3–5 % пациентов (особенно у детей раннего возраста и пожилых людей) болезнь может принять тяжелую форму с развитием тяжелого осложнения — ГУС. Летальность в этих случаях достигает 3–7 %. Для ГУС характерны острая почечная недостаточность, гемолитическая анемия и тромбоцитопения. Предполагается, что в основе ГУС лежит повреждение эндотелиальных клеток как самим веротоксином, так и образуемыми им иммунными комплексами. Это приводит к развитию локального (прежде всего почечного), а затем и диссеминированного внутрисосудистого свертывания, тромбоцитопении, отложению фибрина в сосудах почечных клубочков со снижением скорости клубочковой фильтрации и уменьшением перфузии почечных канальцев с их вторичной дисфункцией и некрозом [9]. Микроангиопатия, имеющаяся при ГУС, участвует в развитии анемии и во многом определяет степень поражения других органов (мозг, печень, сердце, легкие).
Развитие ГУС можно разделить на два периода: продромальный (диарейный) и острую фазу заболевания. Первый длится в среднем 3–5 дней. Клиническая симптоматика продромального периода ГУС соответствует клинике острой кишечной инфекции. За этим периодом следует катастрофическое развитие острой фазы ГУС. Во время нее проявляется и бурно прогрессирует в течение 2–3 дней триада ГУС: нарушение функции почек, анемия, тромбоцитопения. Появляется бледность кожных покровов, рвота, пастозность кожи и подкожной клетчатки, снижается суточный диурез вплоть до полного его прекращения, повышается уровень мочевины и креатинина в крови, снижается уровень общего белка и альбуминов. У 20 % больных отмечаются симптомы поражения центральной нервно–й системы (ЦНС) (адинамия, нарушение сознания, судорожные приступы, гемипарезы).
Характеризуя гемолитическую анемию при ГУС, следует отметить, что в острой фазе заболевания уровень гемоглобина падает очень быстро: в течение 1–2 суток снижается до 70–80 г/л, а иногда и ниже — до 40 г/л. Однако выраженного повышения уровня билирубина в крови при этом не наблюдается. Тромбоцитопения и ДВС-синдром сопровождаются соответствующими изменениями гемостазиограммы (увеличение времени кровотечения, времени свертывания, уменьшение протромбинового индекса, появление продуктов деградации фибрина и фибриногена и др.). Возможны кровоточивость слизистых, мест инъекций, примесь крови в рвотных массах, макрогематурия, примесь алой крови в испражнениях.
По прошествии первых трех суток острой фазы ГУС основная роль в дальнейшем течении заболевания принадлежит острой почечной недостаточности (ОПН) с хорошо известными ее стадиями (олигоанурической, полиурической), осложнениями и исходами. ГУС может возникнуть уже после прекращения диареи. Во всем мире ГУС является самой распространенной причиной ОПН у детей раннего возраста. Он может привести к неврологическим осложнениям (таким как судороги, инсульт и кома) у 25 % пациентов и хроническим заболеваниям почек примерно у 50 % выживших пациентов. У 5–7 % больных, перенесших ГУС, в отдаленном периоде развивается гипертония, требующая применения гипотензивных средств. Около 30 % детей в течение длительного времени (несколько лет) имеют протеинурию и азотемию, и столько же — сниженный уровень гломерулярной фильтрации почек.
Диагностика
Каких-либо клинических признаков, патогномоничных для эшерихиозов, нет. Наряду с клинико-эпидемиологическими данными важная роль принадлежит лабораторной диагностике. Наибольшее значение имеет бактериологический метод. Исследуемым материалом служат испражнения и рвотные массы. Посев производят на среды Плоскирева, Эндо, Левина, а также на среду обогащения Мюллера. Другие методы лабораторной диагностики, в том числе и серологический (РНГА), большого практического значения в настоящее время не имеют. Основная причина этого — антигенная общность между эшерихиями, шигеллами и некоторыми другими бактериями. В настоящее время внедряется диагностика на основе полимеразной цепной реакции (ПЦР) [13, 14]. Инструментальные методы обследования (ректороманоскопия, колоноскопия) при эшерихиозах малоинформативны.
Большое значение для исхода эшерихиоза, вызванного ЭГКП, имеет своевременное выявление у больных ранних признаков ГУС:
— изменений в общем анализе мочи (протеинурия, гематурия, пиурия); это один из ранних признаков ГУС, который появляется еще до снижения суточного диуреза; уровень белка в моче повышается до значительных цифр — 0,5–2 г/л и выше, число лейкоцитов и особенно эритроцитов в моче также резко возрастает;
— изменений в общем анализе крови (лейкоцитоз, сдвиг лейкоцитарной формулы влево, появление токсической зернистости нейтрофилов, увеличение СОЭ); с первых часов острой фазы ГУС выраженность этих изменений значительно превышает таковую у детей с ОКИ;
— судорожных приступов, особенно характерны судороги, возникающие при нормальной или субфебрильной температуре;
— бледности кожных покровов, которая стремительно нарастает, иногда может отмечаться слабая иктеричность кожи и склер;
— пастозности кожи и подкожной клетчатки, которая в начале острой фазы ГУС может быть связана не только со снижением диуреза, но и с прогрессирующей гипопротеинемией из-за потерь белка с мочой;
— рвоты (особенно если она возобновилась у пациентов с диареей спустя несколько дней лечения и не связана с нарушением диеты);
— олигурии (снижение диуреза может быть выявлено в первые сутки острой фазы ГУС);
— тромбоцитопении;
— артериальной гипертензии;
— результатов УЗИ почек: при ГУС отмечается увеличение объема почек, изменение соотношения между паренхимой и центральным комплексом почки в сторону преобладания паренхимы, появление характерной эхогенности паренхимы почек (т.н. гиперэхогенная «белая» почка) в сочетании с деформацией почечных лоханок и их визуализацией в виде тонких полосок неправильной формы; нередко отмечается умеренная пиелоэктация.
Дифференциальная диагностика эшерихиоза проводится с дизентерией, сальмонеллезом, пищевыми токсикоинфекциями, острыми кишечными заболеваниями вирусной этиологии. Само название «холероподобный эшерихиоз» диктует необходимость дифференциации его от холеры. Решающее значение в этих случаях приобретает оценка эпидемиологической ситуации и результатов бактериологического исследования.
Лечение
Лечение больных эшерихиозом проводят в условиях стационара. Постельный режим в первые 2–3 дня необходим для больных тяжелыми и среднетяжелыми формами. Пациенты с тяжелым и осложненным течением эшерихиоза должны госпитализироваться в отделения интенсивной терапии и реанимации. Лечение больных энтерогеморрагическим эшерихиозом включает этиотропные средства и регидратационную терапию в соответствии с клиническими протоколами диагностики и лечения инфекционных заболеваний. Этиотропная терапия эшерихиоза, вызываемого ЭГКП, заключается в назначении рифаксимина — альфа нормикс (препарат обладает широким спектром антибактериальной активности, включающим большинство грамотрицательных и грамположительных, аэробных и анаэробных бактерий [3]. Взрослым и детям старше 12 лет препарат назначают по 200 мг (1 таб–летка или 10 мл суспензии) каждые 8 ч или по 400 мг (2 таблетки или 20 мл суспензии) каждые 8–12 ч. При необходимости дозы и частота приема могут быть изменены под контролем врача. Продолжительность лечения не должна превышать 7 дней и определяется клиническим состоянием пациентов. Отмечено, что препараты ко-тримоксазола, сульфаниламиды, а также ампициллин и амоксициллин увеличивают риск развития гемолиза и уремии, в связи с этим назначение указанных препаратов для лечения данной инфекции не рекомендуется. В случае осложненного ГУС течения заболевания следует использовать карбапенемы, не обладающие антисинегнойной активностью (эртапенем) [3]. Препарат назначают в/в капельно и в/м. Доза для взрослых и детей старше 13 лет — 1 г, кратность введения — 1 раз в сутки. Детям с 3 мес. до 12 лет — 15 мг/ кг, доза делится на 2 введения (но не более 1 г/ сут). Курс лечения — 3–14 дней, в зависимости от тяжести заболевания и вида возбудителя.
Патогенетическая терапия больных тяжелыми и среднетяжелыми формами не менее важна, чем применение этиотропных средств. Применяются инфузионно-дезинтоксикационные средства с одновременной коррекцией нарушений водно-электролитного баланса. Проводится коррекция ДВС-синдрома с учетом его стадии. Показаны ферментные препараты (микразим, фестал, панзинорм и др.), энтеросорбенты (фильтрум, энтеродез, полифепам и др.). При продолжительной диарее, особенно после приема антибактериальных средств, используют эубиотики и их комбинации для коррекции дисбактериоза кишечника (энтерожермина, лактофильтрум, бифидумбактерин и др.). В случаях развития ГУС и дегидратационного шока осуществляется соответствующая интенсивная терапия в специализированных учреждениях.
Выписка реконвалесцентов возможна после полного клинического выздоровления при отрицательных результатах бактериологического исследования. После выписки из стационара реконвалесценты подлежат наблюдению в кабинетах инфекционных заболеваний. Контактировавших с больными в очаге заболевания наблюдают в течение 7 дней.
Профилактика
Для профилактики инфекции необходимо соблюдать контрольные меры на всех стадиях пищевой цепи — от производства сельскохозяйственной продукции на фермах до обработки, переработки и приготовления пищевых продуктов как на коммерческих предприятиях, так и в домашних условиях.
Единственным эффективным способом уничтожения бактерий ЭГКП в пищевых продуктах является бактерицидная обработка, такая как нагревание (например, тепловая обработка или пастеризация) или облучение. В некоторых странах принято считать сырой мясной фарш зараженным, если в нем обнаружены бактерии E.сoli O157:H7.
Меры для профилактики инфекции E.сoli O157:H7 сходны с мерами, рекомендуемыми для профилактики других болезней пищевого происхождения. Однако для бактерий ЭГКП некоторые меры должны быть усилены, особенно это важно по отношению к уязвимым группам населения, таким как дети и пожилые люди. Соблюдение основных принципов надлежащей практики гигиены пищевых продуктов может предотвратить передачу патогенных микроорганизмов, являющихся возбудителями многих болезней пищевого происхождения, а также защитить от болезней, вызываемых бактериями ЭГКП.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Ershova IB, Mochalova AA, Osipova TF, Reshchikov VA, Kozina SYu. [Drugs reducing microbiocenosis as the causal treatment of acute intestinal infections in children]. Aktual'naya infektologiya. 2015;7(2):45-50. Russian
2. Pokrovskiy VI, Pak SG, Briko NI, Danilkin BK. [Infectious diseases and epidemiology: Tutorial]. M.: GEOTAR-MED, 2004. – 816 s. Russian.
3. On peculiarities of the appointment of antibacterial drugs for infections caused by E. coli O104: H4 [Pismo Ministerstva Zdravoohraneniya Respubliki Belarus]. 2011. № 02-2-04/1783. Russian.
4. Pronko NV, Danilevich NA, Konyuk LA. [Epidemiological and clinical features of the syndrome of acute diarrhea in children]. Journal of Grodno State Medical University. 2014;(3):92-95. Russian.
5. Bea WK, Lee YK, Cho MS. et al. A case of hemolytic uremic syndrome caused by Escherichia coli 104:H4. Yonsei Med. J. 2006;47(3):437-439.
6. Lu HJ, Breidt FJr, Pérez-Díaz IM, Osborne JA. Antimicrobial effects of weak acids on the survival of Escherichia coli O157:H7 under anaerobic conditions. J Food Prot. 2011;74(6):893-898.
7. O'Reilly KM, Low JC, Denwood MJ. et al. Associations between the presence of virulence determinants and the epidemiology and ecology of zoonotic Escherichia coli. Appl Environ Microbiol. 2010;76(24):8110-8116.
8. Zhou Z, Li X, Liu B, et al. Derivation of Escherichia coli O157:H7 from its O55:H7 precursor. PLoS One. 2010;5(1):8700-8705.
9. Poolpol K, Gadner B, Neururer S, Mellmann A, Karch H, Orth D, Würzner R. Do complement factor H 402Y and C7 M allotypes predispose to (typical) haemolytic uraemic syndrome? Int J Immunogenet. 2011;38(5):383-387. doi: 10.1111/j.1744-313X.2011.01017.x. Epub 2011 Jun 7.
10. Frank C, Faber MS, Askar M. et al. Large and ongoing outbreak of haemolytic uraemic syndrome, Germany, May 2011. Euro Surveill. 2011;16(21):P.19878.
11. Vidal JE, Canizález-Román A, Gutiérrez-Jiménez J, Navarro-García F. Molecular pathogenesis, epidemiology and diagnosis of enteropathogenic Escherichia coli. Salud Publica Mex. 2007;49(5):376-386.
12. Ochoa TJ, Barletta F, Contreras C, Mercado E. New insights into the epidemiology of enteropathogenic Escherichia coli infection. Trans R Soc Trop Med Hyg. 2008;102(9):852-856.
13. Hill WE, Suhalim R, Richter HC. et al. Polymerase Chain Reaction Screening for Salmonella and Enterohemorrhagic Escherichia coli on Beef Products in Processing Establishments. Foodborne Pathog Dis. 2011;8(9):1045-1053.
14. Perry LL, SanMiguel P, Minocha U, et al. Sequence analysis of Escherichia coli O157:H7 bacteriophage PhiV10 and identification of a phage-encoded immunity protein that modifies the O157 antigen. FEMS Microbiol Lett. 2009;292(2):182-186.
15. Kozub-Witkowski E, Krause G, Frankel G. et al. Serotypes and virutypes of enteropathogenic and enterohaemorrhagic Escherichia coli strains from stool samples of children with diarrhoea in Germany. J Appl Microbiol. 2008;104(2):403-410.
16. Bielaszewska M, Middendorf B, Köck R. et al. Shiga toxin-negative attaching and effacing Escherichia coli: distinct clinical associations with bacterial phylogeny and virulence traits and inferred in-host pathogen evolution. Clin. Infect. Dis. 2008;47(2):208-217.
17. Askar M, Faber M, Frank C. et al. Update on the ongoing outbreak of haemolytic uraemic syndrome due to Shiga toxin-producing Escherichia coli (STEC) serotype O104, Germany, May 2011. Euro Surveill. 2011;16(22):19883.

/101-1.jpg)
/102-1.jpg)