Журнал «Медицина неотложных состояний» 6 (77) 2016
Вернуться к номеру
Эффективность декскетопрофена трометамола при лечении послеоперационной боли
Авторы: Клигуненко Е.Н., Кравец О.В., Болтянский С.В., Ехалов В.В. - ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
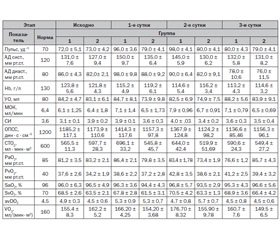
Актуальність. Питання лікування післяопераційного болю залишаються предметом активного обговорення і великої кількості медичних публікацій. Мета дослідження: оцінити ефективність застосування декскетопрофену трометамолу при лікуванні післяопераційного больового синдрому у хворих, які перенесли оперативне втручання на органах черевної порожнини. Матеріали і методи. Обстежено 40 хворих, яких було прооперовано з приводу патології органів черевної порожнини. Залежно від характеру післяопераційного знеболювання (застосування диклофенаку натрію або декскетопрофену трометамолу) хворі були розподілені на 2 групи. Результати. При лікуванні післяопераційного больового синдрому диклофенаком натрію упродовж перших двох діб після операції зберігався помірний больовий синдром, що потребувало додаткового знеболювання наркотичними анальгетиками у 80–90 % хворих (дворазово — в 1-шу добу, одноразово — в 2-гу добу). Післяопераційний біль супроводжувався симпатикотонією, гіперглікемією, вазоспазмом і тахікардією. Формувався відносно гіпердинамічний тип кровообігу. Активація симпатичної ланки вегетативної нервової системи сприяла збільшенню системного транспорту і споживання кисню. Застосування декскетопрофену трометамолу при лікуванні післяопераційного больового синдрому було ефективним і дозволяло якісно обмежити розвиток післяопераційної гіпералгезії. Висновки. Традиційне використання диклофенаку натрію для лікування болю після планового оперативного втручання в абдомінальній хірургії зберігає помірний больовий синдром, що у 80–90 % хворих вимагає неодноразового додаткового введення наркотичних анальгетиків протягом перших двох діб. При застосуванні декскетопрофену трометамолу больовий синдром зменшується до легкого вже з 1-ї доби після операції, що у 40–60 % пацієнтів вимагає тільки одноразового додаткового знеболювання, сприяє нормалізації судинного тонусу і серцевого ритму, транспорту і споживання кисню при відносній парасимпатикотонії.
Актуальность. Вопросы лечения послеоперационной боли остаются предметом активного обсуждения и большого количества публикаций в медицине. Цель исследования: оценить эффективность применения декскетопрофена трометамола при лечении послеоперационного болевого синдрома у больных, перенесших оперативное вмешательство на органах брюшной полости. Материалы и методы. Обследовано 40 больных, оперированных по поводу патологии органов брюшной полости в плановом порядке. В зависимости от характера послеоперационного обезболивания (применение диклофенака натрия или декскетопрофена трометамола) больные были разделены на 2 группы. Результаты. При лечении послеоперационного болевого синдрома диклофенаком натрия на протяжении первых двух суток после операции сохранялся умеренный болевой синдром, требовавший дополнительного обезболивания наркотическими анальгетиками у 80–90 % больных (двукратно — в 1-е сутки, однократно — на 2-е сутки). Послеоперационная боль сопровождалась симпатикотонией, гипергликемией, вазоспазмом и тахикардией. Формировался относительно гипердинамический тип кровообращения. Активация симпатического звена вегетативной нервной системы способствовала увеличению системного транспорта и потребления кислорода. Применение декскетопрофена трометамола при лечении послеоперационного болевого синдрома было эффективным и позволяло качественно ограничить развитие послеоперационной гипералгезии. Выводы. Традиционное использование диклофенака натрия для лечения боли после планового оперативного вмешательства в абдоминальной хирургии сохраняет умеренный болевой синдром, что у 80–90 % больных требует неоднократного дополнительного введения наркотических анальгетиков в течение первых двух суток. На фоне декскетопрофена трометамола болевой синдром уменьшается до легкого уже с 1-х суток после операции, что у 40–60 % пациентов требует только однократного дополнительного обезболивания, способствует нормализации сосудистого тонуса и сердечного ритма, транспорта и потребления кислорода при относительной парасимпатикотонии.
Introduction. Questions of treatment of postoperative pain remain the subject of active debate and numerous publications in medicine. Objective: to evaluate the efficacy of dexketoprofen trometamol in the treatment of postoperative pain in patients, who had undergone elective abdominal surgery. Materials and methods. 40 patients operated on for diseases of the abdominal cavity in a planned manner. Depending on the nature of post-operative analgesia (use of diclofenac sodium or dexketoprofen trometamol), patients were divided into 2 groups. Results. In the treatment of postoperative pain using diclofenac sodium over the first two days after surgery a moderate pain syndrome remained, which required additional analgesia with narcotic analgesics in 80–90 % of patients (twice — on day 1, once — on day 2). Postoperative pain was associated with sympathicotonia, hyperglycemia, vasospasm and tachycardia. It forms a relatively hyperdynamic circulatory type. Activation of the sympathetic component of the autonomic nervous system has increased the system transport and oxygen consumption. The use of dexketoprofen trometamol in the treatment of postoperative pain was effective and allowed to limit the development of postoperative hyperalgesia. Conclusions. The traditional use of diclofenac sodium for the treatment of pain after elective surgery in the abdominal surgery retains moderate pain that in 80–90 % of patients require repeated additional administration of narcotic analgesics during the first two days. Against the background of dexketoprofen trometamol, the pain syndrome is reduced to mild since day 1 after the operation that in 40–60 % of patients required only a single additional pain relief, helps normalize vascular tone and heart rate, oxygen transport and uptake with relative parasympathicotonia.
післяопераційне знеболювання, планова абдомінальна хірургія, нестероїдні протизапальні препарати.
послеоперационное обезболивание, плановая абдоминальная хирургия, нестероидные противовоспалительные препараты.
postoperative analgesia, elective abdominal surgery, nonsteroidal anti-inflammatory drugs.
Статья опубликована на с. 35-41
Введение
Материалы и методы
Результаты
Выводы
1. Barden J., Edwards J., Moore A., McQuay H. Single dose oral paracetamol (acetaminophen) for postoperative pain (Cochrane Review). The Cochrane Library. — Chichester: John Wiley & Sons, 2009.
2. Bombardier C., Laine L., Reicin A. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. // N. Engl. J. Med. — 2009. — V. 343. — P. 1520-1528.
3. Brodner G., Mertes N., Buerkle H. Acute pain management: analysis, implications and consequences after prospective experience with 6349 surgical patients. // Eur. J. Anaesth. — 2010. — V. 17. — P. 566-575.
4. Clark D., Layton D., Shakir S. Do some inhibitors of COX-2 increase the risk of thromboembolic events? Linking pharmacology with pharmacoepidimiology // Drug Saf. — 2010. — V. 27. — P. 427-456.
5. Dolin S., Cashman J., Bland J. Effectiveness of acute postoperative pain management: I. Evidence from published data // Br. J. Anaesth. — 2012. — V. 89. — P. 409-423.
6. Koppert W., Wehrfritz A., Korber N. The cyclooxygenase isozyme inhibitors parecoxib and paracetamol reduce central hyperalgesia in humans // Pain. — 2010. — V. 108. — P. 148-153.
7. Laine L. Gastrointestinal effects of NSAIDs and coxibs // J. ain Symptom Manage. — 2009. — V. 25. — S. 32-40.
8. Perkins F., Kehlet H. Chronic pain as an outcome of surgery // Anesthesiology. — 2010. — V. 93. — P. 1123-1133.
9. Management of Postoperative Pain: A Clinical Practice Guideline From the American Pain Society, the American Society of Regional Anesthesia and Pain Medicine, and the American Society of Anesthesiologists' Committee on Regional Anesthesia, Executive Committee, and Administrative Council // The Journal of Pain. — 2016. — Vol. 17, Is. 2. — P. 131-157.

/37.jpg)
/38.jpg)
/39.jpg)