Статья опубликована на с. 6-7 (Мир)
7–8 жовтня 2016 року у Відні відбувся 16-й Центральноєвропейський мітинг Європейської асоціації урологів (CEM16), що зібрав понад 300 учасників із різних країн Центральної Європи. На даному форумі розглядалися безліч актуальних питань, що стосуються онкологічної урології, сечокам’яної хвороби й дитячої урології. Особливу увагу було приділено медикаментозному лікуванню симптомів нижніх сечових шляхів (СНСШ), пов’язаних із доброякісною гіперплазією передміхурової залози (ДГПЗ). Зокрема, цій проблемі була присвячена лекція професора Bob Djavan (Chairman Department of Urology Rudolfinerhaus Foundation Hospital, Vienna, Austria) «BPH: Medical Treatment in EAU and AUA Guidelines» («ДГПЗ: медикаментозне лікування в рекомендаціях EAU та AUA»).
Доброякісна гіперплазія простати є результатом проліферативного процесу стромальних і епітеліальних елементів простати, що дуже часто зустрічається в чоловіків віком понад 60 років. Клінічні прояви даного захворювання включають симптоми нижніх сечових шляхів, гостру або хронічну затримку сечі, інфекцію сечових шляхів, уросепсис, гематурію й хронічну ниркову недостатність. Результати дослідження MTOPS продемонстрували, що при інтервалі спостереження 4 роки прогресування симптомів має місце в 14 % пацієнтів, затримка сечовипускання — у 2 %, тоді як розвиток інфекційних ускладнень відзначається в 1 % хворих.
У роботі Е.А. Platz і співавт., що включала спостереження за більше ніж 25 тисячами пацієнтів у середньому віці 57,3 року протягом близько 12 років, були ретельно вивчені особливості прогресування симптомів ДГПЗ. Рівень прогресування в сторону виражених симптомів становив 44,9 на 1000 чоловіків на рік. Дане дослідження переконливо продемонструвало, що показники захворюваності й прогресування симптомів різко підвищуються з віком пацієнтів.
З огляду на вищенаведене в даний час стратегія медикаментозної терапії направлена не тільки на корекцію симптомів (СНСШ, гематурія) або ускладнень ДГПЗ (інфекція сечових шляхів), але і на запобігання прогресуванню даного захворювання. Сучасні медикаментозні підходи детально описані в багатьох рекомендаціях (Європейської асоціації урологів (EAU), Американської асоціації урологів (AUA), NICE) і включають широкий спектр препаратів, що використовуються для моно- або комбінованої терапії. Проте ці керівництва мають істотні відмінності в деяких аспектах.
Багатьох чоловіків із СНСШ дані симптоми не турбують до такої міри, при якій необхідна будь-яка медикаментозна корекція або хірургічне втручання. Більшість цих пацієнтів можуть лікуватися консервативно в процесі спостереження, що в керівництві EAU позначається як watchful waiting (пильне очікування, або динамічне спостереження) (Guidelines on the Management of Non-Neurogenic Male Lower Urinary Tract Symptoms (LUTS), incl. Benign Prostatic Obstruction (BPO); European Association of Urology 2014 (pdf), p. 26).
При використанні такого підходу близько 85 % чоловіків залишаються стабільними через 1 рік, а 65 % — через 5 років. Ці дані дозволили дійти висновку, що чоловіки із неускладненими СНСШ легкого або помірного ступеня тяжкості, яких симптоми не надто турбують, можуть вважатися кандидатами для watchful waiting. Ще одним висновком EAU є те, що самостійна оцінка ситуації пацієнтом, як частина watchful waiting, сама по собі може редукувати вираженість симптомів і ступінь їх прогресування.
Як профілактичні заходи щодо розвитку симптомів нижніх сечових шляхів у пацієнтів, які перебувають під динамічним наглядом, запропоновані такі модифікації способу життя:
- зменшення споживання рідини для зменшення частоти сечовипускання в ситуаціях, коли це створює незручності;
- уникнення вживання алкоголю та кофеїну або вживання їх у помірних кількостях з огляду на сечогінну та подразнювальну дію цих речовин;
- використання різних технік, що впливають на сечовипускання, зокрема масажу уретри, стискання статевого члена, дихальних вправ, скорочення м’язів промежини і розумових хитрощів;
- тренування сечового міхура для утримання сечі;
- оцінка використовуваних медикаментів в плані їх заміни або оптимізації часу введення;
- лікування запорів.
Watchful waiting у керівництві AUА
Керівництво Американської асоціації урологів розглядає дві групи пацієнтів, що підходять для watchful waiting. До першої групи належать чоловіки з легкими симптомами нижніх сечових шляхів, пов’язаними з ДГПЗ (сума балів за шкалою AUA-SI < 8). До другої групи входять пацієнти з помірними або навіть вираженими симптомами (AUA-SI ≥ 8), але їх ці симптоми не турбують (American Urological Association Guideline: Management of Benign Prostatic Hyperplasia (BPH); Revised 2010, p. 9).
Основними модифікаціями способу життя, що пропонуються AUA, є:
- уникнення прийому протинабрякових або антигістамінних засобів;
- зменшення вживання рідини перед сном;
- зменшення прийому алкоголю й кофеїну в цілому;
- раннє повторне обстеження.
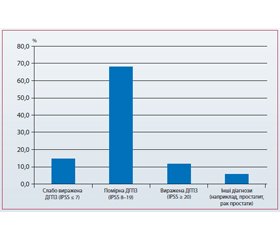
Але найбільш цікавим і важливим питанням залишається реальна вираженість симптомів, із якими пацієнти звертаються до лікаря. На 29-му конгресі EAU, що відбувався в Стокгольмі, компанія «Берлін-Хемі/Менаріні Груп» провела анкетування 195 урологів, присвячене цьому питанню. Результати даного дослідження продемонстрували, що майже 68 % чоловіків, які відвідали урологічний офіс, мали помірні симптоми, тоді як частка виражених симптомів становила не більше ніж 12 % (рис. 1).
Розглядаючи вибір лікувального підходу в пацієнтів із СНСШ, пов’язаними з ДГПЗ, AUA виділяє такі завдання для урологів:
- інформувати пацієнта про всі доступні й альтернативні методи лікування, що використовуються для корекції даного клінічного стану;
- інформувати пацієнта про всі переваги, ризики та вартість кожного методу лікування;
- приймати рішення разом із пацієнтом.
Ментальні й психологічні особливості пацієнтів можуть бути визначальним чинником у виборі виду лікування. Зокрема, пацієнти з подібними симптомами можуть вибрати абсолютно різні методи їх корекції. Деякі хворі з вираженими симптомами вибирають операцію, тоді як інші зупиняються на watchful waiting або медикаментозній терапії. При цьому вони керуються індивідуальним поглядом на переваги, ризик ускладнень і вартість методу лікування.
Альфа-адреноблокатори
На сьогодні тамсулозин залишається основним селективним блокатором альфа-1a-адренорецепторів. Нещодавно в клінічну практику було введено силодозин.
Сучасну інформацію про альфа-адреноблокатори можна коротко подати, навівши висновки рекомендацій Європейської та Американської асоціацій урологів.
EAU: використання альфа-адреноблокаторів показано в пацієнтів із помірними й вираженими симптомами нижніх сечових шляхів. Основним побічним ефектом цієї групи препаратів іноді є порушення еякуляції. Ця проблема пов’язана зі зменшенням обсягу або зникненням сім’яної рідини під час еякуляції, що може стати очевидним фактором ризику в молодому віці. Прийом силодозину найбільш часто супроводжується порушеннями еякуляції.
AUА:
- альфузозин, доксазозин, тамсулозин і теразозин є придатними й ефективними лікувальними альтернативами для пацієнтів із нав’язливими, помірними або вираженими СНСШ, пов’язаними з ДГПЗ (AUA-SI ≥ 8 %);
- усі альфа-блокатори мають подібну ефективність у завершенні СНСШ;
- у профілі побічних ефектів є незначні відмінності.
Але потрібно враховувати, що протягом усього тридцятирічного періоду використання цієї групи препаратів у пацієнтів із ДГПЗ основна увага клініцистів і фармакологів насамперед фокусувалася на подоланні побічних ефектів. У наш час для вирішення цього завдання в клінічну практику введені препарати з повільним вивільненням.
Інгібітори 5α-редуктази
EAU. Інгібітори 5α-редуктази рекомендуються до використання в пацієнтів з помірними або вираженими симптомами нижніх сечових шляхів і великим об’ємом простати (> 40 мл). Ще одним свідченням на їх користь є запобігання прогресуванню хвороби щодо гострої затримки сечовипускання і необхідності хірургічного лікування.
До найбільш виражених побічних ефектів цієї групи препаратів відносять зниження лібідо, еректильну дисфункцію, еякуляторне порушення (менш часто), зниження обсягу сім’яної рідини й розвиток гінекомастії приблизно в 1–2 % пацієнтів.
AUА. Основними показаннями до призначення інгібіторів 5α-редуктази, на думку експертів Американської асоціації урологів, можна вважати запобігання прогресуванню СНСШ, пов’язаних із ДГПЗ, а також зниження ризику розвитку гострої затримки сечовипускання й проведення в майбутньому хірургічного лікування з приводу даного захворювання. Однак ці препарати необхідно використовувати тільки в пацієнтів із великим об’ємом простати. У чоловіків із СНСШ без збільшення передміхурової залози призначення інгібіторів 5α-редуктази не раціональне.
Комбінація альфа-блокаторів та інгібіторів 5α-редуктази
Дану комбінацію пропонують використовувати і EAU, і AUA. Її раціональність аргументується даними досліджень MTOPS і COMBAT, що довели переваги комбінованої терапії перед монотерапією альфа-адреноблокаторами або інгібіторами 5α-редуктази.
Зокрема, AUA рекомендує комбінацію альфа-блокаторів та інгібіторів 5α-редуктази як відповідне та ефективне лікування в пацієнтів:
- із СНСШ, що асоціюються зі збільшенням простати, яке було доведено шляхом вимірювання об’єму простати;
- збільшенням простати за даними пальцевого ректального дослідження;
- рівнем простатичного специфічного антигену (ПСА), що відповідає об’єму простати.
Антагоністи мускаринових рецепторів
Керівництво EAU вказує, що антагоністи мускаринових рецепторів можуть використовуватися в чоловіків із помірними й вираженими симптомами нижніх сечових шляхів, якщо у них домінують симптоми накопичення. Однак ці препарати необхідно призначати з обережністю в пацієнтів з обструкцією нижніх сечових шляхів.
Порівняно з плацебо прийом антагоністів мускаринових рецепторів супроводжується великою кількістю побічних ефектів:
- сухість у роті (до 16 %);
- запори (до 4 %);
- труднощі при сечовипусканні (до 2 %);
- назофарингіти (до 3 %);
- запаморочення (до 5 %).
Інгібітори фосфодіестерази 5-го типу
Фосфодіестераза (ФДЕ) 5-го типу належить до сімейства ензимів, що інактивують циклічний гуанозинмонофосфат (цГМФ). Інгібітори цього ферменту є синтезованими молекулами, що блокують руйнівну дію ФДЕ 5-го типу на цГМФ. Спочатку вони використовувалися як препарати першої лінії терапії еректильної дисфункції. Однак м’язова релаксація в результаті їх дії виникає не тільки в corpus cavernosum, але й у шийці сечового міхура, уретрі й простаті. У даний час інгібітори фосфодіестерази 5-го типу включені в рекомендації EAU.
Дані препарати продемонстрували свою ефективність у пацієнтів з помірними або вираженими СНСШ (з еректильною дисфункцією або без неї) щодо впливу як на обструктивні, так і на іритативні симптоми.
Інгібітори фосфодіестерази 5-го типу об’єктивно не впливають на об’ємну швидкість сечовипускання (Q).
У даний час серед трьох препаратів цієї групи (силденафіл, варденафіл, тадалафіл) для лікування чоловічих СНСШ з еректильною дисфункцією або без неї офіційно ліцензований тільки тадалафіл 5 мг, що приймають один раз на день.
Ще не накопичено достатньо інформації про тривале використання інгібіторів фосфодіестерази 5-го типу, про їх вплив на розмір простати й прогресування ДГПЗ.
При призначенні даних препаратів необхідно враховувати широкий спектр протипоказань до їх застосування:
- використання нітратів або препаратів, які відкривають калієві канали, наприклад нікорандилу;
- спільне використання з альфа-адреноблокаторами, такими як доксазозин або теразозин;
- у пацієнтів із нестабільною стенокардією, недавнім інфарктом міокарда (протягом попередніх 3 місяців) або інсультом (протягом попередніх 6 місяців), а також із серцевою недостатністю > 2-ї стадії за класифікацією Нью-Йоркської кардіологічної асоціації;
- у пацієнтів з гіпотензією, погано контрольованим артеріальним тиском, нирковою або печінковою недостатністю;
- у пацієнтів з передньою ішемічною оптичною нейропатією, що супроводжується раптовою втратою зору після попереднього застосування інгібіторів фосфодіестерази 5-го типу (Guidelines on the Management of Non-Neurogenic Male Lower Urinary Tract Symptoms (LUTS), incl. Benign Prostatic Obstruction (BPO); European Association of Urology 2014 (pdf), p. 46-47).
Препарати Serenoa repens (зокрема, Простамол уно)
EAU. За висновком Кокрейнівского звіту, препарати Serenoa repens не мали переваг порівняно з плацебо, фінастеридом або тамсулозином щодо покращення суми балів за шкалою IPSS, максимальної швидкості сечовипускання або редукції розмірів простати.
Однак подібність суми балів за шкалою IPSS або покращення максимальної швидкості сечовипускання порівняно з клінічними дослідженнями, що включали використання фінастериду або тамсулозину, можуть бути інтерпретовані як свідчення терапевтичної еквівалентності даних лікувальних підходів.
Необхідно також враховувати, що екстракт Serenoa repens був набагато ефективнішим, ніж плацебо, у пацієнтів з ніктурією (середня зважена відмінність — 0,78).
AUА. Протягом багатьох років нетрадиційні підходи до корекції СНСШ, пов’язаних із ДГПЗ, викликають великий інтерес серед пацієнтів США. Донині найбільш вивченим видом даної терапії є застосування екстракту Serenoa repens (Простамол уно) (American Urological Association Guideline: Management of Benign Prostatic Hyperplasia (BPH); Revised 2010, p. 16-17).
Важливо підкреслити доведену комплексну патогенетичну дію Serenoa repens, що одночасно направлена на інгібування процесу зростання ПЖ і ліквідацію симптомів хронічного простатиту за рахунок антиандрогенної, антипроліферативної й протизапальної дії. Протизапальний і протинабряковий ефекти Serenoa repens забезпечуються такими механізмами, як:
- інгібування фосфоліпази А2 і гальмування перетворення фосфоліпідів мембран на арахідонову кислоту;
- інгібування циклооксигенази зі зниженням утворення простагландинів (медіаторів запалення);
- інгібування ліпоксигенази та зниження утворення лейкотрієнів.
Результати досліджень останніх років свідчать, що Serenoa repens впливає також на ключові медіатори запалення МСР1/ССL2 і VCAM1, які визначають прогресування захворювання. Крім того, доведено, що застосування екстракту Serenoa repens у хворих із ДГПЗ призводить до статистично значимого зниження рівня TNF-α і інтерлейкіну-1b (ІЛ-1b) у тканині простати. Усе це обумовлює доцільність застосування Простамолу у хворих із ДГПЗ у періопераційний період, що активно обговорювалося учасниками симпозіуму в процесі панельної дискусії.
В Обласному центрі урології та нефрології ім. В.І. Шаповала ми досліджували ефективність комбінованої терапії тамсулозином і екстрактом Serenoa repens у пацієнтів із СНСШ після хірургічних втручань на передміхуровій залозі з приводу ДГПЗ. У дослідження увійшли 86 хворих, яким проводилося оперативне лікування з приводу ДГПЗ (трансуретральна резекція — 46, аденомектомія — 40). Вони були розділені на дві групи. I група включала 42 пацієнти, які отримували стандартну терапію тамсулозином і антибактеріальними препаратами. У II групу ввійшли 44 хворі, які приймали екстракт Serenoa repens на додаток до стандартної терапії тамсулозином і антибіотиками. У роботі використовувалися препарати виробництва «Берлін-Хемі/Менаріні Груп» (Німеччина) — тамсулозин (Флосін), екстракт Serenoa repens (Простамол уно®). Простамол уно призначали в дозуванні 1 таблетка на добу після їди протягом 2 місяців після операції, тамсулозин — у дозуванні 0,4 мг на добу одноразово вранці після їжі також протягом 2 місяців.
У дослідження були включені пацієнти, виписані із стаціонару, які не мали будь-яких серйозних інтра- або післяопераційних ускладнень і не відмічали макрогематурії.
Пацієнти обох груп були порівнянні за віком, наявністю супутньої патології, об’ємом передміхурової залози, кількістю залишкової сечі й індексом IPSS до операції.
Порівняння ефективності різних видів терапії проводилися на підставі оцінки симптомів за Міжнародною шкалою IPSS, визначення індексу якості життя (QoL), кількості залишкової сечі й максимальної об’ємної швидкості сечовипускання. Окремо вивчалася частота розвитку й вираженість побічних ефектів. Характеристики досліджених параметрів оцінювалися безпосередньо після видалення уретрального катетера й виписки пацієнта зі стаціонару, а також через 4 і 8 тижнів після початку терапії.
Отримані дані обробляли за допомогою методів параметричної статистики. Статистичну обробку проводили за допомогою програм Statistica 6.0 та МО Excel 2007. Усі значення рівня статистичної значущості (р) менше від 0,05 вважалися вірогідними.
Результати
Основні характеристики отриманих результатів подані в табл. 1.
У пацієнтів обох груп безпосередньо перед початком терапії переважала іритативна симптоматика. Через 4 і 8 тижнів після лікування середній сумарний бал IPSS був вірогідно нижче в групі комбінованої терапії (Флосін + Простамол уно) порівняно з групою монотерапії тамсулозином. Ці відмінності були найбільш виражені через 8 тижнів лікування й насамперед стосувалися симптомів накопичення.
/7_m.jpg)
Результати комбінованої терапії також були вірогідно кращими при оцінці якості життя пацієнтів й кількості залишкової сечі, але ці переваги були зафіксовані тільки через 8 тижнів після початку лікування. Об’єктивні відмінності в обох групах відносно рівня максимальної об’ємної швидкості сечовипускання не відзначалися ні через 4, ні через 8 тижнів спостереження. Рівні побічних ефектів вірогідно не розрізнялися в обох групах і в основному були пов’язані з прийомом тамсулозину. Отже, можна зробити висновок, що комбінована терапія СНСШ після хірургічних втручань на передміхуровій залозі з приводу ДГПЗ за допомогою Флосіну й Простамолу уно є ефективним підходом, що перевершує за результатами монотерапію тамсулозином у корекції іритативних симптомів і покращенні залежної від здоров’я якості життя.
У рекомендаціях ЄАU 2016 з консервативного лікування ДГПЗ підкреслюється, що порівняно з монотерапією із застосуванням альфа-1-адреноблокаторів або інгібіторів 5-альфа-редуктази комбінована терапія призводить до більш суттєвого покращення щодо СНСШ і збільшення показника Qmax, а також є більш ефективним засобом запобігання прогресуванню захворювання. Разом з тим комбінована терапія призводить до підвищення частоти виникнення побічних явищ. У зв’язку з цим комбіновану терапію слід призначати головним чином чоловікам із СНСШ помірного до тяжкого ступеня та з ризиком прогресування захворювання (більший об’єм передміхурової залози, більша концентрація ПСА, старший вік, більший залишковий об’єм сечі після сечовипускання, нижчий показник Qmax тощо). Можливість припинення прийому альфа-1-адреноблокаторів через шість місяців терапії можна розглянути при лікуванні чоловіків із СНСШ помірного ступеня тяжкості.

/6_m.jpg)
/7_m.jpg)