Статтю опубліковано на с. 101-106
Вступ
Травма головного мозку, поєднана з травмою кісток скелета, є важливою медичною та соціальною проблемою через високий відсоток інвалідизації та летальності пацієнтів із даною патологією. Перебіг післятравматичного періоду в потерпілих із тяжкою черепно-мозковою травмою, поєднаною з травмою кісток скелета (ЧМТпТКС), практично завжди ускладнений розвитком синдрому поліорганної дисфункції (СПОД), летальність при розвитку якого досягає 70–100 %. На сьогодні незаперечним фактом є провідна роль синдрому гастроінтестинальної дисфункції (СГІД) у прогресуванні ендогенної інтоксикації та виникненні загальної відповіді організму на запалення (SIRS) у хворих із ЧМТпТКС [3, 6].
Хоча при отриманні ЧМТпТКС кишка первинно не ушкоджується, вона зазнає різних негативних впливів за рахунок стресових реакцій нейроендокринної системи, ушкодження та ішемізації тканин, що стимулюють вивільнення медіаторів запалення. Необхідність у тривалій аналгоседації, у тому числі із застосуванням наркотичних анальгетиків, також призводить до порушення функції шлунково-кишкового тракту (ШКТ). На сьогодні існує необхідність у диференційованому підході до лікування СГІД.
Матеріали та методи
Обстежено 65 хворих із тяжкою ЧМТпТКС, ускладненою СПОД із СГІД у стадії декомпенсації. Хворі були розподілені на дві групи, що не відрізнялися за віком, тяжкістю стану, вираженістю поліорганної дисфункції та СГІД. Хворі першої групи отримували терапію, що включала хірургічну санацію вогнища, волемічну, інотропну й судинну підтримку, респіраторну терапію, антибіотико- та антицитокінову терапію, застосовувались прокінетики (тримебутину малеат) та перидуральна анестезія з пролонгованим титрованим уведенням анестетика. Хворим другої групи окрім вказаних методів терапії застосовували селективну деконтамінацію кишок шляхом застосування рифаксиміну та фідаксоміцину.
Методика проведення прокінетичної терапії, пролонгованої перидуральної анестезії та селективної деконтамінації кишок була такою: прокінетик тримебутину малеат застосовувався внутрішньовенно або внутрішньом’язово по 50–100 мг (1–2 ампули) два рази на добу.
Перидуральна анестезія з метою стимуляції кишечника проводилась на рівні TXII-LI. З місцевих анестетиків застосовувався 0,25% бупівакаїн. Після ідентифікації перидурального простору одномоментно вводили 20 мл місцевого анестетика, проводилась катетеризація перидурального простору та розпочиналось пролонговане введення місцевого анестетика за допомогою еластомерної помпи зі швидкістю 8 мл на годину. Відповідно до зменшення проявів СГІД темп інфузії знижували до 2 мл на годину з подальшим припиненням введення анестетика.
Селективна деконтамінація кишок проводилась за допомогою рифаксиміну та фідаксоміцину: рифаксимін застосовувався по 2 таблетки, які подрібнювались для введення через зонд, 3 рази на добу. Добова доза становила 1200 мг рифаксиміну курсом 7–10 днів. Фідаксоміцин застосовувався по 1 таблетці (200 мг) кожні 12 годин протягом 10 днів. Таблетки після їх подрібнення вводились через зонд.
Усім хворим проводили загальноклінічні та біохімічні дослідження крові. З метою діагностики ознак SIRS визначали параметри, що характеризують наявність та динаміку загальної відповіді організму на запалення. Інтегральна оцінка тяжкості стану хворих визначалася за шкалою АРАСНЕ ІІ, тяжкість поліорганної дисфункції — за шкалою SOFA.
Стадійність синдрому гастроінтестинальної дисфункції та тяжкість його проявів визначалась за модифікованою нами шкалою, що була створена на основі шкали оцінки гастроінтестинальної недостатності LIFE (Lausanne Intestinal Failure Estimation) (табл. 1). Кожен показник, що вказує на наявність гастроінтестинальної дисфункції, ми оцінювали в певну кількість балів залежно від його вираженості. Відповідно до кількості балів ми виділили три ступені тяжкості ГІД: компенсовану (1–2 бали), субкомпенсовану (2–3 бали) та декомпенсовану (3–4 бали).
Враховуючи те, що ініціаторами розвитку SIRS є молекулярні медіатори запалення, серед прозапальних цитокінів визначали фактор некрозу пухлини (TNF) та інтерлейкін-8 (IL-8). Обидва цитокіни визначали за допомогою твердофазового хемілюмінесцентного імуноферментного аналізу й тестів IMMULITE/IMMULITE1000 (TNF-α) та IMMULITE/IMMULITE1000 (IL-8).
З метою контролю та корекції центральної гемодинаміки крім таких показників, як артеріальний тиск, САТ, частота серцевих скорочень (ЧСС), центральний венозний тиск, за допомогою ультрасонографії (апарат Aloka SSD-500/SL-450, Siemens, Німеччина) визначали серцевий індекс (СІ).
Дослідження газового складу крові проводили апaратом ABL-520 фірми Radiometer Copenhagen (Данія). За величиною СІ та отриманими даними газового складу крові розрахунковим методом (Усенко Л.В., Шифрин Г.А., 1995, 2007; Корячкин В.А., Страшнов В.И., Чуфаров В.Н., 2001) визначали величини постачання та споживання кисню (DO2-VO2), співвідношення раО2/FiO2. Енергетичний баланс клітини визначали за рівнем глюкози, АТФ, лактату (визначали на біохімічному аналізаторі Doctor Muller Німеччина), пірувату (аналізатор Accutrend, USA).
Рівень ендотоксемії оцінювали за рівнем молекул середньої маси (МСМ) (Андрейчик М.А. і співавт., 1998; Назаренко Г.И., Кишкун А.А., 2002), сорбційною здатністю еритроцитів (СЗЕ) та проникністю еритроцитарних мембран (ПЕМ) (Михайлович В.А. і співавт., 1993).
Дослідження проводили на 1-шу (н1; етап 1), 3-тю (н3; етап 2), 5-ту (н5; етап 3), 7-му (н7; етап 4), 10-ту (н10; етап 5) добу захворювання.
Результати та обговорення
Вихідні показники SIRS, тяжкість стану за шкалою АРАСНЕ ІІ, тяжкість поліорганної дисфункції за шкалою SOFA і її компонента СГІД у хворих першої й другої групи були ідентичними. Загальний стан хворих за шкалою АРАСНЕ ІІ оцінювався в 35,27 ± 1,11 і 35,25 ± 1,71 бала відповідно (р > 0,05). Тяжкість поліорганної дисфункції становила 21,81 ± 1,13 бала і 22,91 ± 1,20 бала за шкалою SOFA (р > 0,05). У хворих обох груп було діагностовано СГІД у стадії декомпенсації.
На момент надходження у відділення інтенсивної терапії (ВІТ) рівень TNF-α у хворих першої та другої групи становив 275,5 ± 10,5 пг/мл та 285,9 ± 14,1 пг/мл (р > 0,05); рівень IL-8 — 2770,101 ± 37,250 пг/мл (р > 0,05) і 2610,111 ± 29,730 пг/мл (р > 0,05). У хворих першої групи протягом усього періоду дослідження не було відмічено вірогідної динаміки фактора некрозу пухлини і IL-8 (табл. 2). Вірогідне зростання рівня TNF-α наставало на н5 етапі дослідження у пацієнтів другої групи (355,9 ± 19,1 пг/мл, р < 0,05). Рівень IL-8 зростав на н7 етапі дослідження (3020,65 ± 18,88, р < 0,05).
Вірогідне зниження температурної реакції організму наставало у хворих другої групи на 7-му добу проведення інтенсивної терапії (ІТ), у хворих першої групи протягом усього періоду обстеження температура тіла утримувалася на субфебрильних цифрах. Аналіз динаміки частоти серцевих скорочень показав, що вихідне значення ЧСС було однаковим в обох групах, у хворих основної групи зменшувалося на н3 етапі дослідження (100 ± 5 уд/хв, р < 0,05). У хворих контрольної групи вірогідне зменшення ЧСС наставало на 5-ту добу проведення інтенсивної терапії (табл. 3).
Тахіпное та співвідношення рaO2 /FiO2 у хворих обох груп на момент їх надходження до ВІТ також були практично однаковими. Вірогідне зменшення частоти дихання виникало лише у хворих другої групи на н7 етапі дослідження (20 < 2 рухи в 1 хв, р < 0,05), і це корелювало з динамікою співвідношення рaO2/FiO2 (r = 0,76 при р < 0,05).
На початку ІТ у другій групі хворих кількість лейкоцитів у периферичній крові була вірогідно більшою, ніж у хворих контрольної групи (20,8 ± 2,5 % і 19,1 ± 2,5 % відповідно, р < 0,05). Проте вже на третю добу проведення ІТ кількість лейкоцитів у периферичній крові у хворих другої групи вірогідно зменшувалася порівняно як із хворими першої групи, так і з вихідним значенням. У хворих першої групи кількість лейкоцитів та кількість незрілих форм на всіх етапах дослідження були вірогідно більшими порівняно з хворими основної групи (табл. 3).
У першу добу захворювання у хворих обох груп спостерігалося зростання СІ до супранормальних значень (табл. 4). Незважаючи на це, покращити процес постачання-споживання кисню на цьому етапі дослідження не вдавалося. Лише на 3-тю добу у хворих основної групи збільшилося постачання кисню до нормальних величин і, що найголовніше, забезпечувалось його нормальне споживання.
У хворих контрольної групи постачання кисню підвищувалося на 5-ту добу проведення інтенсивної терапії (644,5 ± 21,3 мл/хв · м2, р < 0,05), як і його споживання (182,10 ± 9,23 мл/хв · м2, р < 0,05). Проте і на цьому етапі дослідження показники патерну DО2-VO2 у хворих першої групи були вірогідно нижчими від показників хворих, яким у алгоритм інтенсивної терапії декомпенсованого СГІД було введено селективну деконтамінацію кишок. У хворих цієї групи нормалізація показників патерну DO2-VO2 супроводжувалася зменшенням показника 2,3-ДФГ (5,1 ± 0,2 мкмоль/мл, р > 0,05) (кореляційний обернений зв’язок, r = –0,56 при р < 0,05) та зростанням макроергів еритроцитів (АТФ = = 3,43 ± 0,12 мкмоль/1 г Нb) (прямий кореляційний зв’язок, r = 0,68 при р < 0,05). Такі дані свідчать про покращання тканинного дихання та відновлення енергодефіциту в еритроцитах.
Вихідні значення рівня ендогенної інтоксикації (показники лейкоцитарного індексу інтоксикації (ЛІІ), МСМ, СЗЕ, ПЕМ) у хворих обох груп між собою суттєво не відрізнялися (табл. 5). ЛІІ у хворих другої групи на 3-й день проведення ІТ вірогідно відрізнявся від аналогічного показника хворих першої групи (р < 0,05). Величина середньомолекулярних пептидів на 3-тю добу перебування у ВІТ у хворих другої групи була вірогідно меншою порівняно як з вихідним значенням (р < 0,05), так і з відповідним показником хворих першої групи (р < 0,05). У подальшому (5-та, 7-ма та 10-та доба) ця тенденція посилювалася.
Вірогідне зниження СЗЕ (р < 0,05) у хворих другої групи наступало протягом перших 3 діб проведення ІТ, тоді коли зниження цього показника у хворих першої групи зафіксовано лише на 5-ту добу ІТ, що вказує на більш швидке зниження рівня ендогенної інтоксикації у хворих, яким в протокол ІТ було включено селективну деконтамінацію кишок.
Низькі показники проникності еритроцитарних мембран (один із досліджуваних маркерів ендотоксикозу) свідчать про надзвичайно тяжкий стан хворих і про те, що тривалий вплив токсинів призводить до конформації білкового й фосфоліпідного шарів мембрани, її патологічного ущільнення з різким обмеженням транспорту — формується так звана жорстка мембрана. Низький рівень ПЕМ у хворих першої групи на 3-тю добу перебування хворого у ВІТ, швидше за все, свідчить про те, шо ендотоксикоз триває, і це підтримує стан жорсткості мембрани. У хворих другої групи в цей період рівень ПЕМ вірогідно (р < 0,05) зростає до 18,7 ± 0,5 ум.од., і це зростання триває до 5-ї доби (19,6 ± 0,4, р < 0,05), після чого показник ПЕМ повертається до нормального значення. Така його динаміка може вказувати на те, що рівень ендогенної інтоксикації у хворих другої групи нормалізувався на 7-му добу захворювання. У хворих першої групи показник ПЕМ зростав до свого максимального значення (19,8 ± 0,1 ум.од., р < 0,05) і залишався на такому ж рівні на 10-ту добу проведення ІТ (19,0 ± 0,1 ум.од., р < 0,05).
В основі розвитку СГІД лежать порушення перфузії та гіпоксія. Як відомо, рНі може опосередковано вказувати на величину реперфузії кишки. При надходженні хворих до відділення інтенсивної терапії цей показник був низьким і становив 7,1 ± 0,1 і 7,10 ± 0,05 відповідно (рис. 1). На третю добу захворювання у хворих другої групи рНі вірогідно зростав порівняно як з вихідним значенням (7,26 ± 0,05, р < 0,01), так і з відповідним показником хворих першої групи (7,15 ± 0,11, р < 0,01). Зростання показника рНі у хворих другої групи тривало й на 5-ту добу захворювання (7,34 ± 0,05, р < 0,05). Натомість у хворих 1-ї групи значення рНі хоча й зростало порівняно з його вихідним значенням (7,21 ± 0,12, р < 0,05), але було нижчим за відповідний показник хворих основної групи.
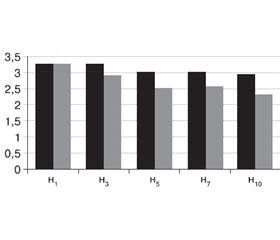
На початку дослідження тяжкість СГІД у хворих обох груп оцінювалася в 3,21 ± 0,21 бала та 3,32 ± 0,12 бала відповідно (р < 0,05). Наприкінці дослідження у хворих другої групи тяжкість СГІД була вірогідно нижчою як порівняно з її вихідним значенням (2,3 ± 0,1 бала, р < 0,05), так і порівняно з тяжкістю СГІД хворих першої групи (2,9 ± 0,2 бала, р < 0,05) (рис. 2).
Тяжкість стану пацієнтів на момент їх надходження до ВІТ за шкалою АРАСНЕ ІІ вірогідно не відрізнялась і становила 35,27 ± 1,11 бала та 35,25 ± 1,71 бала відповідно (р > 0,05). У хворих другої групи тяжкість стану зменшувалася на 5-ту добу проведення ІТ (28,15 ± 1,85 бала, р < 0,05), а у хворих першої групи — на 7-му добу (28,9 ± 0,7 бала, р < 0,05). На 10-ту добу тяжкість стану хворих другої групи була вірогідно меншою, ніж у хворих першої групи (рис. 3).
Динаміка тяжкості стану у хворих із декомпенсованою гастроінтестинальною дисфункцією корелювала з динамікою тяжкості СПОД (r = 0,67 при р < 0,05), вихідні показники якої у хворих обох груп майже не відрізнялися (рис. 3). Зниження тяжкості поліорганної дисфункції у хворих другої групи почалося вже на третю добу проведення ІТ, у хворих контрольної групи — на 5-ту добу лікування (рис. 3).
Отже, гіповолемія, артеріальна гіпотензія, зниження серцевого викиду, компенсаторна вазоконстрикція, порушення мікроциркуляції й периферичне шунтування крові призводять до зниження гастроінтестинальної перфузії, зменшення постачання й споживання кисню, порушення бар’єрної функції кишок з подальшою мікробною й ендотоксиновою транслокацією. Застосування прокінетичної терапії, пролонгованої перидуральної анестезії та селективної деконтамінації кишок приводить до більш швидкого регресу явищ SIRS, що, у свою чергу, сприяє покращенню загального стану хворого, регресу поліорганної дисфункції взагалі та СГІД зокрема. Разом з тим застосування прокінетичної терапії, пролонгованої перидуральної анестезії та селективної деконтамінації кишок сприяє покращанню киснево-транспортної функції крові –(патерн DO2-VO2 , АТФ, 2,3-ДФГ).
Висновки
Застосування прокінетичної терапії, пролонгованої перидуральної анестезії та селективної деконтамінації кишок у хворих із тяжкою черепно-мозковою травмою, поєднаною з травмою кісток скелета, з декомпенсованим синдромом гастроінтестинальної дисфункції приводить не тільки до швидшого регресу ознак дисфункції ШКТ, але і до зменшення летальності на 1,4 %.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
/101-106/104-1.jpg)

/101-106/102-1.jpg)
/101-106/103-1.jpg)
/101-106/105-1.jpg)