Журнал «Здоровье ребенка» 8 (76) 2016
Вернуться к номеру
Morphofunctional Сhanges of Gallbladder and Biochemical Parametеrs of Lipid Metabolism in Children with Liver Steatosis
Авторы: S.O. Babii, N.Yu. Zavgorodnya, I.S. Konenko
SI «Institute of Gastroenterology of the National Academy of Medicine Sciences of Ukraine», Dnipro, Ukraine
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Метою нашого дослідження було дослідити залежність між функціональним станом і структурними змінами жовчного міхура, а також ліпідним обміном у дітей зі стеатозом печінки. Матеріали та методи. Під спостереженням перебувала 51 дитина віком від 10 до 17 років, які за даними ультразвукового дослідження моторно-евакуаторної функції жовчного міхура та транзієнтної еластографії печінки були розподілені на 4 групи: І — 11 дітей із нормокінезією жовчного міхура без стеатозу печінки, що обрано як групу порівняння; ІІ — 20 дітей із гіпокінезією жовчного міхура без стеатозу печінки; ІІІ — 11 дітей із нормокінезією жовчного міхура і стеатозом печінки; IV — 9 дітей із гіпокінезією жовчного міхура зі стеатозом печінки. Оцінювали антропометричні дані: ріст, вагу, окружність талії, індекс маси тіла. Функціональний стан жовчного міхура і його характеристики визначали за допомогою ультразвукової діагностики. Як дослідні маркери ліпідного спектра сироватки крові використано вміст загального холестерину, тригліцеридів, ліпопротеїдів високої та низької щільності, ліпопротеїдів дуже низької щільності і розраховано коефіцієнт атерогенності. Результати. Установлено, що для пацієнтів зі стеатозом печінки характерними були надмірна вага (у 15 % пацієнтів), ожиріння (у 85 % хворих), збільшення об’єму жовчного міхура на 30–50 % (р < 0,05), щільності стінок — на 12–16 % (р < 0,05) і ехогенності стінки — на 24 % (р < 0,05) порівняно з групою без стеатозу і нормокінезією жовчного міхура. Виявлено позитивний зв’язок між товщиною стінки та наявністю стеатозу. Отже, збільшення ваги може бути одним із чинників розвитку розладів біліарної системи та ліпідного обміну. Виявлено, що в 70 % дітей з ожирінням наявні патологічні зміни рівня ліпідів, у тому числі в 74 % — збільшення атерогенних властивостей крові. Висновки. Призначаючи лікування при ожирінні в дітей та підлітків, слід обов’язково здійснювати корекцію функціонального стану жовчного міхура. Тільки комплексний підхід до лікування дасть змогу запобігти розвитку неалкогольної жирової хвороби печінки.
Целью нашего исследования было изучить зависимость между функциональным состоянием и структурными изменениями желчного пузыря, а также липидным обменом у детей со стеатозом печени. Материалы и методы. Под наблюдением находился 51 пациент в возрасте от 10 до 17 лет, которые по данным ультразвукового обследования моторно-эвакуаторной функции желчного пузыря и транзиентной эластографии печени были разделены на 4 группы: І — 11 детей с нормокинезией желчного пузыря без стеатоза печени, которую выбрали в качестве группы контроля; ІІ — 20 детей с гипокинезией желчного пузыря без стеатоза печени; ІІІ — 11 детей с нормокинезией желчного пузыря и стеатозом печени и IV — 9 детей с гипокинезией желчного пузыря со стеатозом печени. Оценивали антропометрические данные: рост, вес, окружность талии, индекс массы тела. Функциональное состояние желчного пузыря определяли с помощью ультразвуковой диагностики. В качестве исследуемых маркеров липидного спектра сыворотки крови использовали содержание общего холестерина, триглицеридов, липопротеидов высокой и низкой плотности, липопротеидов очень низкой плотности и рассчитывали коэффициент атерогенности. Результаты. Установлено, что для пациентов со стеатозом характерными были лишний вес (у 15 % пациентов), ожирение (у 85 % пациентов), увеличение объема желчного пузыря на 30–50 % (р < 0,05), плотности стенок — на 12–16 % (р < 0,05) и эхогенности стенки — на 24 % (р < 0,05) в сравнении с группой без стеатоза и с нормокинезией желчного пузыря. Выявлена положительная связь между толщиной стенки и наличием стеатоза. Таким образом, избыток веса может быть одним из факторов развития нарушений липидного обмена, а также билиарной дисфункции. Выявлено, что у 70 % детей с ожирением имеются в наличии патологические изменения уровня липидов, в том числе у 74 % детей — увеличение атерогенных свойств крови. Выводы. Назначая лечение при ожирении детей и подростков, следует обязательно осуществлять коррекцию функционального состояния желчного пузыря. Только комплексный подход к лечению даст возможность предотвратить развитие осложнений неалкогольной жировой болезни печени.
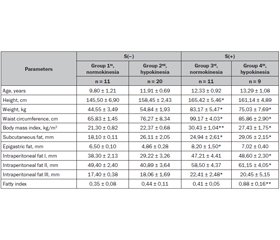
Background. The aim of study was to investigate peculiarities of structural and functional disorders of gallbladder in children with non-alcoholic fatty liver disease. Materials and methods. The study was conducted in 51 children aged 10–17 years. Patients were divided into four groups: the 1st group consisted of 11 children with biliary normokinesia without steatosis; the 2nd group — 20 children with biliary hypokinesia without steatosis; 3rd group — 11 children with biliary normokinesia and steatosis, and the 4th group — 9 children with biliary hypokinesia and steatosis. Anthropometric parameters were measured: height, weight, abdominal circumference, body mass index. Functional state of gallbladder was investigated with the help of ultrasound. Such biochemical parameters, as total cholesterol, triacylglycerols, levels of high-density lipoprotein cholesterol, low-density lipoprotein cholesterol and very-low-density lipoprotein cholesterol were defined, atherogenic index was calculated according to Friedewald formula. Results. Present study shows overweight (in 15 % of patients), obesity (in 85 % of patients), increase in the gallbladder volume by 30–50 % (p < 0.05), in the density of gallbladder wall by 12–16 % (p < 0.05) and its echogenicity by 24 % (p < 0.05) in children with steatosis versus group without steatosis and gallbladder normokinesia. Positive correlation between wall thickness and steatosis has been established. Thus, weight increase may potentially play a role in lipid disorders and biliary dysfunction. The 70 % of children with obesity had pathological changes of lipid levels, such as 74 % — increased blood atherogenicity. Conclusions. Physicians must necessarily correct a functional state of gallbladder during the treatment of obesity in children and adolescents. Only comprehensive approach to the treatment allows prevention of non-alcoholic fatty liver disease and its complications.
біліарна дисфункція; стеатоз печінки; ожиріння; дисліпідемія
билиарная дисфункция; стеатоз печени; ожирение; дислипидемия
biliary dysfunction; steatosis; obesity; dyslipidemia
The article was published on p. 9-14
Introduction
Materials and methods
Results
Discussion
Conclusions
1. Факторы риска развития стеатоза печени у детей / [М.Ю. Степанов, Н.Ю. Завгородняя, О.Ю. Лукьяненко та ін.] // Гастроэнтерология. — 2016. — № 2. — С. 5-9.
2. Auen D. Body mass index, abdominal fatness and the risk of gallbladder disease / D. Auen, T. Norat, L.J. Vatten // Europian Journal of Epidemiology. — 2015. — № 30. — С. 1009-1019.
3. Cholelithiasis and markers of nonalcoholic fatty liver disease in patients with metabolic risk factors / [T. Koller, J. Kollerova, T. Hlavaty et al.] // Scandinavian Journal of Gastroenterology. — 2012. — № 47. — P. 197-203.
4. Tsai C.J. Steatocholecystitis and fatty gallbladder disease / C.J. Tsai // Digestive Diseases and Sciences. — 2009. — № 54. — P. 1857-1863.
5. The diagnosis and management of non-alcoholic fatty liver disease: practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association / [N. Chalasani, Z. Younossi, J.E. Lavine et al.] // Hepatology. — 2012. — № 55. — P. 2005-2023.
6. Завгородняя Н.Ю. Характеристика функционального состояния желчного пузыря и структурных изменений печени при неалкогольной жировой болезни печени у детей / Н.Ю. Завгородняя, О.Ю. Лукьяненко // Гастроэнтерология. — 2016. — № 2. — С. 81-94.
7. Prevalence of fatty liver in children and adolescence / [J.B. Schwimmer, R. Deustch, T. Kahen et al.] // Pediatric. — 2006. — № 118. — P. 1388-1393.
8. Біохімічні маркери порушень ліпідного обміну при стеатозі печінки у дітей / [Н.Ю. Завгородня, С.О. Бабій, І.А. Кленіна та ін.] // Здоровье ребенка. — 2015. — № 8. — С. 38-42.
9. Colak Y. Impaired Gallbladder Motility and Increased Gallbladder Wall Thickness in Patients with Nonalcoholic Fatty Liver Disease [Electronic resource] / Y. Colak, G. Bozbey, T. Erim, O.T. Caklili et.al. // Journal of Neurogastroenterology and Motility. — 2016. — Mode of access.: http://www.jnmjournal.org/journal/view.html?uid=1094&vmd=Full&
10. Пальмера П.Е. Руководство по ультразвуковой диагностике / Под ред. П.Е.С. Пальмера. — Женева: Всемирная ОЗО, 2000. — 334 с.
11. Гончаренко Н.И. Моторно-эвакуаторная функция желчного пузыря у детей с хроническими гепатитами и портальной гипертензией / Н.И. Гончаренко // Перинатология и педиатрия. — 2011. — № 1. — С. 76-79.
12. Уніфікований клінічний протокол медичної допомоги дітям із функціональними розладами жовчного міхура та сфінктера Одді: Наказ Міністерства охорони здоров’я України № 59 від 29.01.2013 р.
13. Петри А. Наглядная статистика в медицине / А. Петри, К. Сэбин. — Москва: ГЭОТАР-Мед, 2003. — 144 с.
14. Day С.Р. Steatohepatitis: a tale of two «hits»? / С.Р. Day, O.F. James // Gastroenterology. — 1998. — № 114. — P. 842-845.
15. Nonalcoholic Fatty gallbladder disease: the influence of diet in lean and obese mice / [M.I. Goldblatt, D.A. Swartz-Basile, H.H. Al-Azzawi et al.] // Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract. — 2006. — № 10. — P. 193-201.
16. Excess membrane cholesterol alters human gallbladder muscle contractility and membrane fluidity / Q. Chen, J. Amaral, P. Biancani, J. Behar // Gastroenterology. — 1999. — № 116. — P. 678-685.
17. Effect of ursodeoxycholic Acid alone and ursodeoxycholic Acid plus domperidone on radiolucent gallstones and gallbladder contractility in humans [Electronic resource] / [I. Tuncer, M. Harman, Y. Colak et al.] // Gastroenterology Research and Practice. — 2012. — Mode of access: https://www.hindawi.com/journals/grp/2012/159438/
18. Ezetimibe ameliorates cholecystosteatosis / [A. Mathur, J.J. Walker, H.H. Al-Azzawi et аl.] // Surgery. — 2007. — № 142. — P. 228-233.
19. Alexopoulos N. Visceral adipose tissue as a source of inflammation and promoter of atherosclerosis / N. Alexopoulos, D. Katritsis, P. Raggi // Atherosclerosis. — 2014. — № 233. — P. 104-112.
20. Jung U.J. Obesity and its metabolic complications: the role of adipokines and the relationship between obesity, inflammation, insulin resistance, dyslipidemia and nonalcoholic fatty liver disease / U.J. Jung, M.S. Choi // International Journal of Molecular Sciences. — 2014. — № 15. — С. 6184-6223.
21. Makki K. Adipose tissue in obesity-related inflammation and insulin resistance: cells, cytokines, and chemokines [Electronic resource] / K. Makki, P. Froguel, I. Wolowczuk // ISRN Inflammation. — 2013. — Mode of access: https://www.hindawi.com/journals/isrn/2013/139239/
22. Resistin-like molecule alpha reduces gallbladder optimal tension / [H.H. Al-Azzawi, A. Mathur, D. Lu et al.] // Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract. — 2007. — № 11. — P. 95-100.
23. Human Adipocytes Induce Inflammation and Atrophy in Muscle Cells During Obesity / [V. Pellegrinelli, C. Rouault, S. Rodriguez-Cuenca et al.] // Diabetes. — 2015. — № 64. — P. 3121-3134.
24. Просоленко К.О. Сучасні підходи до лікування неалкогольної жирової хвороби печінки на фоні метаболічного синдрому / К.О. Просоленко // Ліки України. — 2012. — № 3. — С. 30-34.

/10.jpg)
/11_2.jpg)
/11.jpg)
/12.jpg)